复发性椎动脉夹层1例并文献回顾
周宏星,黎凯锋,黄静,黎杰,张亮,贺雄军,刘亚杰
1 病例介绍
1.1 首次发病 患者男性,29岁,因“突发头痛2天”于2018年12月27日到南方医科大学深圳医院就诊。患者于入院2 d前休息时无明显诱因突发头痛,右侧枕部为主,呈持续性胀痛,阵发性加重,严重时自觉难以忍受。本院门诊头颅CT提示:右侧小脑半球大片状低密度影,拟“头痛原因待查”收入院。
既往史:否认“高血压、糖尿病、冠心病”等慢性病史。
入院查体:脉搏69次/分,血压126/83 mm Hg。神志清楚,对答切题,双侧瞳孔等大等圆,直径3.0 mm,对光反射灵敏,眼球活动正常,未见眼震,双侧额纹、鼻唇沟对称,伸舌居中。四肢肌张力、肌力正常,双侧腱反射(++),病理征未引出,双侧指鼻试验、跟膝胫试验稳准,脑膜刺激征阴性。
实验室检查:同型半胱氨酸30.61 μmol/L,总胆红素33.30 μmol/L,直接胆红素5.50 μmol/L,间接胆红素27.80 μmol/L。尿常规:尿胆原(+),尿酮体弱阳性(±)。血常规、大便常规、糖化血红蛋白、电解质、肾功能、凝血功能、血脂正常。
心电图、心脏彩超均正常。肝胆脾胰彩超:脾脏稍大。
头颅MRI平扫+增强(2018-12-27):右侧小脑半球、中脑右侧、右枕叶缺血性改变,考虑血管源性病变,头颅MRA、椎-基底动脉平行解剖磁共振成像(basi-parallel anatomical scanning,BPAS)未见异常。
头颈部CTA(2018-12-27):右侧大脑前动脉A1较对侧纤细;右椎动脉V3段管腔重度狭窄(图1A)。
诊疗经过:根据影像检查考虑脑梗死,住院后给予抗血小板治疗(阿司匹林100 mg/d、氯吡格雷75 mg/d),阿托伐他汀降脂,甘露醇脱水,以及止痛等对症治疗。进一步完善椎动脉MRI(2018-12-29):MRA示右椎动脉V3段管腔重度狭窄70%~80%(图1B~C),HR-MRI黑血序列示管壁明显增厚,管壁高信号考虑壁间血肿(图1D),增强扫描管壁明显强化。根据HR-MRI检查考虑动脉夹层,予停用抗血小板治疗,改用抗凝治疗(达比加群110 mg,每日2次),住院1周后患者头痛好转出院。
出院诊断:

随访:出院后规律使用口服抗凝药物。3个月后复查椎动脉MRI(2019-03-24):颈部MRA结合HR-MRI黑血序列示右椎动脉V3段原管腔狭窄明显缓解(图2)。6个月后复查椎动脉MRI(2019-06-30):右椎动脉V3段管腔正常。
1.2 夹层复发 首次发病16个月后,患者因“反复头痛”于2020年4月26日再次入院。患者入院前5 d因右肩部疼痛在当地医院行理疗后出现头痛,以枕部为主,呈紧缩性疼痛,偶有搏动胀痛感,伴轻微头晕,持续5~6 h后自行缓解。本院门诊查头颈部MRA提示:右侧椎动脉V2段节段性变细,管腔重度狭窄(图3A),右侧椎动脉V2段横断面血管双腔征(图3B)。
入院神经系统查体无明显阳性体征。全脑DSA提示右侧椎动脉V2段节段性管腔变细,前向血流正常(图3C)。患者出现右侧椎动脉夹层复发,但此次无缺血性脑血管事件,表现为单纯性头痛,且夹层部位前向血流正常,无介入手术指征,给予抗凝(达比加群110 mg,每日2次)等药物治疗,患者头痛好转出院,门诊随诊。
最终诊断:
右侧椎动脉V2段夹层并管腔重度狭窄
2 讨论
颈部动脉夹层所致缺血性卒中的发生率低,却是青年卒中的重要原因,占青年卒中的8%~25%[1-2]。颈部动脉夹层的病因分为自发性和创伤性,自发性夹层常见于患有纤维肌发育不良、常染色体显性多囊肾、先天性结缔组织病(如马方综合征)等疾病的患者[3]。严重外伤或轻度机械刺激也可导致颈部动脉夹层,据报道超过40%的颈部动脉夹层与轻度机械刺激有关[4],比如颈部推拿按摩、球类运动、跳舞,甚至是打喷嚏都有可能引发动脉夹层。本例患者第一次动脉夹层无明确诱因,可能属于自发性夹层,第二次夹层有明确的颈部理疗诱因,属于创伤性夹层。但也有观点认为自发性夹层大多数是由那些被患者遗忘或认为不重要的轻微外伤所致。

图1 首次发病时椎动脉血管成像
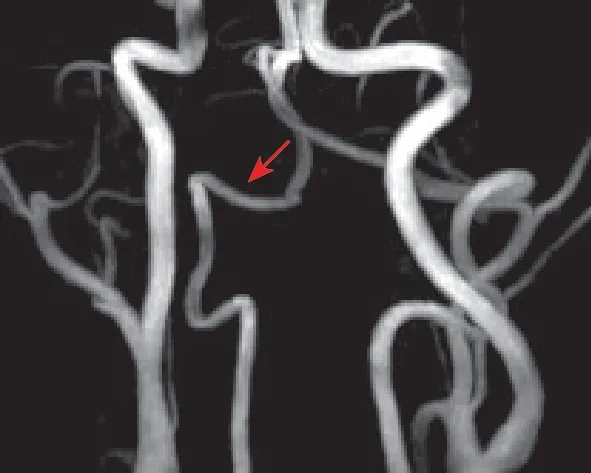
图2 发病3个月后MRA图像

图3 夹层复发后的头颈部MRA和DSA图像
椎动脉夹层临床上主要表现为颈部疼痛、头痛、后循环脑梗死。本例患者两次椎动脉夹层发病均表现为单纯性头痛,如果询问病史时忽视颈部理疗的诱因,则容易误诊为紧张性头痛,尤其在该患者第二次发生椎动脉夹层后。因此,对于存在头痛、颈部疼痛,同时有颈部机械外力损伤病史的患者,则首先考虑排查动脉夹层。这时需进一步影像学检查明确夹层的诊断,最具有诊断意义的影像学特征是DSA、MRA、CTA上内膜瓣或双腔征[5]。此外,以下典型影像学征象也具有诊断价值:①DSA上存在非特异性夹层征象,如串珠样、锥形闭塞(火焰征);②MRA上可见与DSA一致的串珠样、线样征、锥形闭塞;③T1WI显示壁间血肿。符合以上三个影像学特征中其中一个,并且随访发现明确的血管变化,也可诊断动脉夹层[6]。本例患者首次椎动脉夹层影像学特征是HR-MRI黑血序列上存在壁间血肿,多次随访复查MRI提示血管腔逐渐恢复正常。第二次椎动脉夹层的诊断主要依靠MRA上的双腔征和DSA长节段管腔变细,且患者起病前有颈部理疗史,诊断夹层明确。DSA是诊断脑血管病的金标准,但无法直接观察到血管壁病变,高度怀疑动脉夹层的病例,CTA或HR-MRI能补充更多的诊断夹层的征象,如双腔征、壁间血肿,在血管壁病变评估方面较DSA更有优势。
颈部动脉夹层复发率较低[7],一项对432例颈部动脉夹层患者进行31个月的随访研究中,仅有4例患者出现夹层复发,其中2例夹层复发导致缺血性卒中[8],这也提示颈部动脉夹层相关的卒中再发风险较低。颈部动脉夹层复发的位置多数不在原先病变的血管,一项研究对103例连续性的夹层病例进行为期4年的跟踪随访,发现5例患者出现颈部动脉夹层复发,其中有4例患者动脉夹层复发出现在另外一侧颈部动脉[9]。本例患者所不同的是,先后两次夹层均在同一侧椎动脉,分别是V3段和V2段。大多数颈部动脉夹层的患者没有传统的脑血管病危险因素,夹层发生和复发的危险因素尚不清楚[10]。相对来说,自发性颈部动脉夹层更容易复发,其血管本身可能有一定的遗传因素及容易产生夹层病变的基础。Ohta等[11]报道1例双侧颈内动脉自发性夹层的卒中患者,发病12年后在上呼吸道感染后复发双侧颈动脉夹层,该报道认为患者可能存在弹性纤维异常的疾病基础,感染只是可能起到触发夹层的作用。但是,Kloss等[12]对282例颈动脉夹层患者进行平均52个月的随访,17例(7.1%)在1个月以后夹层复发,该研究还对其中108例(45.4%)患者的真皮结缔组织形态学进行了研究,但未发现皮肤结缔组织异常与复发夹层相关。
动脉夹层的治疗包括夹层相关的急性缺血性卒中溶栓治疗、急诊血管内介入治疗,以及预防卒中复发的抗栓治疗。抗栓药物主要是抗血小板聚集和抗凝药物。动脉夹层卒中复发主要原因之一是血栓脱落引起远端血管栓塞,理论上,抗凝治疗对预防血栓形成和血栓脱落的效果会优于抗血小板治疗。但是对于合并缺血性卒中的动脉夹层患者,抗凝治疗可能增加出血风险,现有的临床证据显示抗血小板聚集和抗凝对预防夹层相关的缺血性卒中复发无明显差异[13]。关于这两类抗栓药物对动脉夹层早期愈合是否有差异,动脉夹层引起的血管狭窄或夹层动脉瘤是否需常规进行手术干预,这些问题目前尚不清楚。
综上所述,椎动脉夹层可以单纯表现为颈后部头痛,也可以表现为后循环缺血症状,甚至在颅内的椎动脉发生夹层动脉瘤破裂时可导致脑出血症状。对于有颈部按摩理疗等病史的患者,MRA、CTA、DSA,尤其HR-MRI可以帮助早期诊断动脉夹层。动脉夹层复发危险因素尚不清楚,抗栓治疗是预防的基础,同时应避免各种诱发动脉夹层的机械外力因素。

点评专家:霍晓川 副主任医师
E-mail:huoxiaochuan@126.com
工作单位:北京天坛医院神经介入中心
主要研究方向:出血及缺血性脑血管病介入治疗
专家点评:
颅外椎动脉夹层是缺血性卒中的少见病因,却是青年卒中的常见病因,建议对年轻患者、尤其是无常见脑血管病危险因素的缺血性卒中患者进行筛查,本病例通过MRA、HR-MRI和DSA诊断夹层。对于动脉夹层的治疗,应根据临床实际情况及患者个体化选择治疗方案。在颈部动脉夹层形成的急性期,使用抗血小板或抗凝治疗,通常维持3~6个月。目前,缺乏足够的证据推荐在颈部动脉夹层患者中常规开展血管内介入治疗或手术治疗,如在积极药物治疗基础上仍有缺血性事件发生,可考虑血管内介入治疗或手术治疗。但血管内介入治疗或手术治疗的有效性及安全性有待进一步研究。本病例夹层的复发容易考虑到血管本身问题,在外力作用下,再次发作。因此,应针对有夹层病史的患者,开展评估和干预颈部动脉夹层的危险因素,以减少颈部动脉夹层复发。
——以渤海A 油藏为例

