泛素连接酶UBE4B的研究进展
陆 瑶, 赵 博, 武正华
(上海交通大学 药学院, 上海 200240)
泛素是一种由76个氨基酸组成的分子量约为8.5 ku的蛋白质。泛素(Ub)与泛素激活酶(E1)、泛素结合酶(E2)、泛素连接酶(E3)和底物蛋白一起构成了泛素化途径,作为一种蛋白质翻译后修饰过程(Post-translational modification, PTM)[1],在体内参与了蛋白降解、细胞凋亡、转录调节、DNA修复及免疫信号转导等一系列重要生命活动[2-3]。
泛素连接酶E3是泛素化体系中数量最多、调控机制最复杂的酶,也是泛素化体系中直接负责底物识别的部分。E3种类繁多,但是它们都含有能与E2结合的保守结构域。根据E3结构域的不同,E3可被分为HECT家族(Homologous to E6-associated protein C-terminus)、RING-Finger家族(Really interesting new gene)和RBR家族(RING-in-between-RING)[4]。在RING家族中,某些E3具有一种约70个氨基酸组成的特征性U-box结构域[5],因此它们也属于U-box家族成员。UBE4B(简称E4B)隶属于U-box家族泛素连接酶,大小约为146 ku。
随着近年来泛素领域研究的愈发深入,UBE4B作为一种重要的泛素连接酶,参与了胚胎发育、神经元保护等生命活动,并被发现与多种癌症、神经退行性疾病的发生发展有关[6-7]。这些发现凸显了UBE4B的研究意义,本文从UBE4B的结构特征、E4活性、特异性底物功能以及其在多种疾病中的重要作用进行综述,讨论了UBE4B对于特异性底物蛋白进行泛素化后可能具有的生理功能和对机体造成的影响。
1 UBE4B的来源与发现
从UBE4B的发现到现在已经过去了20余年,最初Johnson等[8]通过分析泛素-β-半乳糖苷酶融合构建物的稳定性,发现了一条泛素融合降解途径(Ubiquitin fusion degradation, UFD),并确定了该途径涉及的5个基因,分别是Ufd1-Ufd5。Koegl等[9]基于树脂亲和洗脱和质谱分析,从酿酒酵母中分离鉴定了UFD2,发现该蛋白可以作为E4因子促进泛素链的延长。UBE4B(也称UFD2a)是UFD2的哺乳动物同源物,因E4活性得名UBE4B[10]。随后Hatakeyama等[11]提出,UBE4B作为U-box家族成员,是一种新型的E3,且在哺乳动物体内高度保守。UBE4B已被确认参与p53、EGFR等重要蛋白的降解,目前是泛素领域研究的热门泛素连接酶。
2 UBE4B的结构特征与生物学功能
2.1 U-box家族E3 UBE4B
UBE4B具有特征性的U-box结构域,删除U-box结构域或者对其中的保守氨基酸序列进行点突变,则E3酶活性丧失,说明了U-box家族E3的酶活性是由完整的U-box结构域决定的[11]。通过序列与结构对比(图1),U-box与RING结构的保守序列中有着相似的3条链、一个螺旋结构和一个特殊的环状结构,但是U-box结构域缺乏RING-锌指结构中螯合的锌离子和标志性的半胱氨酸与组氨酸残基[12]。U-box与RING结构的相似性关联了二者传递Ub功能的相似性,成为将U-box E3划分为RING家族的有力证据。
2.2 UBE4B的E3与E4活性
E3催化底物形成泛素链对于蛋白质降解过程至关重要,但是在完成泛素化之前底物脱离E3,形成的泛素标签容易脱去,底物也将逃过被泛素化的命运[13]。UBE4B作为一类U-box型E3,可以与E1、E2一起进行泛素级联反应,将Ub传递对应的底物蛋白上,完成泛素化过程。UBE4B还可作为特殊的泛素连接E4[9]:一种在E1、E2、E3已经完成底物的泛素化标记后,继续延长底物泛素链的泛素连接酶。如图2所示,在缺乏UBE4B时,虽然某些E1-E2-E3体系可以在对应底物上传递少量泛素,但是并不能够形成足够长的泛素链以启动蛋白酶体降解,UBE4B可以识别底物的K29泛素链,继续帮助泛素链延伸[9]。E4与E3的区别在于:E4不参与硫酯键形成,且不与底物相互作用[9]。目前有几种可能的机制解释E4介导的多聚泛素化过程:1)E4改变E2与E3的作用模式或改变E2-E3复合物的构象,改变E2或者HECT E3的泛素结合活性位点,以限制泛素从E2或者HECT E3转移到底物;2)E4可能作为泛素连接持续促进因子,提高泛素链的延长效率[14]。虽然对于UBE4B可作为E4参与泛素链延长已有一定认识,但是目前的研究方法还不能直接区分UBE4B在特定底物泛素化中扮演的角色,如何分辨E3与E4还需要进一步探明。
3 UBE4B的底物
UBE4B可以作为E3或者E4与底物蛋白相互作用,已有许多针对其底物功能的研究,包括p53家族蛋白[15, 28-29]、ataxin-3[16]、FEZ1蛋白[17]、激酶Mps1[24]和EGFR[18, 23]等。这些底物蛋白大部分参与机体的重要生命活动,或与疾病发生发展有重要关系。
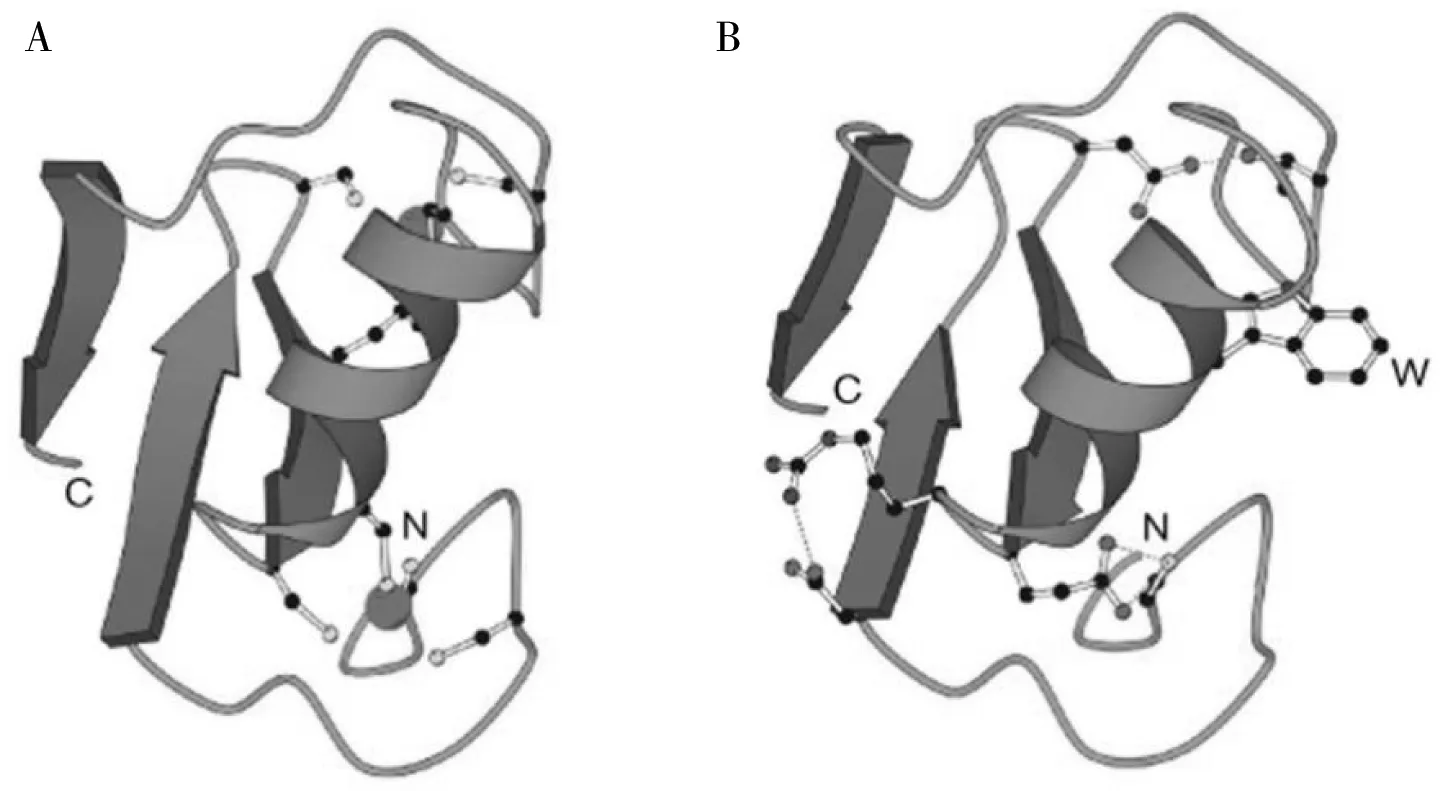
图1 RING结构域 (A)与U-box结构域(B)[12]

图2 UBE4B作为E4延伸泛素链
研究发现,UBE4B的过表达极大程度降低了各种类型细胞中p53蛋白的含量[15]。抑癌蛋白p53是泛素连接酶Mdm2的底物,Mdm2的人类同源物也叫作Hdm2,可以靶向作用于Ser-15和Ser-392位丝氨酸磷酸化的p53,使其快速降解[19-20]。在几种脑部肿瘤和神经管细胞瘤细胞系中观察到UBE4B蛋白表达量升高,且在这些肿瘤细胞系中,UBE4B的表达与p53的表达呈负相关,UBE4B可能作为E4,参与了Hdm2介导的p53泛素化和降解[15]。MicroRNA-1301可以直接靶向作用UBE4B,显著下调该基因表达,降低内生UBE4B蛋白以激活p53功能[21]。除p53之外,p53家族的其他两个成员p63[5]和p73[22]也可以与UBE4B相互作用。Ataxin-3是一种与DNA损伤修复有关的去泛素化酶(Deubiquitinase,DUB),能够被泛素化降解。细胞中过表达的UBE4B可以促进异常聚积的ataxin-3降解,而UBE4B的失活突变体则无法促进异常蛋白降解;UBE4B无法在仅存在E1、E2的条件下使ataxin-3泛素化,暗示UBE4B在ataxin-3泛素化降解途径中可能作为E4发挥作用[16]。FEZ1是一种与神经突触延伸相关的蛋白,UBE4B可以发挥E3活性,在FEZ1上形成K27泛素链,且这一泛素化过程不会降解底物[17]。UBE4B可以有效降解EGFR,通过调控EGFR泛素化来促进其在胞内的分选和信号转导[18, 23]。激酶Mps1参与了纺锤体形成、染色体复制,UBE4B可以调控激酶Mps1的泛素化,形成K48泛素链[24]。上述蛋白虽已被证明是UBE4B的底物,但是形成的泛素链类型与功能还值得进一步研究。
探究E3特异性底物及其生理功能是泛素领域的一个研究热点,但泛素化调控网络错综复杂,不同底物形成的泛素链类型和功能不同,明确UBE4B的对应底物、解密形成的泛素链种类有助于确定药物作用靶点,针对性治疗相关疾病[25]。在已鉴定的部分UBE4B底物中(表1),研究者采用酵母双杂交系统[15, 17, 23, 26]或从组织样本中进行基因分析[24, 27]寻找与UBE4B相互作用的蛋白,但是这些方法特异性较低且耗时耗力,可能存在假阳性结果,需要经过多重手段验证,无法大批量直接筛选UBE4B潜在底物。正交泛素转移途径(Orthogonal ubiquitin transfer, OUT)利用噬菌体展示技术,定点突变Ub、E1、E2和E3,构建一条体内正交泛素传递链,将人工改造后带有标签的Ub模拟天然泛素传递过程,寻找携带标记Ub的蛋白,可以准确地发现某种E3的大量底物[28-30]。通过这种方法,我们已经确定了180余种UBE4B潜在底物,且部分底物已在胞内验证(表1)[29],未来还将对重要底物的生理功能进行进一步探索。

表1 UBE4B底物的生理作用和相关疾病
4 UBE4B与相关疾病
UBE4B在泛素化途径中扮演着重要的角色,参与了多种蛋白的降解。泛素化系统异常导致的蛋白质错误聚积或提前降解与多种疾病的发生发展密切相关,因此UBE4B在体内的表达异常可能与多种疾病或病理状态有关。
4.1 UBE4B影响癌症发生发展
UBE4B可作为癌基因或者抑癌基因在不同类型的癌症中发挥相反的功能。在人类肝癌细胞系中敲除UBE4B可以减缓肝癌细胞生长,诱导其凋亡。通过对多个临床样本进行分析发现,UBE4B的过表达促进了肝癌的发生发展和迁移侵袭[31]。不仅如此,目前还发现了UBE4B在乳腺癌[32]、鼻咽癌[27]、神经管细胞瘤[15]以及人肾细胞癌[33]中,在癌细胞系SH‐SY5Y、SAOS‐2、H1299和Neuro2a中高度表达[31]。裸鼠模型中也发现,过表达UBE4B的肿瘤细胞比正常表达UBE4B的肿瘤细胞生长速率更快[32]。UBE4B在神经母细胞瘤组织中则是作为抑癌基因存在的,UBE4B水平与RAS / MAPK途径活性呈负相关,缺失UBE4B基因的神经母细胞瘤不容易分化,其患者在临床上表现出明显的预后不良[7]。UBE4B的过表达可以降低神经母细胞瘤的增殖,减少肿瘤组织中EGFR的表达[18]。
4.2 UBE4B与神经退行性疾病的联系
UBE4B可以调控神经系统发育,可能与某些神经退行性疾病有关,有望成为神经退行性疾病的治疗靶点。Ataxin-3异常聚积会引起遗传性神经退行性疾病Machado-Joseph症,UBE4B与异常Ataxin-3蛋白的多聚泛素化有关[16]。小鼠Wallerian变性模型中发现UBE4B可以保护小鼠的神经元,延迟Wallerian变性[5]。总之,目前研究表明UBE4B对于神经系统具有一定保护作用,但是具体作用机制还需进一步研究。
4.3 UBE4B与其他疾病
在UBE4B转基因小鼠和大鼠模型中,研究者发现UBE4B的增加可能导致下丘脑神经细胞内蛋白的异常积累、神经元变性和功能损伤,从而导致食物摄入和能量代谢紊乱。下丘脑饱腹感中枢的功能障碍会引起UBE4B转基因动物模型肥胖,发生瘦素和胰岛素抵抗,葡萄糖耐受不良,高胆固醇血症等症状[34]。UBE4B在胚胎发育过程中可以保持心脏正常发育和保护神经元免于轴突变性[35]。敲除UBE4B基因的小鼠表现出神经系统轴突发育障碍,同时伴随内质网应激的浦肯野细胞变性和心肌细胞凋亡,表明UBE4B可以维持神经元细胞内环境并保护它们免受内质网应激和其他类型的细胞应激的影响,保护胚胎正常发育[35]。在人类细胞中,UBE4B基因敲减会导致有丝分裂停滞、染色体异常及细胞凋亡,证明UBE4B对于人类细胞的正常生命活动十分必要[6]。
5 结语
UBE4B是U-box家族兼具E4活性的泛素连接酶,可形成或延长不同种类的泛素链,决定底物的命运,调控重要生命活动进程。但是UBE4B在不同类型的疾病中扮演的角色良莠难辨,现有的研究仍存在不少亟待解决的问题:在不同类型肿瘤中,UBE4B的表达和对患者预后影响存在截然相反的情况,但是没有研究明确指出造成这些差异的机制;UBE4B的下游底物相关信号通路和作用机制研究大多浮于表面,目前报道中仅有经典抑癌蛋白p53的研究较为深入,其他的重要底物如EGFR、OTUB1等研究还不够具体;UBE4B分布较广,组织特异性较差,且针对不同底物蛋白调节作用各异,这给开发药物进行特异性治疗带来了一定的困难。
相信随着研究的逐步推进,未来的研究重点将是UBE4B对应的多种底物生理功能、形成泛素链类型与调控的下游反应。阐明底物蛋白在体内的含量变化对正常生命活动的影响,探索对应疾病的发生机制和新颖治疗手段,为针对UBE4B乃至E3药物开发提供一大优势。

