森林草莓DDM1基因RNAi干扰载体的构建及功能分析
王 蕾, 顾婷婷, 甘立军
(1. 南京农业大学 生命科学学院, 南京 210095; 2. 南京农业大学 园艺学院, 南京 210095)
在植物中,DNA甲基化主要参与了基因的表达调控,进而对植物生长发育产生影响[1]。DNA甲基化会影响植物的生长发育、器官分化等生物过程,尤其是在植物春化作用与开花,正常花器官的形成与发育,内源基因表达和转基因植株的基因沉默等过程中有重要作用[2]。DNA甲基化主要发生在对称的CG, CHG和不对称CHH位点中(H代表A、C或T),其中CG和CHG位点的甲基化是最主要的甲基化形式。DNA甲基化对植物的生长发育主要起调控作用,CG(mCG)位点的甲基化是在DNA复制过程中由甲基转移酶1(Methyltransferase1, MET1)维持,是植物基因组中最丰富的DNA甲基化形式[3-4]。植物特异性染色质域甲基转移酶3(Chromomethylase, CMT3)主要负责CHG(mCHG)位点的甲基化[5-9]。域重排甲基转移酶(Domains rearranged methyltransferase, DRM)的结构和哺乳动物的Dnmt3甲基化酶相似,对CHH非对称位点的从头甲基化及维持失活转座子及转基因沉默位点的胞嘧啶甲基化进行修饰,同时,DRM也参与RNA介导的甲基化过程[10-13]。
DDM1(Decrease in DNA methylation1)是一种Snf2家族的核糖体重塑蛋白,在植物体中对保持CG和非CG位点甲基化起着非常重要的作用[14-15]。DDM1可以通过水解ATP改变核小体的组成和位置,从而允许其他甲基转移酶进入DNA[11,16]。近来的研究表明,拟南芥中DDM1的破坏导致异染色质TEs和其他DNA重复序列中所有类型的DNA甲基化显著减少[15,17-18]。除拟南芥外,ddm1突变体已在玉米和水稻中分离得到,均含有两个ddm1同源基因,在玉米中,两个单一T-DNA插入功能丧失的ddm1突变体显示非CG背景下甲基化显著降低[19]。在水稻中,功能缺失的单突变体Osddm1a和Osddm1b没有明显的表型,但在双突变体中观察到严重的生长缺陷,3种位点的甲基化都有显著的降低[20]。为了探究DDM1基因对森林草莓发育过程的影响,通过构建草莓中DDM1基因的RNAi干扰载体,并通过草莓叶片农杆菌转化方法获得转基因草莓,来降低草莓中DDM1基因的表达量,观察转基因株系的表型,从而进行DDM1基因在草莓生长发育过程中的功能研究,这为以后研究甲基化对草莓生长发育的影响提供理论基础。
1 材料与方法
1.1 材料
二倍体森林草莓(Fragariavesca, Ruegen F7-4),于(25±2) ℃组培室内培养,光周期为16 h/8 h(光/暗)。大肠杆菌DH5α、农杆菌EHA105以及p2300GRN-35S-faq-nos的RNAi表达载体均由本实验室保存。
KOD FX DNA聚合酶(TaKaRa)、限制性内切酶(Thermo Fisher)、rTaqDNA聚合酶、DNA凝胶回收试剂盒、质粒抽提试剂盒等购自Axygene公司;Infusion一步克隆试剂盒购自南京诺唯赞生物公司;引物由南京金斯瑞生物公司合成。
1.2 方法
1.2.1 正向片段DDM1-1的片段的克隆和回收
根据FveDDM1基因全长cDNA序列,利用Snapgene和Primer Premier 5软件设计含有同源臂的引物,以野生型森林草莓的cDNA为模板,分别采用引物F1/R1(表1)进行PCR扩增,获得正向片段DDM1-1(412 bp)。按照KOD FX说明书进行反应体系配制。PCR程序:94 ℃预变性2 min;98 ℃变性10 s;55 ℃退火30 s;延伸温度68 ℃,延伸时间根据扩增片段长度来计算(1 kb/min),最后68 ℃延伸10 min后结束,总共35个循环。使用凝胶回收试剂盒对获取的目的片段进行纯化回收,并置于-20 ℃保存。

表1 本实验所用引物序列
1.2.2 中间载体的构建
用限制性内切酶SalⅠ对p2300GNR-35S-faqr-nos的载体骨架进行酶切后,回收载体片段。将扩增好的含有同源臂的正向片段和回收的载体片段按照Infusion一步克隆试剂盒说明书进行连接。将连接产物转化到大肠杆菌DH5α菌株中,挑取抗卡拉霉素的单克隆进行菌落PCR验证,将鉴定所得阳性重组质粒送公司进行测序,连接正确的重组质粒命名为p35S-DDM1-1-RNAi。
1.2.3 反向片段DDM1-2的扩增和DDM1基因干涉表达载体的构建
以中间载体p35S-DDM1-1-RNAi为模板,利用含有同源臂的引物F2/R2进行PCR扩增,获得反向片段DDM1-2(412 bp)。同时用XbaⅠ对中间载体进行单酶切,进行纯化回收后,与扩增的反向片段DDM1-2进行连接转化,挑取单克隆进行测序验证,同时用Hind Ⅲ和EcoRⅠ对构建好的重组质粒进行酶切验证,能得到1760 bp大小的条带,说明构建成草莓DDM1基因RNAi表达载体p35S-FveDDM1-RNAi。将测序完全正确的重组质粒利用冻融法[21]转入农杆菌EHA105感受态细胞,保存阳性克隆供草莓的遗传转化使用。
1.2.4 草莓外植体的制备
取适量饱满的二倍体草莓的种子通过消毒灭菌后接种于含MS固体培养基的组培瓶中,待长成小苗后,选取叶龄35 d左右、长势一致、叶脉清晰、叶片厚实、叶色不深的嫩叶作为遗传转化的外植体。
1.2.5 农杆菌介导的森林草莓的遗传转化
在悬浮含有表达载体质粒的农杆菌菌液的同时,把选作外植体的草莓叶片在背面用刀片沿垂直叶脉方向轻轻划三刀或四刀。将切好的叶片置于复苏好的菌液中,置于28 ℃摇床100 r/min浸染20 min。将浸染好的叶片的正面贴于共培养培养基(MS-B5+2 mg/L TDZ+0.2 mg/L IBA+100 μmol/L AS)上,黑暗培养3 d后,转入脱菌培养基(MS-B5+2 mg/L TDZ+0.2 mg/L IBA+300 mg/L Ti)中,在弱光下培养15 d左右,观察叶片是否长出愈伤,未长出愈伤的继续脱菌,长出愈伤的外植体移至含有抗生素的筛选培养基(MS-B5+3 mg/L 6-BA+0.2 mg/L IBA+300 mg/L Ti+20 mg/L Kan)上在光下进行筛选培养,培养室温度为22 ℃,为了防止叶片褐化,每2周更换1次培养基。
当有不定芽产生时,将不定芽进行分离。先转移至生芽培养基(MS-B5+2 mg/L 6-BA+0.2 mg/L IBA+300 mg/L Ti+20 mg/L Kan)中培养,待长出叶后将其转入到生根培养基(MS-B5+0.2 mg/L IBA +300 mg/L Ti+20 mg/L Kan)中,待长成完整小苗,有3~5片真叶时,缓苗后移入花盆中。
1.2.6 GUS染色
对转基因草莓叶片进行GUS染色检测,剪取转基因草莓幼叶进行GUS染色,以野生型草莓植株作为对照。37 ℃保温过夜后,用无水乙醇进行脱色,直到所取叶片的表面呈无色,显微镜或肉眼可以观察到叶片边缘组织有明显的蓝色,则表明GUS报告基因已整合到草莓基因组中,并发生了表达。
1.2.7 实时荧光定量PCR
采用RT-qPCR方法,对转基因草莓DDM1基因表达量进行分析,验证RNAi的干扰效率。选用森林草莓的GADPH基因作为内参基因。利用Primer Premier 5.0软件设计RT-qPCR的检测引物,其中FveDDM1基因上、下游引物序列分别为:FveDDM1-F/FveDDM1-R(见表1)。实验所得数据经过软件输出后采用 Microsoft Excel和SPSS对数据进行作图分析,运用△△CT法对基因的相对表达量进行计算。所有样品均设置3次独立生物学重复。
2 结果与分析
2.1 森林草莓FveDDM1基因正向片段DDM1-1扩增
为了构建FveDDM1基因干涉表达载体,以森林草莓的cDNA为模板,选择DDM1基因(GenBank登录号:XM_004289096)上392 bp的片段进行PCR扩增,获得了该基因的一段正向片段(DDM1-1),通过电泳分析,结果显示所获得的目的片段的大小和预期一致(图 1-A)。
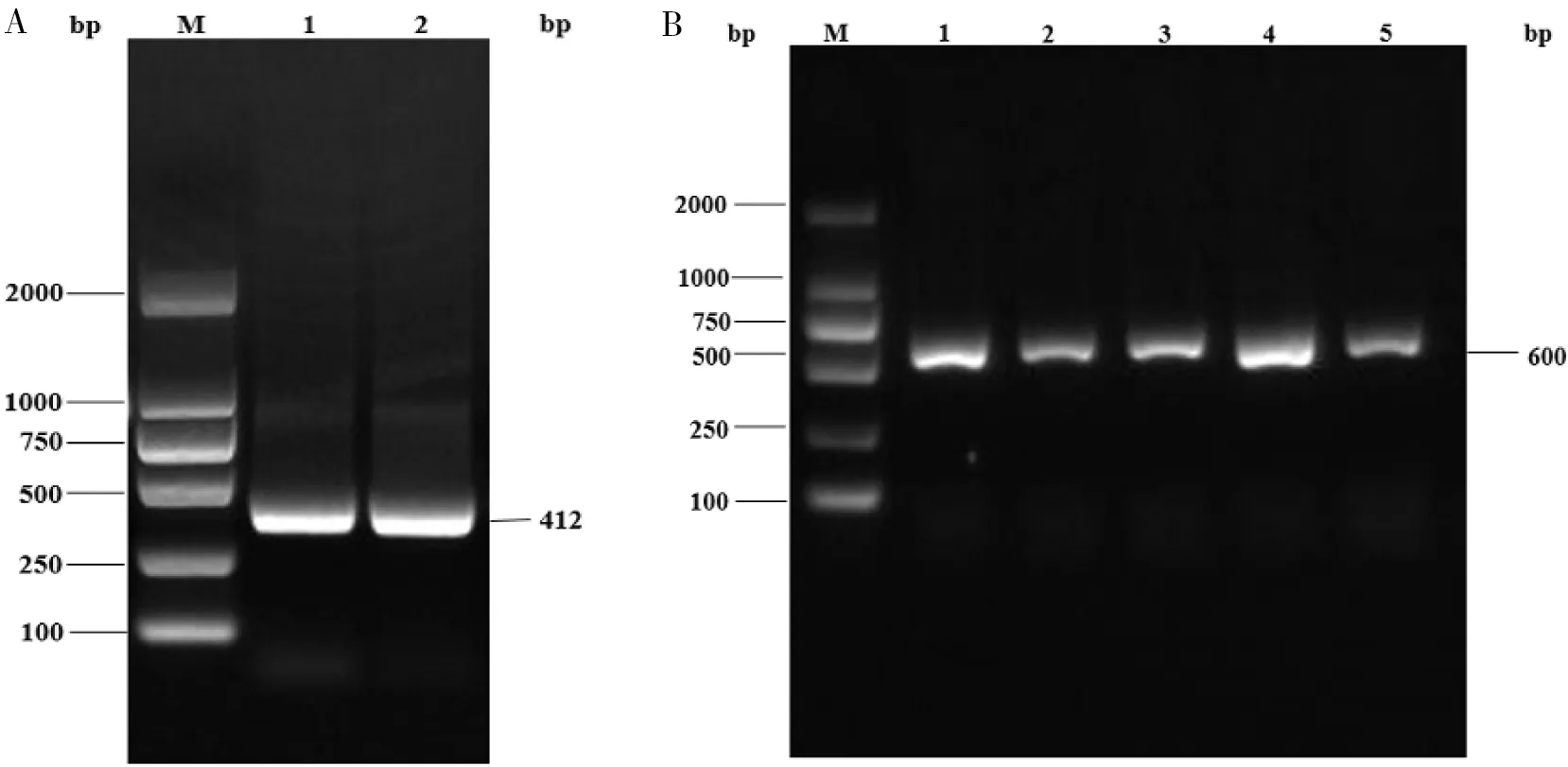
图 1 正向片段DDM1-1扩增(A)和p35S-DDM1-1-RNAi质粒PCR检测(B)
2.2 中间载体的构建
将扩增的正向片段和用SalⅠ单酶切的骨架载体进行连接后,将连接产物进行大肠杆菌DH5α的转化,涂板经抗性筛选后,挑取单菌落进行培养,然后进行菌落PCR验证,经电泳检测后能扩增出600 bp与目的片段大小一致的条带(图 1-B),说明目的片段可能连接到骨架载体上面。将阳性重组质粒送南京金斯瑞测序,结果表明已成功构建p35S-DDM1-1-RNAi中间载体,保存测序正确的重组质粒用于后续实验。
2.3 FveDDM1基因反向片段DDM1-2扩增和干涉载体的构建
以测序正确的重组质粒为模板,利用反向引物F2和R2进行扩增得到反向片段DDM1-2(图 2-A),然后与用XbaⅠ单酶切的中间载体进行一步克隆连接,再将其转入大肠杆菌感受态中,进行Kan抗性筛选后,挑取单菌落进行培养,然后进行重组质粒的提取,用Hind Ⅲ和EcoRⅠ酶切检测结果显示片段大小与预期的大小一致(1760 bp),见图 2-B。将阳性克隆进行进一步的测序检测,结果显示已成功的构建成FveDDM1基因的干涉表达载体,载体结构如图 3所示。将测序结果完全正确的pFveDDM1-RNAi质粒转入农杆菌后,用做森林草莓的遗传转化。
2.4 转基因草莓株系GUS染色鉴定
依据Jefferson等[22]的染色方法,对转基因草莓株系进行GUS染色检测。分别剪取生长在MS培养基上的野生型和转基因型的草莓叶片进行GUS染色,通过脱色可以观察到野生型植株的叶片呈现白色。相比之下,转基因草莓叶片呈现蓝色(图 4),表明GUS基因已经插入到草莓的基因组中,并且进行了表达,说明了草莓转化成功。

M:DNA Marker DS2000。 A图1和2:反向片段DDM1-2 ;B图1、2和3:pFveDDM1-RNAi质粒经Hind III和EcoR I酶切结果

图3 pFveDDM1-RNAi载体结构简图
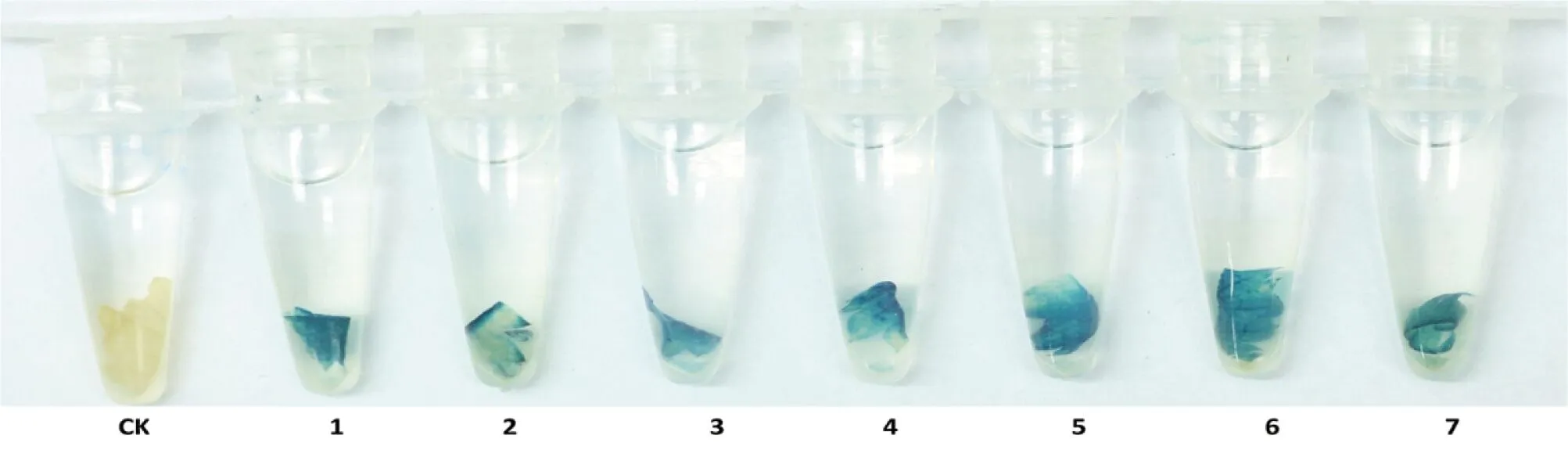
CK:对照(野生型);1~7:不同转基因株系
2.5 转基因草莓中甲基化修饰基因FveDDM1的表达分析

WT:野生型;R1~R4,R6~R7,R9~R11:不同转基因株系。柱状图中字母不同代表显著差异(P≤0.01)
为了进一步验证RNAi的干扰效果,利用RT-qPCR对草莓转基因株系的DDM1基因进行表达分析。结果表示,与野生型相比,转基因草莓不同株系中FveDDM1基因的相对表达出现了显著的下调(P≤0.01)(图5)。
2.6 转基因草莓的表型分析
经过农杆菌浸染、共培养、脱菌、筛选及生根培养等过程,得到了50个独立株系的FveDDM1的RNAi转基因材料,并且已观察到了相应的表型,FveDDM1沉默植株叶片出现了明显的畸形,叶边缘变窄,缺刻变深(图6),各个RNAi株系果实的表型正在观察中。以上现象表明DNA甲基化对草莓的生长发育具有重要的调控作用。

WT:野生型;FveDDM1:RNAi的转基因草莓
3 讨论与结论
近年来,RNA干扰技术发展迅速,由于其能特异并高效的抑制特定基因的正常表达,降低目的基因的表达量,同时还可以进行多代稳定遗传,因此逐渐成为植物基因功能研究的重要遗传学手段[23]。而RNAi技术的关键在于选择目标基因构建高效的RNA干扰表达载体。之前的研究表明,所用的基因RNAi片段在98到853 bp时都能对基因的表达起到很好的抑制效果(抑制效率可达到90%)[24-25]。Wlesley等[26]发现在目的基因的正向片段和反向片段之间插入一个内含子,可以显著提高正义链和反义链RNA形成双链RNA的效率,有利于产生siRNA。在本研究中为了获得较好的干涉效果,所使用的载体在启动子下游的多克隆位点中间包含一个128 bp的内含子,这与胡旭霞和刘耀光[27]在水稻基因RNA干涉载体的设计一致,同时我们所用的RNAi片段长度为392 bp。因此,本研究在进行载体构建时采用了较为理想的实验方案。
先前的研究表明,DNA甲基化对植物形态的建成和发生有很大影响,甲基化的缺失去引起植物一系列异常的表型[3-4]。依据转录组数据,FveDDM1基因在草莓叶片上具有较高的表达[28],表明该基因对草莓叶片的生长发育可能起着重要作用。本研究中我们通过构建FveDDM1基因的沉默载体,来降低FveDDM1的表达。结果发现FveDDM1-RNAi的转基因株系,FveDDM1基因在草莓叶片中的表达量明显降低,并且草莓叶片出现了明显的异常表型,比如叶边缘变窄,缺刻变深。因此,我们推测FveDDM1甲基化基因在维持草莓叶片的正常形态中起着重要作用。

