烟草4 种病毒的多重RT-PCR 检测方法构建
杨 洋,汪 蝶,杨懿德,李林秋,鄢 敏,杨 辉*
1. 四川省烟草公司宜宾市公司,四川省宜宾市叙州区酒都路中段51 号 644002 2. 四川农业大学农学院,成都市温江区惠民路211 号 611130
烟草病毒病是目前烟草生产上分布广泛且发生十分普遍的一大类病害。由于田间烟草病毒复合侵染普遍,各病毒间具有协同或拮抗作用,且各病毒在植株中的丰度有差异等,病毒病的症状具有复杂性和多样性,难以仅依赖症状进行判断。相比电子显微镜观察病毒粒子形态和生物学鉴定等方法,PCR 技术具有准确度高、特异性强和灵敏度高等优点,被广泛应用于植物病毒检测[1-2]。多重PCR 检测则是在单一PCR 只能检测一种病毒的基础上,通过在体系中加入多种不同的特异性引物,调节反应体系和反应条件,从而同时获得多个目标产物,实现对多种病毒病同时检测的技术,适用于目前烟草病毒田间复合侵染的情况。
在烟草病毒的种类调查中,20 世纪80 年代中期,在云南烟区发现烟草蚀纹病毒(Tobacco etch virus,TEV)呈现与烟草普通花叶病毒(Tobacco mosaic virus,TMV)混合侵染烟草的现象[3]。佟爱仔等[4]检测发现云南烟田中烟草蚀纹病毒和烟草脉带花叶病毒(Tobacco vein banding mosaic virus,TVBMV)复合侵染烟草。李金岭等[5]和王秀敏等[6]对陕西烟区烟草病毒病种类进行检测并鉴定出危害烟草的病毒,其中以烟草普通花叶病毒、黄瓜花叶病毒(Cucumber mosaic virus,CMV)和马铃薯Y 病毒(Potato virus Y,PVY)复合侵染的检出率最高。鉴于各烟区存在多种病毒,为实现对烟草病毒的快速检测,已有报道建立了TMV 和CMV,以及TMV、CMV 和PVY 等病毒的多重PCR 检测方法[8-10]。佟爱仔等[11]进行了云南烟草蚀纹病毒与其他病毒复合侵染的多重RT-PCR 检测。郑轩等[12]利用TVBMV 与TMV、TEV、CMV、PVY 的外壳蛋白(Coat protein,CP)基因序列,建立了多重PCR 检测方法。然而,根据郑轩等[12]提供的方法,在人工接种的复合病毒检测中,TVBMV 的检出率低于TMV 和CMV。考虑到复合侵染的病毒间具有协同或拮抗作用,为探究TVBMV 相对低的检出率是否由于在复合侵染中受到其他病毒的拮抗影响,分析TVBMV 与TMV、CMV 和PVY 的相互作用,并通过TVBMV 各基因的筛选,选取表达水平相对较高的基因优化引物,调整引物和cDNA 的模板浓度,旨在建立一种高效、稳定的多重PCR 检测体系,以满足各烟区对烟草病毒病检测的需求。
1 材料与方法
1.1 病叶材料
感染TMV、CMV、PVY 和TVBMV 病毒的烟叶材料由四川农业大学植物病理系提供,包括单独接种TMV、CMV、PVY 和TVBMV 第7 天的烟叶及复合接种TMV、CMV、PVY 和TVBMV 第3 天和第7 天的烟叶。
1.2 试剂
Moloney Murine Leukemia Virus 逆转录酶(M-MLV Reverse Transcriptase)、RNA 酶抑制剂、dNTP 和DL2000 Marker 均购自宝生物工程(大连)有限公司,Taq DNA Mix 聚合酶购自生工生物工程(上海)股份有限公司。
1.3 烟草病叶总RNA 的提取
取烟草病叶0.1~0.3 g 于离心管中,加入液氮研磨成粉末状,分别加入400 μL 的RNA 提取缓冲液及400 μL 酚/氯仿/异戊醇(体积比为25 ∶24 ∶1),充分混匀;12 000 g离心10 min,吸取上清液并加入其两倍体积的4 mol/L LiCl,混合均匀后在-20 ℃下静置沉淀20 min 以上;12 000 g 离心10 min,弃上清液;将沉淀用75%乙醇漂洗,12 000 g离心5 min,弃上清液,于室温下充分干燥沉淀;用去离子水约30 μL 将沉淀溶解后置于-20 ℃冰箱保存,备用[13]。
1.4 反转录
取上述提取的总RNA500 ng,加入浓度为100 μmol/L 的下游引物1.0 μL,于70 ℃水浴5 min,迅速置于冰上;再加入2.5 μL 5×RT buffer,2 mmol/L的dNTP 0.5 μ L,2.5 U RNA 酶 抑 制 剂,2.5 U Reverse Transcriptase(M-MLV),无 菌 水 补 足 至10.0 μL;40 ℃水浴1 h;反转录产物加ddH2O 稀释至30.0 μL,用于后续实验。
1.5 引物设计
使用DNAMAN 6.0 软件比对GenBank 中多条TMV、CMV 和PVY 外壳蛋白序列,以及TVBMV的全基因组序列,选择序列保守区域。使用Oligo 6.0 软件设计引物。引物设计要求目的片段的长度尽量在200~800 bp,长度不宜太接近,以免难以通过琼脂糖电泳进行区分。所得引物通过BLAST比对确保引物特异性良好。引物序列见表1。
1.6 单重PCR
采用25 μL 的PCR 反应体系:2×Taq DNA Mix 12.5 μL;TMV、CMV、PVY 和TVBMV 的cDNA 均为1.0 μL;TMV、CMV、PVY 和TVBMV 的引物浓度均为20 μmol/L,上下游引物加入量分别为各0.5、0.5、1.0 和1.0 μL;用ddH2O 补足至25 μL。PCR反应条件:94 ℃预变性3 min;94 ℃变性1 min;53.5 ℃退火30 s;72 ℃延伸1 min,循环35 次;72 ℃延伸10 min。
1.7 多重PCR
根据各特异性引物片段大小设计合适的PCR反应条件。反应体系为:2×Taq DNA Mix 12.5 μL;cDNA 1.0~1.5 μL;TMV、CMV、PVY 和TVBMV 的引物浓度均为20 μmol/L,分别取上下游引物各0.5~1.5 μL;加ddH2O至25.0 μL。PCR反应条件为:94 ℃预变性3 min;94 ℃变性1 min;退火30 s;72 ℃延伸1 min,循环35 次;72 ℃延伸10 min。设置退火温度梯度:57.5、56.5、55.5、53.5、51.5 和50.5 ℃。

表1 各病毒的特异性引物序列Tab.1 Specific primer sequences for each virus
2 结果与分析
2.1 烟草病叶总RNA 检测
提取含病毒的烟叶总RNA,在1%琼脂糖凝胶上电泳检测,结果如图1 所示。28 S 和18 S 条带清晰,无DNA 条 带;OD260/OD280 比 值 均 在1.7~1.9,表明蛋白质和酚类物质基本去除。LiCL 沉淀法提取的RNA 纯度较理想,可用于后续实验。
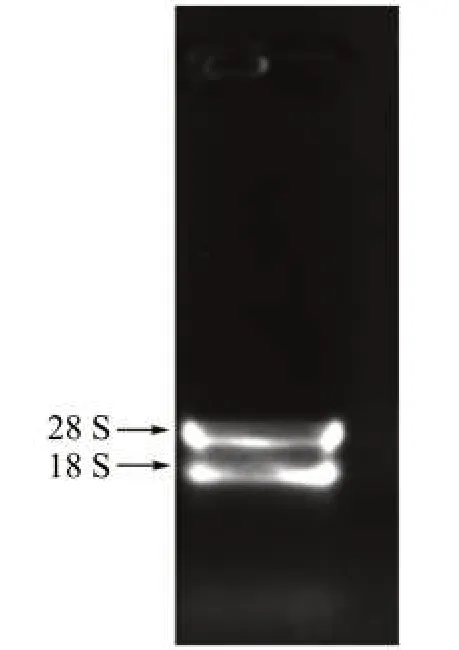
图1 植物总RNA 检测Fig.1 Plant total RNA detection
2.2 TMV 和CMV 的双重PCR 检测体系构建
TMV 和CMV 在单独扩增条件下均能检测出目标病毒。然而,在与单独扩增TMV 和CMV 相同的反应体系和反应条件下,双重PCR 中CMV 未扩增出条带,将CMV 的上下游引物量从各0.5 μL调整至各0.8 μL,结果显示CMV 和TMV 均能扩增出目标条带。使用该反应体系,退火温度设置为57.5、56.5、55.5、53.5、51.5 和50.5 ℃共6 个梯度。扩增结果显示,各退火温度下均能扩增出TMV 和CMV 目标大小条带(图2)。
2.3 TMV、CMV和PVY的3重PCR检测体系构建
PVY 在与TMV 和CMV 相同的单重PCR 反应条件下,反应体系中PVY的上下游引物为各1.0 μL,进行单重PCR,能够扩增检测出目标PVY,然而,在3 重PCR 中PVY 扩增条带较淡。因此,将PVY的cDNA 量调整至1.5 μL,上下游引物量调整为各1.0 μL,结果显示CMV、TMV 和PVY 均能扩增出目标条带(图2)。TMV 的目标条带随着退火温度的改变无明显变化,CMV 随着退火温度的降低,扩增条带略淡,说明退火温度55.5~57.5 ℃更适于TMV、CMV 和PVY 的3 重PCR 检测。
2.4 TMV、CMV、PVY 和TVBMV 的4 重PCR 检测体系构建
2.4.1 TVBMV 引物筛选
利用TVBMV 细胞质内含体蛋白基因(Cylindrical inclusion protein gene,CI)、第1 蛋白基因(The first protein gene,P1)、细胞核内含体蛋白a基因(Nuclear inclusion a gene,NIa)、细胞核内含体蛋白b 基因(Nuclear inclusion b gene,NIb)、第3 蛋白基因(The third protein,P3)、第3 蛋白顺反子内的移码蛋白基因PIPO或外壳蛋白基因(Coat protein gene,CP)对TVBMV 单独侵染的材料进行PCR 扩增,均能获得目标条带。对于复合侵染材料的检测,在TMV、CMV和PVY的3重PCR反应体系中,加入TVBMV各基因引物,仅PIPO在4重PCR中扩增出目标条带(图3)。除了PIPO,TVBMV 其他基因在混合侵染样品中难以扩增出目标条带,推测这与多重PCR 影响引物的特异性有关,也可能与TVBMV 与多种病毒复合侵染后相互间存在的拮抗效应有关。
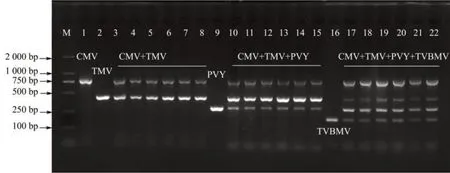
图2 烟草病毒的多重PCR 检测Fig.2 Multiplex PCR detection of tobacco virus

图3 TVBMV 特异性引物筛选Fig.3 TVBMV-specific primer screening
2.4.2 TVBMV 在复合侵染中的分析
为验证TVBMV 在复合侵染中与其他病毒间的关系,在烟草上进行复合接种,分别于接种后第3 天和第7 天取样,根据构建的4 重PCR 检测体系对TMV、CMV、PVY 和TVBMV 进行检测。TMV、CMV 和PVY 在接种后的第3 天和第7 天均能扩增出清晰的目标条带。接种后3 天可以检测到TVBMV 的P1,CP和PIPO目标条带,但TVBMV的CP基因积累水平较低;在接种后第7 天,仅PIPO基因能够检测到明显的目标条带,P1和CP基因的扩增条带较弱,结果见图4。因此,进一步以TMV、CMV 和PVY 的CP基因,TVBMV 的PIPO基因设计相应引物组合,进行四重PCR 反应体系的优化。
2.4.3 4 重PCR 反应条件的优化
在建立的3 重PCR 体系的反应条件下,加入TVBMV 的PIPO特异性上下游引物以及cDNA 各1.0 μL,PCR 扩增的目标条带较淡,因此,将PIPO的上下游引物以及cDNA 的加入量均调整至1.2 μL,设置退火温度57.5、56.5、55.5、53.5、51.5 和50.5 ℃共6 个梯度,4 种病毒均能扩增出较为清晰的目标条带(图2)。
最终建立的CMV、TMV、PVY和TVBMV的4重PCR 检测体系为:25 μL反应体系中TMV、CMV、PVY和TVBMV的cDNA分别为1.0、1.0、1.5和1.2 μL,对应的上下游引物分别为各0.5、0.8、1.0 和1.2 μL;2×Mix Taq 反应液12.5 μL;0.2 μL ddH2O 补足体系。反应条件为:94 ℃预变性3 min;94 ℃变性30 s;53.5 或55.5 ℃退火30 s;72 ℃延伸1 min,35 个循环;72 ℃延伸10 min。根据CP基因设计CMV、TMV、PVY 的引物,根据PIPO基因设计TVBMV的引物。CMV、TMV、PVY 和TVBMV 扩增大小分别约为700、452、275 和235 bp。

图4 TVBMV 在复合侵染中的检测Fig.4 Detection of TVBMV in complex infection
3 讨论
多重PCR 要求在同一反应体系中,进行多个引物序列的特异结合和扩增,引物浓度和模板量是影响多重PCR 的重要因素,因此,一个理想的多重PCR 体系需要针对引物序列、模板量、引物浓度和退火温度条件等进行综合优化,建立适宜的反应体系和扩增条件[14]。在本研究中,PVY 和TVBMV 的扩增效率较低,通过在多重PCR 中增加模板量和引物浓度,扩增效率得到提高。
根据郑轩等[12]利用TMV、CMV、TEV、PVY 和TVBMV 的外壳蛋白基因序列建立的多重PCR 检测体系能够扩增出TMV、CMV 和PVY 的目标条带,然而对复合侵染中TVBMV 的检测却不够稳定,推测这与TMV、CMV、PVY 的株系差异,以及病毒间的相互作用有关。通过复合侵染的人工接种实验,明确TVBMV 明显受到其他几种病毒的拮抗作用,进而降低了复合侵染中TVBMV 的检出率。在多重PCR 的各基因引物筛选中,发现TVBMV 的PIPO基因能够在4 重PCR 反应中产生较明显的条带。PIPO是PVY 属病毒中一个位于P3基因序列内,从第2 个核苷酸开始翻译合成的编码框。然而,TVBMV 的其他基因则通过单个大开放阅读框(Open reading frame,ORF)进行表达,编码一个大约由3 000 个氨基酸组成的多聚蛋白[15]。因此,推测PIPO的复制策略不同于TVBMV的其他基因,使得PIPO的mRNA 丰度有所差异。本研究基于TMV、CMV 和PVY 的CP基因并结合TVBMV 的PIPO基因,通过PCR 反应条件和体系的优化建立的4 重PCR 检测体系提高了复合侵染样品中TVBMV 检测的灵敏度。
4 结论
筛选出了TVBMV 的PIPO基因并结合TMV、CMV、和PVY 的CP基因设计引物,通过调整引物和反应模板的浓度,优化反应条件,扩增获得大小分别约为700、452、275 和235 bp 的PCR 产物,建立了针对CMV、TMV、PVY 和TVBMV 4 种常见烟草病毒的多重RT-PCR 检测体系,为田间复合侵染的烟草病毒提供了一项更加高效的检测手段。

