含油污泥石油烃在生物强化堆肥处理中降解特性研究
张传涛,张 璐,徐开慧,徐娟娟,韩智超,陈丽华*
1.西北民族大学化工学院,甘肃 兰州 730030 2.西北民族大学实验中心,甘肃 兰州 730030
在储存油品时,油品中的石蜡和沥青质等重质组分以及少量机械杂质、沙粒、泥土、重金属盐类沉积在油罐底部形成含油污泥,含油污泥会对人体造成伤害,其油气蒸发在空气中能刺激皮肤、眼睛及呼吸器官,若进入土壤,还会影响植物的正常生长.含油污泥处理困难且对环境具有放射性污染,是石油及石油化工行业的主要污染物之一[1].含油污泥中石油烃类物质引起的环境污染逐渐引起人们的关注,目前对含油污泥的修复方法有很多,其中利用物理、化学等方法消减石油烃可以得到较好的效果,但因造价高、二次污染等问题使其应用受到了限制,而生物修复法由于其操作方便、费用低、无二次污染等优点,受到了高度重视,是目前处理石油烃污染效果比较好的方法[2-3].堆肥法是利用自然界广泛分布的微生物,包括细菌、放线菌、真菌等,在一定的人工条件下,促进降解的有机物向稳定腐殖质转化的生物化学过程,其实质是一种发酵过程[4-5].
笔者所在的课题组制备了以假单胞菌和芽孢杆菌为主的降油复合菌剂,其不仅可以广泛利用石油中的正构烷烃、烯烃、藿烷、甾烷等主要成分为碳源进行自身生长代谢,而且可以将这些石油成分降解或矿化[6-8].该研究通过混合菌剂强化堆肥法处理含油污泥的小试试验,采用GC-MS (气相色谱-质谱联用仪)图谱分析技术对石油烃中正构烷烃、藿烷、甾烷的降解特性进行分析.
1 材料与方法
1.1 试验材料
1.1.1堆肥原料
该研究使用的堆肥原料为新鲜牛粪、含油污泥和辅料(玉米秸秆).牛粪中的水分含量约为70%,pH为8.4,有机质含量为64.3%,C/N为18.5,全碳含量为33.7%,全氮含量为2.09%,上述条件满足各种微生物降解的需求.含油污泥来自陇东地区,含油污泥总石油烃含量在3%~20%之间,含水率为5%,pH平均值为7.82,电导率(EC)平均值为0.866 mS/cm,总氮含量平均值为0.493 g/kg,有机质含量平均值为257.6 g/kg,有机磷含量平均值为13.26 mg/kg,速效钾含量平均值为165.9 mg/kg.玉米秸秆经粉碎机粉碎后,过10目(约0.08 μm)后上筛,高温灭菌,晾干备用.
1.1.2堆肥菌剂
堆肥菌剂Ⅰ:T1(木霉菌属)、A1(曲霉菌属)、B1(芽孢杆菌属)、P1(假单胞菌属).将T1、A1在马铃薯液体培养基试管中接种,置于28 ℃恒温、120 r/min下振荡培养2~3 d以上,等菌液变浑浊后待用;将B1、P1在营养肉汤培养基中接种,置于37 ℃恒温、120 r/min下振荡培养24 h至液体变浑浊后,待用.将上述复活好的T1、A1、B1、P1放入发酵罐中,30 ℃、120 r/min分别发酵培养,检测菌落数大于1×1010CFU/mL后,密封保存备用.使用时按T1、A1、B1、P1体积比为2∶2∶1∶1与腐殖质混合吸附制成固体混合菌剂[9-13].
降油复合菌剂Ⅱ:以陇东地区受污染土壤当作菌源,原油当作唯一碳源筛选分离得到6种石油烃降解菌,分别为P1和P2(均为假单胞菌属),B1、B2和B3(均为芽孢杆菌属)以及D1(为不动杆菌属).由一次扩培后的B1、B2和B3(芽孢杆菌属),P1和P2(假单胞菌属)以及D1(不动杆菌属)这6株菌,按体积比为1∶1∶1∶1∶1∶1配置成菌悬液,放入发酵罐中,以营养肉汤为培养基,在37 ℃、200 r/min恒温振荡下发酵,之后与适量的腐殖质充分吸附混匀制成固体菌剂,当检测菌落数的活性在1×1010CFU/mL以上时,密封保存后备用[14-15].
固肥菌剂Ⅲ:将一次扩培后的C1(固氮菌属)、B1(芽孢杆菌属)按体积比为1∶1制成混合菌剂,放入发酵罐里37 ℃、200 r/min发酵,然后添加适量的腐殖质,制成固体菌剂后使菌落数活性在1×1010CFU/mL以上,密封保存备用.
堆肥菌剂Ⅰ和固肥菌剂Ⅲ的作用是使堆肥原料的纤维素成分分解为微生物可直接利用的糖类等小分子物质,并促使生物肥中的氮素固定化,以提供微生物生长必须的营养元素;降油复合菌剂Ⅱ的作用是利用微生物以石油为碳源的生长代谢过程降解含油污泥中的石油烃[16-17].
1.2 试验方法
1.2.1降解率的测定
紫外分光光度法测定的是堆体中石油烃类物质,先用索氏提取法提取其中的石油类物质,残余油吸光度采用紫外分光光度计测定,绘制出标准曲线,计算得到残余油的质量浓度及降解率[18-20].
1.2.2GC-MS检测
GC-MS图谱解析时从总离子流图中提取正构烷烃、藿烷、甾烷3种系列物质,积分每个系列化合物的峰面积换算成相对百分含量,藿烷、甾烷系列物质用质量归一法计算出相对百分含量,正构烷烃系列物质用加入内标物(44-氘代二十一烷)的绝对含量计算出该系列化合物的绝对残留量(μg).将降解后的样品用正己烷萃取,取5 mL萃取液,经无水硫酸钠脱水,以及0.22 μm耐有机溶剂滤膜过滤后,取2 mL氮气吹干,重新溶解于1 mL正己烷中作为进样,用GC-MS (Agilent 7250 GC/Q-TOF,美国)检测分析降解后总石油烃总离子流[21].
分析条件:气化温度260 ℃,载气He,柱温200 ℃,柱SE-30 (50 m).质谱条件:电子能量70 eV,质量范围为40~450.
1.2.3生物演化参数分析
烷烃主峰碳反映高低碳数正构烷烃的降解优势,W∑C21-/W∑C22+(W∑C21-为C21以下低碳数烷烃的质量总和,W∑C22+为C22以上高碳数烷烃的质量总和)反映了在微生物降油复合菌剂作用下高、低碳数正构烷烃的降解优势.该参数总体反映了烷烃在微生物降油复合菌剂作用下高、低碳数正构烷烃的降解性能.OEP (有机质的奇偶碳比值)反映了微生物降解高碳数奇、偶碳数正构烷烃的能力,该值越小,表明降解奇数碳烷烃的能力越强,反之降解偶数碳烷烃的能力越强.
(1)
式中:WC25为正构二十五烷的质量,μg;WC26为正构二十六烷的质量,μg;WC27为正构二十七烷的质量,μg;WC28为正构二十八烷的质量,μg;WC29为正构二十九烷的质量,μg.
使用藿烷中WC31αβ-22S/(WC31αβ-22S+WC31αβ-22R)〔WC31αβ-22S为17α(H)21β(H)-22S-31-升藿烷的质量,WC31αβ-22R为17α(H)21β(H)-22R-31-升藿烷的质量〕、W∑td/W∑h(W∑td为三环二萜烷的质量总和,W∑h为藿烷的质量总和)、WTs/WTm〔WTs为18α(H)-22,29,30三降藿烷的质量,WTm为17α(H)-22,29,30三降藿烷的质量〕3个参数作为藿烷生物演化过程中降解和构型转化的依据.碳数大于31的藿烷,由于手性碳是第22位碳原子形成的,因而会出现一对镜像异构体(22S和22R).由于22R在生物体中的含量较高,而22S的含量较低,所以通常将22R构型称为生物构型(R型),将22S构型称为地质构型(S型).藿烷类化合物由R型在成岩或微生物作用过程中逐渐转变为S型(更稳定),最后达到R型和S型的平衡状态,即S型占比为0.6.
使用甾烷中的WC29αα-20S/(WC29αα-20S+WC29αα-20R)(WC29αα-20S为ααα-20S-24-乙基-胆甾烷的质量,WC29αα-20R为ααα-20R-24-乙基-胆甾烷的质量)、W∑pg/W∑g(W∑pg为孕甾烷的质量总和,W∑g为甾烷的质量总和)、W∑rg/W∑g(W∑rg为重排甾烷的质量总和,W∑g为甾烷的质量总和)3个参数作为甾烷生物演化过程中降解和构型转化的依据,其均是石油地质领域常用的有机质演化程度参数.碳数大于29的甾烷,因为手性碳是由其第20位碳原子形成的,因而会出现一对镜像异构体(20S和20R).甾烷类化合物由生物构型(R型)在成岩或微生物作用过程中逐渐转变为地质构型(S型,更稳定),最后达到R型和S型的平衡状态,即S型占比为0.6.
1.3 试验设计
将新鲜牛粪500 kg、油泥100~130 kg和辅料(2%玉米秸秆)搅拌均匀,试验设计空白组与试验组各2个,空白组Ⅰ和试验组Ⅰ石油烃的初始浓度均为7%,空白组Ⅱ和试验组Ⅱ石油烃的初始浓度均为10%,空白组中只加入堆肥菌剂Ⅰ和固肥菌剂Ⅲ,试验组较空白组多加入了降油复合菌剂Ⅱ.
试验步骤:首先加入1.5%的堆肥菌剂Ⅰ,使堆肥物料快速达到高温,控制堆肥过程中臭气的产生,缩短堆肥腐熟进程;堆体温度升至60 ℃左右并维持一段时间(10~15 d),当堆体温度降至30 ℃时试验组加入5%降油复合菌剂Ⅱ,利用微生物以石油为碳源的生长代谢过程降解含油污泥中的石油烃,并保持含氧量在10%~20%内,湿度在20%~45%范围内,实时监测降油率等相关指标.在堆肥一个月左右时加入1%固肥菌剂Ⅲ维持堆体肥力,以供给微生物降解所必需的N、P等营养元素.堆至降油指标达到目标值,用Fenton试剂处理杀菌.
2 结果与讨论
2.1 总石油烃降解率的变化
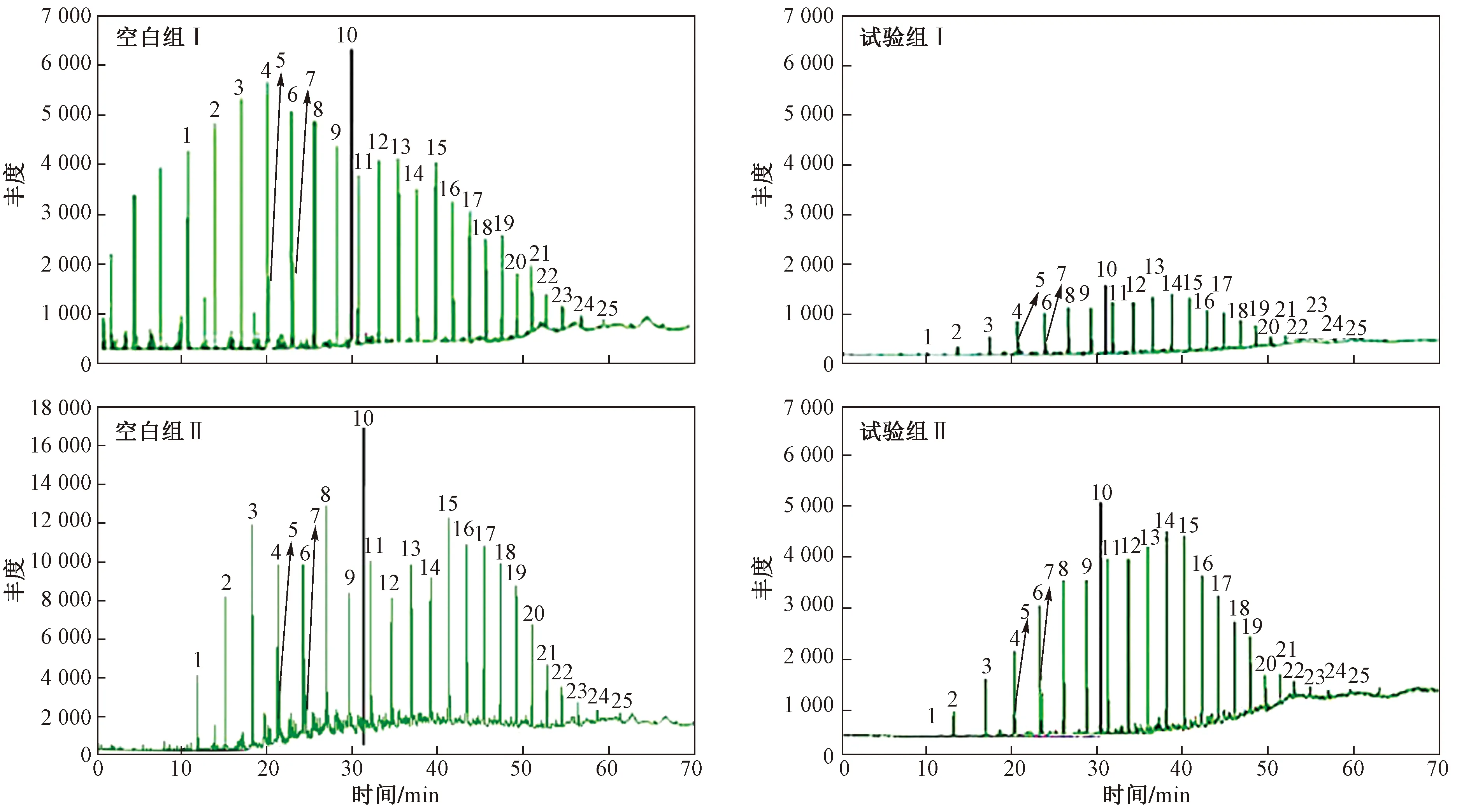
注:1—正十四烷;2—正十五烷;3—正十六烷;4—正十七烷;5—姥鲛烷;6—正十八烷;7—植烷;8—正十九烷;9—正二十烷;10—44-氘代二十一烷(内标);11—正二十一烷;12—正二十二烷;13—正二十三烷;14—正二十四烷;15—正二十五烷;16—正二十六烷;17—正二十七烷;18—正二十八烷;19—正二十九烷;20—正三十烷;21—正三十一烷;22—正三十二烷;23—正三十三烷;24—正三十四烷;25—正三十五烷.图2 空白组与试验组中正构烷烃系列GC-MS质量色谱图Fig.2 n-alkanes series GC-MS mass chromatogram between the blank group and the experimental group
由图1可见:在堆肥过程中,试验组Ⅰ、Ⅱ在降解前期(0~18 d)的总石油烃降解率平均值分别为57%和44%,因试验组Ⅱ石油烃初始浓度较高,对微生物初期生长繁殖有一定抑制,导致降解效果明显不如试验组Ⅰ;试验组Ⅰ、Ⅱ在降解中期(18~48 d)的总石油烃降解率平均值分别为67%和46%,微生物菌剂需要一定时间去适应环境,石油烃初始浓度为10%的试验组Ⅱ的适应时间明显长于石油烃起始浓度为7%的试验组Ⅰ,故试验组Ⅰ的降解不如试验组Ⅱ.相比空白组,2个试验组在25 d时均加入了降油复合菌剂,使得2个试验组的降解率大幅提升,到49 d时总石油烃降解率分别达86%和65%,较空白组分别提高了56%和35%.从降解趋势分析,利用该微生物降油复合菌剂与堆肥法联合修复含油污泥时,周期控制在50 d左右为宜.2个空白组在第25天后,其降解率均为50%,且一直保持着较低的水平,说明通过添加外源微生物降油复合降油菌剂有利于提高堆肥体系中石油烃的降解率[22];同时,试验组Ⅰ、Ⅱ堆肥后的肥力和污染物含量也发生了变化,其中腐殖质、有机质、碳氮比、矿物油含量平均值分别为45 g/kg、57 g/kg、12%、0.8%,除腐殖质含量有显著增加外,其他指标均较堆肥前降低,与李文玉[23]添加外源菌剂后试验组腐殖质含量、碳氮比分别为58 g/kg、28.5%相比,该研究添加微生物降油复合菌剂后碳氮比含量较普通菌剂低,说明该研究采用的微生物降油复合菌剂的石油烃降解率较高.此外,试验组Ⅰ、Ⅱ堆肥后Hg含量≤15 mg/kg、Cu含量≤500 mg/kg、Zn含量≤1 000 mg/kg、Ni含量≤200 mg/kg、Pb含量≤1 000 mg/kg、Cd含量≤20 mg/kg、Cr含量≤1 000 mg/kg、As含量≤75 mg/kg,各重金属含量均在GB 15618—1995《土壤坏境质量标准》范围内.

图1 空白组与试验组中总石油烃降解率的变化Fig.1 Changes of total petroleum hydrocarbons degradation rate between the blank group and the experimental group
2.2 正构烷烃、藿烷、甾烷降解规律
原油中的主要成分是石油烃,包括饱和烃和不饱和烃,而饱和烃中主要成分是烷烃,其包括正构烷烃、藿烷、甾烷3种系列,这3种系列在饱和烃馏分中的总占比较高(94.6%).烷烃中多数为直链烷烃,碳数范围为C14~C39,其次是支链烃,低碳数异构烷烃中植烷和姥鲛烷浓度较高.在微生物降油复合菌剂降解过程中,降解饱和烃所需的能量最低,说明微生物复合菌剂在降解过程中饱和烃会先被降解,之后结构较为复杂的烃类再被降解[24].可见,总石油烃中降解率最高的是正构烷烃.正构烷烃中有3种系列含量较高,3种系列包括正十四烷、植烷、正三十九烷等25种物质,从离子流图中可以提取并获得各物质的含量.由图2可见:没有添加微生物降油复合菌剂的空白组的丰度下降趋势最小,降解效果不明显,较试验组Ⅰ、Ⅱ有较大差别;正构烷烃降解效果最明显的是试验组Ⅰ,其丰度下降趋势最大;试验组Ⅱ中正构烷烃也有一定的降解,但降解效果不如试验组Ⅰ.
图3为微生物降油复合菌剂与堆肥法联合降解49 d后正构烷烃残留量变化.由图3可见:试验组Ⅰ正构烷烃的平均残留量较空白组Ⅰ降低了0.03 μg,说明通过添加外源微生物降油复合降油菌剂能有效降低堆肥体系中正构烷烃的量;试验组Ⅰ中高碳数烷烃(碳数>20)的平均残留量比空白组Ⅰ降低了0.02 μg,低碳数烷烃(碳数<20)的平均残留量比空白组Ⅰ降低了0.04 μg,说明试验组Ⅰ对高碳数烷烃、低碳数烷烃均有较好地降解效果.加入堆肥混合菌剂Ⅰ后,会加速能利用牛粪的天然微生物(芽孢杆菌属等)的增长,其将牛粪中大量纤维成分分解为其他微生物可直接利用的糖类,以及将玉米秸秆中的多糖分解成小分子淀粉等,此时添加适量的微生物降油复合菌剂(腐殖质固载)刚好可以利用前期堆肥过程产生的糖类等小分子物质使降油菌株大量繁殖,为其在降解含油污泥中石油烃的过程提供合适的环境条件.正构烷烃(碳数<40)的降解率与碳数呈负相关,微生物降油复合菌剂对高碳数烷烃(碳数>20)的平均降解率为75.55%,大于对低碳数烷烃(碳数<20)的平均降解率(62.98%),证明在一定链长范围(C14~C35)内,碳链越长,降解越快[25-26].菌剂在刚加到土壤中时并不会很快适应土壤环境,但是随着时间的推移,菌剂会逐渐与土壤环境相适应.现场试验在某时段的菌落数会达到最大值,降解率在该时段也达到最大值,各种菌剂在降解石油不同组分中起协同作用;之后菌落数虽逐步减少,但石油烃降解率仍会升高,这是因为微生物降油复合菌剂与底物降解之间存在滞后性,虽然菌落数逐步减少,但降解效果不会随菌落数的减少而降低,降解仍可持续一段时间;同时,正构烷烃降解后的产物能为微生物提供可再利用的碳源,也利于微生物的生长.
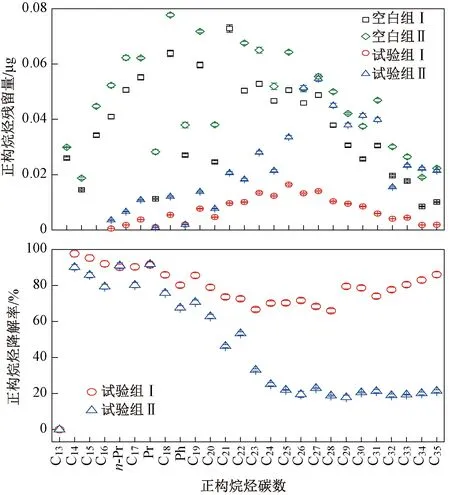
图3 空白组与试验组中正构烷烃降解规律Fig.3 Degradation trend of n-alkanes between the blank group and the experimental group

注:1—三环二萜烷;2—三环二萜烷;3—三环二萜烷;4—三环二萜烷;5—三环二萜烷;6—22S+22R-三环二萜烷;7—四环萜;8—22S-三环二萜烷;9—22R-三环二萜烷;10—22S-三环二萜烷;11—22R-三环二萜烷.图4 空白组与试验组中藿烷系列GC-MS质量色谱图Fig.4 Horane series GC-MS mass chromatogram between the blank group and the experimental group
石油烃的第二系列化合物是藿烷,在一定条件下微生物可以降解藿烷及其相关同系物[27].由图4可见,藿烷中最主要的物质是三环二萜烷化合物.为进一步解释石油烃的降解规律,分析各试验组降解藿烷系列物质的特征及差异,利用藿烷生物标志物参数WTs/WTm和WC31αβ-22S/(WC31αβ-22S+WC31αβ-22R)分析微生物在生物演化石油过程中降解和构型的转化[28-30].
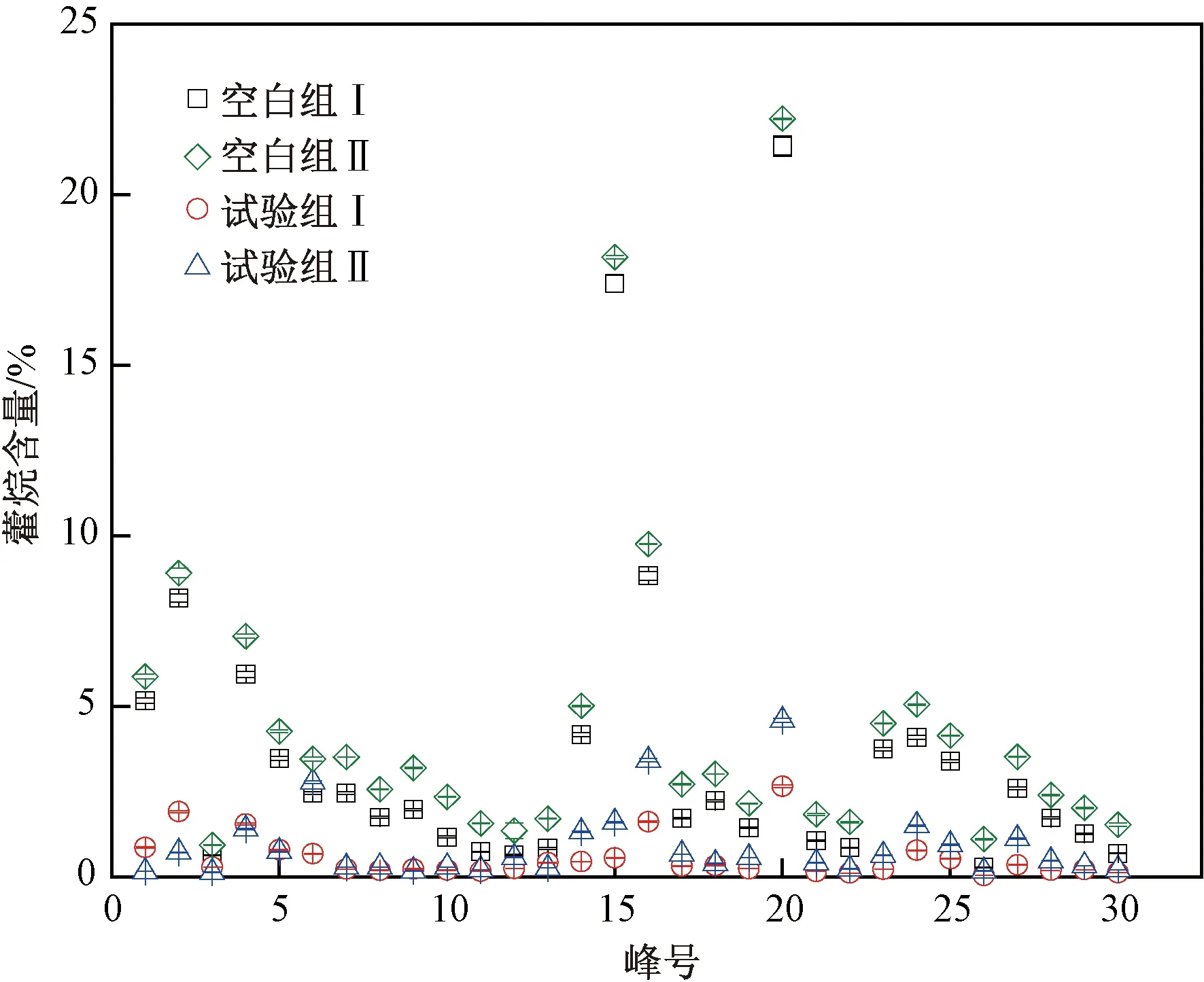
峰号:1—三环二萜烷;2—三环二萜烷;3—三环二萜烷;4—三环二萜烷;5—三环二萜烷;6—22S+22R-三环二萜烷;7—四环萜;8—22S-三环二萜烷;9—22R-三环二萜烷;10—22S-三环二萜烷;11—22R-三环二萜烷;12—22S-三环二萜烷;13—22R-三环二萜烷;14—18α(H)-22,29,30-三降藿烷;15—17α(H)-22,29,30-三降藿烷;16—17α(H),21β(H)-30-降藿烷;17—重排-30-降藿烷;18—羽扇烷;19—17β(H),21α(H)-30-降莫烷;20—17α(H),21β(H)-藿烷;21—五环三萜烷;22—五环三萜烷;23—17β(H),21α(H)-莫烷;24—17α(H),21β(H)-22S-31-升藿烷;25—17α(H),21β(H)-22R-31-升藿烷;26—γ-蜡烷;27—17α(H),21β(H)-22S-31,32-二升藿烷;28—17α(H),21β(H)-22R-31,32-二升藿烷;29—17α(H),21β(H)-22S-31,32,33-三升藿烷;30—17α(H),21β(H)-22R-31,32,33-三升藿烷.图5 空白组与试验组中藿烷的降解规律Fig.5 Degradation of hopane between the blank group and the experimental group
由图5可见,试验组Ⅰ、Ⅱ的藿烷含量较空白组Ⅰ、Ⅱ分别降低了2.6%和3.0%,试验组Ⅰ、Ⅱ的降解趋势基本一致,表明微生物混合菌剂对含油污泥土壤中藿烷类物质的降解率(90%以上)较高,说明藿烷的降解主要表现为手性碳R型向更稳定的S型转化的特征.藿烷的降解波动明显,原因是该类物质S型 和R型交替出现,混合菌剂促使五环三萜类化合物立体构型中不稳定构型向稳定性构型转化,S型化合物更稳定,所以降解率低,R型物质不稳定,所以降解率高,故整体呈波浪状的降解趋势.其中,微生物混合菌剂对22S-31,32,33,34-四升藿烷的降解效果最好,降解率达98.8%;而对γ-蜡烷、17α(H),21β(H)-22S-31,32-二升藿烷、17α(H),21β(H)-22R-31,32-二升藿烷、17α(H),21β(H)-22S-31,32,33-三升藿烷、17α(H),21β(H)-22R-31,32,33-三升藿烷的降解效果均较好,降解率均在85%以上.该微生物降油复合菌剂对五环三萜类、升藿烷类、降藿烷类的降解难易程度依次为五环三萜类>升藿烷类>降藿烷类.可见,油污土壤中的藿烷类化合物在混合菌剂中各菌株配比合适的情况下降解率均较高,藿烷属于环烷烃的一种,与正构烷烃相比更难被降解,说明该微生物降油复合菌剂对藿烷也具有较强的降解能力.
石油烃的第三系列化合物是甾烷,是由一组不对称异构多环环烷烃组成,其特点是具有旋光性.由图6可见,甾烷中最主要的物质是升孕甾烷、重排胆甾烷、胆甾烷等化合物.许多甾烷存在于沉积物和原油中,是由生物中的甾族(甾醇)化合物转化而来的.因此,具有海相或湖相的沉积物一般含有大量的甾烷类化合物.
由图7可见:试验组Ⅰ、Ⅱ对甾烷类化合物的降解效果均优于空白组,与试验组Ⅰ、Ⅱ加入了微生物降油复合菌剂有关.微生物降油复合菌剂对甾烷类化合物的降解幅度均较高,经过49 d的降解,石油烃中甾烷含量均降至2%以下,其中,4-甲基-24-乙基-胆甾烷的降解效果最好,降解率达98.6%;ααα-20S-胆甾烷、αββ-20R-胆甾烷、βα20S-24-乙基-重排胆甾烷、αββ-20S-胆甾烷、ααα-20R-胆甾烷、βα-20R-24-乙基-重排胆甾烷、ααα-20S-24-甲基-胆甾烷、αββ-20R-24-甲基-胆甾烷、αββ-20S-24-甲基-胆甾烷、ααα-20R-24-甲基-胆甾烷、ααα-20S-24-乙基-胆甾烷、αββ-20R-24-乙基-胆甾烷、αββ-20S-24-乙基-胆甾烷、4-甲基-24-甲基-胆甾烷的降解效果均较好,降解率均在90%以上.由此可见,微生物降油复合菌剂对石油烃中的甾烷类化合物降解幅度均较高.
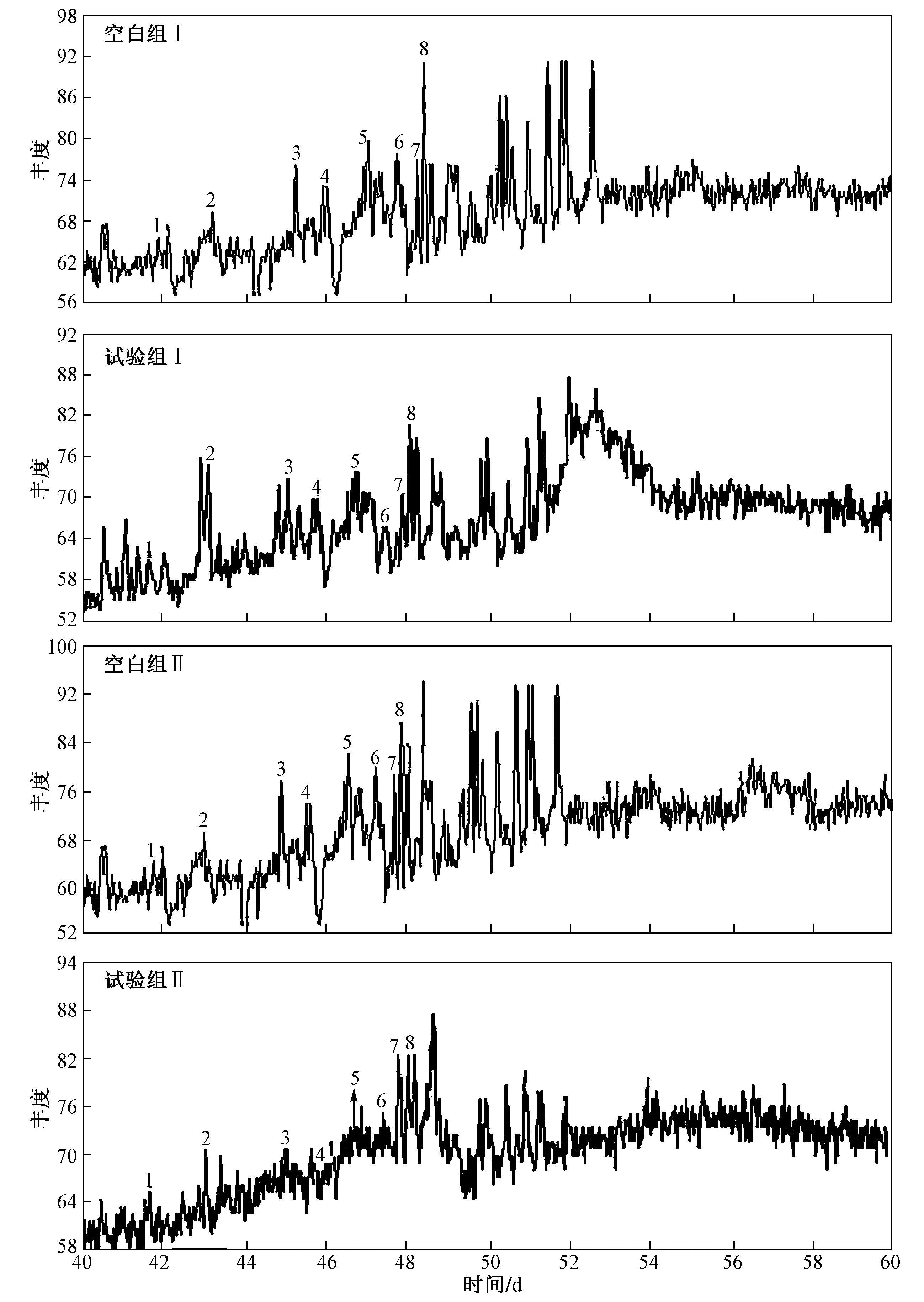
注:1—孕甾烷;2—升孕甾烷;3—βα-20S-重排胆甾烷;4—βα-20R-重排胆甾烷;5—βα-20S-24-甲基重排胆甾烷;6—βα-20R-24-甲基重排胆甾烷;7—ααα-20S-胆甾烷;8—αββ-20R-胆甾烷.图6 空白组与试验组中甾烷系列GC-MS质量色谱图Fig.6 Gonane series GC-MS mass chromatogram between the blank group and the experimental group
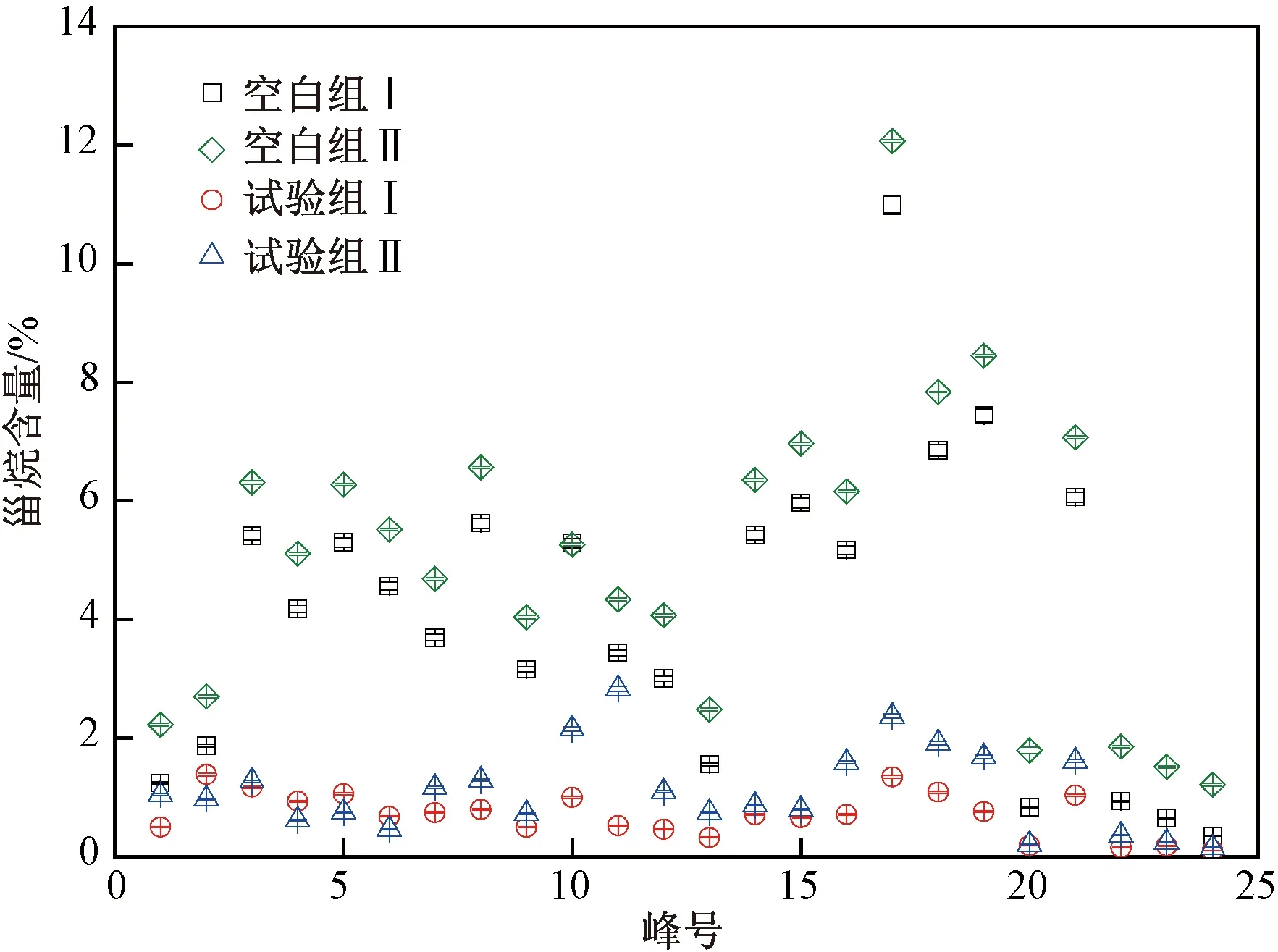
峰号:1—孕甾烷;2—升孕甾烷;3—βα-20S-重排胆甾烷;4—βα-20R-重排胆甾烷;5—βα-20S-24-甲基重排胆甾烷;6—βα-20R-24-甲基重排胆甾烷;7—ααα-20S-胆甾烷;8—αββ-20R-胆甾烷;9—βα20S-24-乙基-重排胆甾烷;10—αββ-20S-胆甾烷 ;11—ααα-20R-胆甾烷;12—βα-20R-24-乙基-重排胆甾烷;13—ααα-20S—24-甲基-胆甾烷;14—αββ-20R-24-甲基-胆甾烷;15—αββ-20S-24-甲基-胆甾烷;16—ααα-20R-24-甲基-胆甾烷;17—ααα-20S-24-乙基-胆甾烷;18—αββ-20R-24-乙基-胆甾烷;19—αββ-20S-24-乙基-胆甾烷;20—4-甲基-24-甲基-胆甾烷;21—ααα-20R-24-乙基-胆甾烷;22、23、24—4-甲基-24-乙基-胆甾烷.图7 空白组与试验组中甾烷的降解规律Fig.7 Degradation of Gonane between the blank group and the experimental group
2.3 正构烷烃、藿烷、甾烷的生物演化参数分析
由表1可见:正构烷烃生物演化参数中,试验组Ⅱ的W∑C21-/W∑C22+为 0.282 6,小于试验组Ⅰ(0.577 1),表明试验组Ⅰ降解高碳数烷烃的能力强于试验组Ⅱ.试验组Ⅱ的OEP值为 0.632 0,小于试验组Ⅰ(1.018 3),表明试验组Ⅰ的降解程度高于试验组Ⅱ;试验组Ⅱ的OEP值是空白组Ⅱ的0.6倍,其OEP值最小,说明微生物降油复合菌剂对高碳数奇数碳烷烃的降解效果优于对偶数碳烷烃的降解效果.试验组Ⅰ的OEP值约为1,没有表现出奇偶碳优势的特征.2个空白组烷烃主峰碳范围为C16~C20,2个试验组的主峰数均发生后移,主峰碳数后移表明石油烃在微生物的作用下优先降解低碳数烷烃.
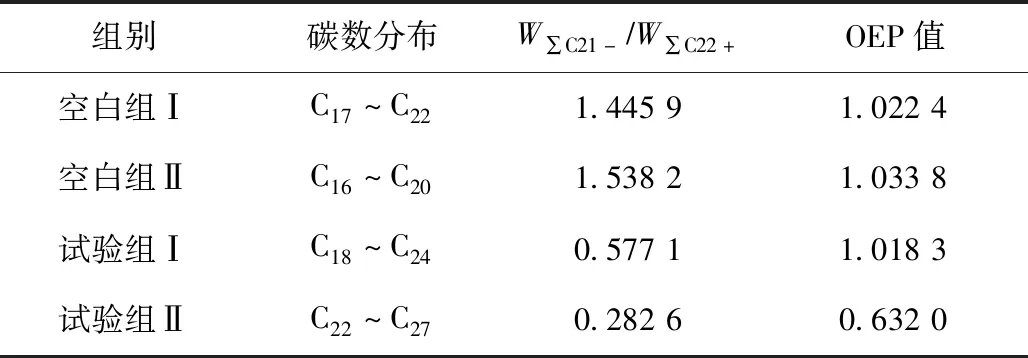
表1 正构烷烃生物演化参数Table 1 Biological evolution parameters of n-alkanes
由表2可见,藿烷系列生物演化参数中,试验组Ⅱ的三环二萜烷化合物主峰相对于试验组Ⅰ发生了后移,说明石油烃在协同作用下表现出较强的优先降解低碳数藿烷的能力.试验组Ⅰ和试验组Ⅱ的W∑td/W∑h分别为 0.086 7 和 0.089 5,均小于各空白组,说明2个试验组的三环二萜烷被微生物降油复合菌剂降解的程度均较高.碳数大于C31的17α(H)、21β(H)构型的藿烷,因其第22位碳原子形成手性碳,所以会出现一对镜像异构体(22S和22R).WC31αβ-22S/(WC31αβ-22S+WC31αβ-22R)是石油地质领域常用的有机质演化程度参数,空白组Ⅱ的WC31αβ-22S/(WC31αβ-22S+WC31αβ-22R)为 0.546 4,其较为接近终点值 0.600 0,所以成熟质的原石油样受外力作用变化不大.试验组Ⅰ、试验组Ⅱ经微生物降油复合菌剂降解后的WC31αβ-22S/(WC31αβ-22S+WC31αβ-22R)分别为 0.593 2 和 0.614 6,均大于各空白组,因此该降油复合菌剂能促进三环二萜类化合物的手性碳R型向更稳定的S型转化.WTs/WTm也是石油地质领域常用的有机质演化程度参数,试验组Ⅰ、Ⅱ的WTs/WTm分别为 0.802 2 和 0.822 9,均大于各空白组,说明三降藿烷在微生物作用下,Tm立体构型逐渐向更稳定的Ts立体构型转化,表明该降油复合菌剂能促进藿烷不稳定构型向更稳定性构型转化.
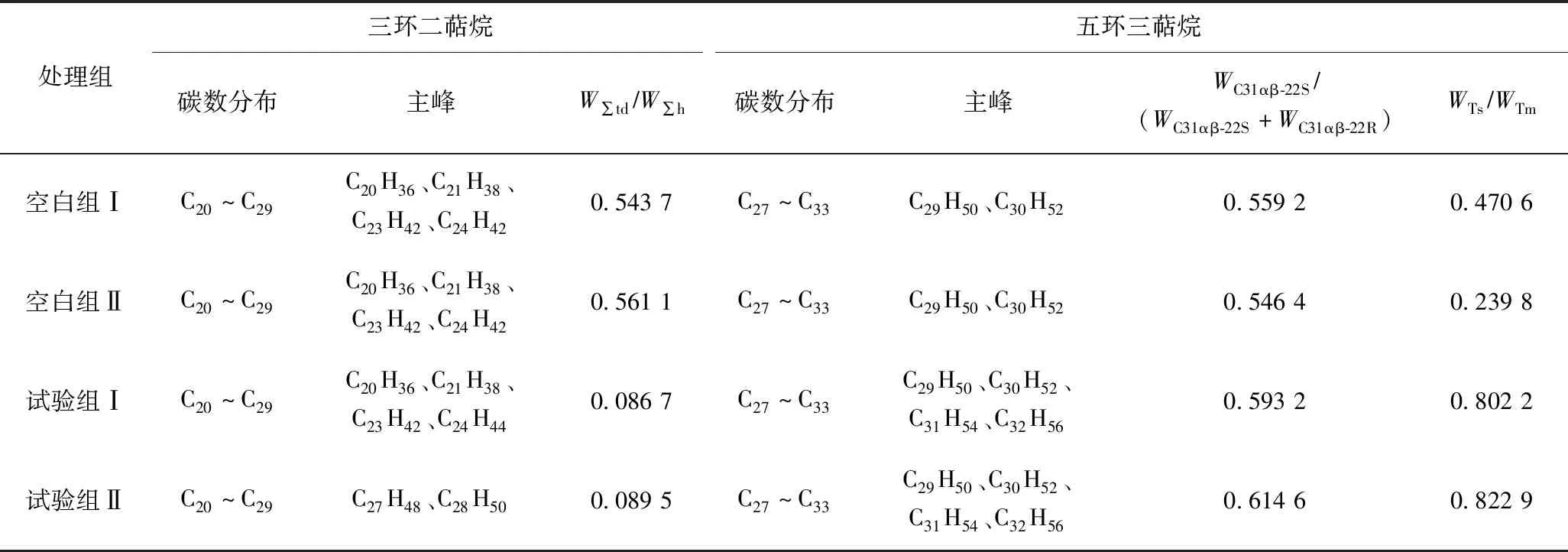
表2 藿烷系列生物演化参数Table 2 Biological evolution parameters of hopane series
由表3可见:甾烷系列生物演化参数中,试验组Ⅰ、Ⅱ的W∑pgW∑g分别为 0.019 0 和 0.020 4,均小于各空白组,说明微生物降油复合菌剂能促进孕甾烷的转化;试验组Ⅰ、Ⅱ的W∑rgW∑g分别为 0.048 5 和 0.049 6,均明显小于各空白组 (0.233 9 和 0.258 7),表明微生物降油复合菌剂对重排甾烷的降幅较大.碳数大于C29的甾烷,因其第20位碳原子成为手性碳,所以会出现一对镜像异构体(20S和20R).空白组Ⅱ的WC29αα-20S(WC29αα-20S+WC29αα-20R)为 0.644 7,其较为接近终点值 0.600 0,所以成熟质的原石油样受外力作用变化不大;试验组Ⅰ、试验组Ⅱ经降解后WC29αα-20S(WC29αα-20S+WC29αα-20R)分别为 0.565 4 和 0.595 3,均小于各空白组.综上,该降油复合菌剂能有效促进甾烷的降解.

表3 甾烷系列生物演化参数Table 3 Biological evolution parameters of gonane series
3 结论
a) 通过GC-MS分析,石油烃3种系列的降解难易程度为正构烷烃>藿烷>甾烷.从降解规律看,77%的油泥经微生物强化堆肥处理49 d后降解率在85%以上.总石油烃中降解率最大的是正构烷烃,藿烷、甾烷中最具代表性的物质分别为22S-31,32,33,34-四升藿烷、4-甲基-24-乙基-胆甾烷,降解率分别为98.8%以及90%以上.结果表明,微生物降油复合菌剂对石油烃中正构烷烃、藿烷、甾烷的降解效果均较好.
b) 从生物演化参数可以看出,该微生物降油复合菌剂对高碳数奇数碳烷烃的降解效果优于对偶数碳烷烃,可促进三环二萜类化合物的手性碳R型向更稳定的S型转化,三降藿烷的Tm立体构型向更稳定的Ts立体构型转化,以及孕甾烷的转化.演化参数分析说明,微生物强化堆肥过程中该降油复合菌剂能够有效促进石油烃3种系列物质的生物降解和演化.

