聚苯硫醚生产废水的资源化利用
苗淑兰,陈侠,2,周登凤,兰天骄,李萍,王亚楠
(1 天津科技大学化工与材料学院,天津300457;2 天津黄埔盐化工程技术有限公司,天津300457)
聚苯硫醚(PPS)是具有良好的耐热性及优越抗化学腐蚀性的高分子工程材料,因其优异的性能被广泛应用于工业中[1-2]。PPS的生产过程是以对二氯苯和硫化钠为原料,磷酸钠为助剂,N-甲基吡咯烷酮(NMP)为溶剂,发生聚合反应形成。PPS生产过程中产生的废水的主要组分为N-甲基吡咯烷酮[3]、氯化钠和磷酸钠。为实现PPS 生产废水的资源化利用,需要达到NMP 的回收利用以及氯化钠与磷酸钠分离两个目标。苟梁武[4]提出将混合液在精馏塔中进行脱水,离心分离出结晶盐,将滤液回流入NMP 的精馏塔,通过间歇真空精馏对NMP 进行精馏回收,但该方法没有对副产盐进行回收。段琳等[5]提出运用PDCA 循环处理含有NMP的PPS 生产废水,但在实际的运行过程中,处理效果并未达标。王军等[6]采用三维电极电化学方法对合成PPS 废水进行处理,有机物的去除率为54.30%,但对其中的盐没有进行处理。方卫东等[7]采用Fenton 氧化法,利用Fenton 试剂处理生产废水中的有机物,但处理后的废水还需进行电解处理。
国内工业化聚苯硫醚的开发、推广和应用刚刚起步,聚苯硫醚生产过程中的副产物的回收利用对实现聚苯硫醚的工业化发展至关重要。本文对PPS生产过程中副产物的资源化利用进行初步研究,结果表明:可以利用有机溶剂萃取分离出废水中的NMP,其他无机盐可根据其特性进行分离提纯,实现PPS生产废水的资源化利用。本文进行实验研究的基本路线如图1。
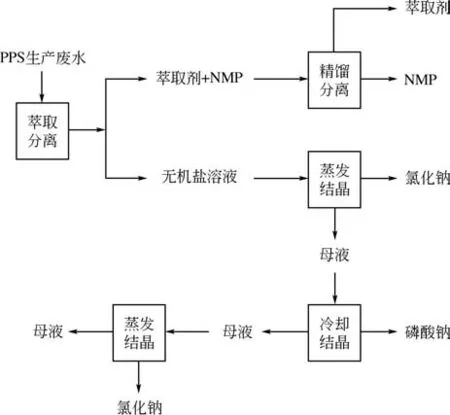
图1 PPS生产废水综合利用技术路线
1 药品与仪器
1.1 试剂和仪器
试剂:去离子水,pH≈6.6,25℃时电导率<1×10-5S/cm,实验中溶液配制均使用此水。硫酸钾(K2SO4)、浓硫酸(H2SO4)、硫酸铜(CuSO4)、石油醚(C5H12)、二氯甲烷(CH2Cl2)、三氯甲烷(CHCl3)、四氯化碳(CCl4)、乙酸乙酯(C4H8O2)、甲酸甲酯(C2H4O2)以及配置平衡料液所使用的氯化钠(NaCl)、磷酸钠(Na3PO4),均为分析纯。
仪器:分光光度仪,HXC-500-8A多点磁力搅拌低温槽,全自动凯氏定氮仪,石墨消解仪。
1.2 分析方法[8]
2 原理与内容
2.1 萃取实验
2.1.1 萃取原理
本文采用的是物理萃取过程,主要是利用NMP 在水和一些有机溶剂中的溶解度不同,使水相中的NMP 转移至有机溶剂中,完成NMP 与无机盐溶液的分离过程。
萃取分配系数(D)常被用来表示被萃组分在萃取相和溶液中的平衡分配关系[9]。由分配系数的定义式式(1)可以看出,被萃组分在萃取相中的浓度越大,D的值越大。影响D值的因素包括萃取剂对被萃组分的萃取能力以及萃取过程中的操作环境与条件,因此可以通过对操作条件的改变来提高萃取剂对被萃溶质与溶液的分离效果。

萃取率是在萃取过程中,被萃组分由水相中转移至有机相中的量占原溶液中的被萃组分的量的百分比,用E表示,如式(2)所示。

2.1.2 萃取实验内容
该废水中氯化钠的含量为11.74%,磷酸钠的含量为3.01%,NMP 含量为2.24%。取一定量的萃取剂于烧杯中,加入含NMP 的高盐废水,在恒温水浴搅拌器中进行搅拌以便两种溶液充分混合,达到萃取平衡后取出,静置分层。将混合溶液倒入分液漏斗中进行萃取剂和无机盐溶液的分离,其中上层为水相,下层为有机相。
2.2 结晶分盐实验
2.2.1 相图分析
本文首先通过实验绘制了353K 下的三元体系Na+//Cl-,-H2O 相图[10-11],并以此数据为理论指导,利用有机溶液萃取PPS生产废盐溶液的萃余相为原料,进行减压等温蒸发实验。其溶液组分如表1所示。

表1 萃取后PPS废盐溶液组成(质量分数)
针对PPS生产废盐溶液,因经萃取后的废水中NMP 含量较低,在忽略NMP 存在的情况下,可利用353K 时三元体系Na+//Cl-,-H2O 相图进行理论分析,如图2所示。图中M点为PPS生产废盐溶液经过萃取后的组分(%),随着水分被蒸发,溶液组分沿M 点蒸发至M0点,M0点开始有固相NaCl析出,继续蒸发,溶液组分则从点M0向点E移动,点E 为共饱和点,此时溶液中的NaCl 和Na3PO4都达到饱和状态。对共饱和点处的饱和溶液加水使之达到298K 时三元体系Na+//Cl-,-H2O 相图Na3PO4的结晶区域,如图2所示,此时理论上析出的应该是Na3PO4·12H2O。
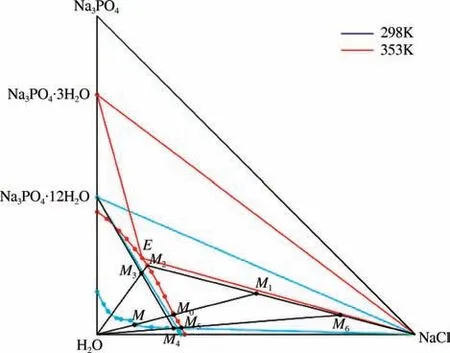
图2 298K与353K三元体系Na+//Cl-,PO3-4 -H2O相图
2.2.2 结晶过程中的物料衡算
(1)蒸发结晶过程 为了确定实验过程中的相关参数,需要对该结晶过程中的每个组分进行物料衡算,从而得到每个节点的物料量,溶液原料以100g为基准进行计算。
M为原料溶液,因萃取后的原料溶液中有机物含量较少,因此可以忽略。M 点的组成:NaCl 为11.74%,Na3PO4为3.01%。根据353K 时的三元体系相图来看,点M1的组成:NaCl 为24.14%,Na3PO4为6.19%。将溶液从点M蒸发至点M0需要蒸发的水分为w0,蒸发得到的母液M0的质量为m0。对母液M0继续蒸发,溶液组成由点M0向点M1移动,在此过程中NaCl 被析出,蒸发至M1之后,进行固液分离,得到固体NaCl 和母液M2,在这一过程中需蒸发的水量为w1,析出的氯化钠的质量为a,剩余母液M2的质量为m2。

以100g 溶液为基准对蒸发过程中氯化钠的收率进行计算,氯化钠的理论收率为

(2)降温结晶过程 降温结晶过程以298K 三元体系相图为依据,磷酸钠的溶解度随着温度的降低而迅速减小,降温结晶的原料点为母液M2,其液相组成为NaCl=15.78%,Na3PO4=21.68%。首先需要向母液M2中加水,使母液组成点向M3点移动,加水量为w2,然后使溶液自然降温至298K,在此过程中Na3PO4·12H2O 被析出,过滤将其分离,得到固体Na3PO4·12H2O 以及母液M4。析出固体的质量为b,母液M4的质量为m4。

以100g 溶液为基准对蒸发过程中磷酸钠的收率进行计算,磷酸钠理论收率为

(3)冷却母液蒸发过程 为提高氯化钠的回收率,实验对冷却结晶后的母液进行再一次的蒸发,使其中的氯化钠结晶析出。溶液原料以100g为基准进行计算。M4点的组成为NaCl=23.92%,Na3PO4=1.9%,根据353K 时的三元体系相图来看,点M5的组成为NaCl=26.48%,Na3PO4=2.1%,将溶液从点M4蒸发至点M5需要蒸发的水分为w3,蒸发得到的母液M5质量为m5。对母液M5继续蒸发,溶液组成由点M5向点M6移动,在此过程中NaCl被析出,蒸发至点M6之后,进行固液分离,得到固体NaCl 和母液M7(NaCl=15.78%,Na3PO4=21.68%),在这一过程中需蒸发的水量为w4,析出的氯化钠的质量为a',剩余母液M7的质量为m7。

2.2.3 结晶分盐实验内容
取适量溶液于三口圆底烧瓶中,将圆底烧瓶与冷凝管等回流装置连接,同时连接真空泵,将圆底烧瓶置于电加热套上加热,进行减压等温蒸发[12]。在不同的蒸发水量对液相进行取样分析,分别测定液相中的离子组成及物化性质,将固相烘干并进行化学组分分析。
蒸发结束后,对蒸发母液进行抽滤,从而将氯化钠固体从母液中分离。根据298K 的相图分析,计算出理论加水量,向滤液中加入适量的水,使其组分达到M3点,待温度冷却至298K后,磷酸钠从溶液中析出,再次抽滤分离结晶析出固体与母液M4,并对该固体进行化学分析。
为提高氯化钠的回收率,实验对冷却结晶后的磷酸钠母液进行再一次的蒸发或返回前段蒸发结晶器进行循环蒸发结晶,以保证氯化钠的提取率。
3 结果与讨论
3.1 萃取条件对萃取效果的影响
3.1.1 萃取剂的选择
美国有专利[13]提出采用溶剂萃取法分离出无机盐中的NMP。文献[14]报道,NMP可以被氯代溶剂通过络合作用从含氯化钠的水溶液中萃取出来,但文献报道的系统性较差。为进一步研究不同有机溶剂对NMP的萃取效果,实验选用的萃取剂分别为:二氯甲烷、四氯化碳、石油醚、乙酸乙酯、苯胺、甲酸甲酯。
实验条件:T=298K,t=3h,V(O)∶V(W)=1∶1,萃取级数为一级。
实验结果如表2 所示,结果表明,以二氯甲烷、乙酸乙酯、石油醚、四氯化碳及甲酸甲酯作为萃取剂,二氯甲烷的萃取效果较好。

表2 NMP-NaCl-Na3PO4-H2O体系中不同萃取剂对NMP的萃取效果
3.1.2 搅拌时间对分配比的影响
实验条件:T=298K,V(O)∶V(W)=1∶1,萃取级数为一级。萃取选用的萃取剂为二氯甲烷,搅拌时间分别为0.5h、1.0h、1.5h、2.0h、2.5h、3.0h、3.5h、4.0h,停止搅拌后静置2h。
从图3可以看出,NMP在有机相和水相中的分配比随着萃取时间的延长而逐渐增大,在搅拌时间达到3h后,两种溶液中被萃组分的含量不再变化,达到萃取平衡的状态。达到平衡状态后,NMP 在有机相与水中的分配比为2.62,在有机相与NaCl-Na3PO4-H2O体系中的分配比为2.92。
3.1.3 萃取温度对萃取效果的影响
选用二氯甲烷为萃取剂,按照溶剂比V(O)∶V(W)为1∶1 混合,分别在291K、293K、296K、298K、300K、303K、306K 以及308K 条件下,搅拌3h 后静置分离,分别测定两相中的NMP 含量,计算分配系数。
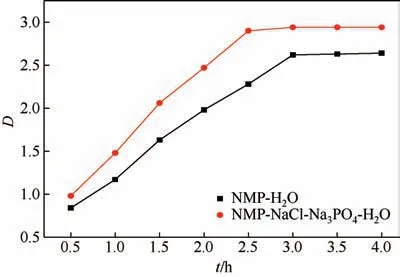
图3 搅拌时间与分配比的关系
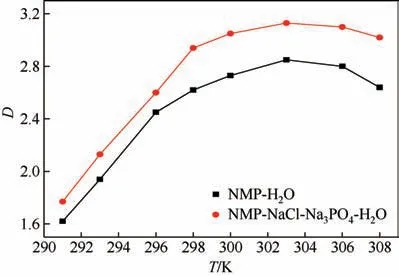
图4 萃取温度与分配比的关系
如图4所示,随着萃取温度的升高,NMP在有机相和水相中的分配系数不断增大,303K 时萃取效果最好。这是因为随着温度的升高,液体分子间的扩散运动加剧,有利于两相间的传质。但在303K 以后两相中分配系数开始减小,其减小原因有待研究。
3.1.4 溶剂比对萃取效果的影响
在298K 的条件下,选取二氯甲烷作为萃取剂,将水溶液或盐溶液与二氯甲烷分别按照不同比例混合,萃取时间为3h,静置分离后,分别对两相中的NMP 含量进行分析检测,计算分配系数D。
实验结果如图5所示,萃取剂的用量越大,分配比也越大,萃取效果也就越好。然而使用有机溶剂的量过大会使生产成本过高,从经济性考虑实验选择V(O)∶V(W)为1∶1,在这时对NMP 的萃取即可得到较好的效果。
3.1.5 萃取级数对萃取效果的影响
在298K 条件下,选用二氯甲烷为萃取剂,按照溶剂比V(O)∶V(W)为1∶1混合,搅拌时间为3h,静置后对有机相与水相进行分离,将分离出的水相按照以上条件再次进行萃取。
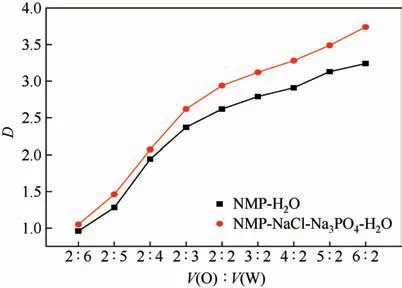
图5 溶剂比与分配比的关系
分别对NMP 水溶液和含NMP 的盐溶液进行一级、二级、三级错流萃取实验。实验结果表明:该实验条件下,随着萃取级数的增加,萃取回收率也逐渐增大,进行三级错流萃取后,在NMP-H2O 体系及NMP-NaCl-Na3PO4-H2O 体系中,二氯甲烷对NMP 的萃取回收率皆可达到90%以上。如表3、表4所示。

表3 不同萃取级数对NMP溶液萃取效果的影响
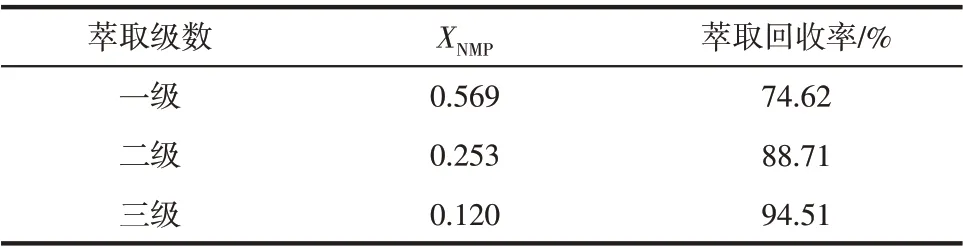
表4 NMP-NaCl-Na3PO4体系中萃取级数对萃取效果的影响
3.2 氯化钠和磷酸钠的分离提纯
3.2.1 蒸发结晶分离氯化钠图6 为本文作者通过相平衡研究绘制的353K时三元体系Na+//Cl-,-H2O平衡相图。在实际废水蒸发过程中得到的液相组成曲线与353K 时三元体系Na+//Cl-,-H2O相图趋势相似,但因该盐溶液中NMP 的存在,其组成与理论存在差异,其溶解度曲线与理论值略有偏差。
根据其结晶规律,通过蒸发浓缩结晶后,对析出的固体进行化学分析,其中氯化钠的含量为98.15%,其余组分为母液中夹带的少量的磷酸钠及其他杂质。称重,得到析出盐的质量为94g,则蒸发实验中氯化钠的单次收率Ya'=80.44%。氯化钠收率的实际值比理论值偏小,其原因主要是转移过程中的氯化钠损失以及蒸发过程中取样所带来的损失。

图6 理论与实验相图(353K)
3.2.2 冷却结晶结果分析
以100g 溶液为基准,蒸发后得到M2母液13.92g,母液中氯化钠的含量为15.78%,磷酸钠的含量为21.68%。向母液中加入1.82g水,使其中的氯化钠溶解后,在298K 时溶液中只有磷酸钠为过饱和状态,从而使母液中的磷酸钠结晶析出。在298K 的条件下,磷酸钠以结晶水的形式存在,因此此时从母液中结晶析出的是十二水合磷酸钠。
对冷却后的固液混合物进行抽滤分离,析出的固体的纯度为98.88%,分离得到固体的质量为64.07g,将其转化为磷酸钠的质量为27.65g,则蒸发实验中磷酸钠的实际收率Yb'=92.28%。磷酸钠收率的实际值比理论值偏小,其原因主要是在转移过程中造成的磷酸钠的损失,以及母液中微量有机物和其他杂质的影响。
3.2.3 冷却母液的二次蒸发
如表5所示,将冷却母液蒸发至M7时,对该母液的浓缩倍数最大,但随着溶液浓缩倍数的增大,析出的氯化钠中夹带的杂质含量也增大。为保证析出氯化钠的纯度,对溶液的浓缩倍数不应超过2.59倍,此时氯化钠的收率为87.42%,纯度为97.54%,对其进行母液转换后纯度可达到99.41%。
3.3 工艺过程中氯化钠总收率
工艺过程中氯化钠的总收率如表6所示。
4 结论
(1)将PPS生产废盐溶解后进行萃取实验以分离其中的有机物NMP,通过对萃取过程中萃取剂的选择、萃取温度、萃取时间、溶剂比以及萃取级数等条件的研究,探明萃取该盐溶液中NMP 的最佳工艺条件是:以二氯甲烷为萃取剂,萃取时间为3h后可达到萃取平衡状态,萃取温度可选择303K,适宜的溶剂比为1∶1,进行三级错流萃取后,无论是对NMP 水溶液还是对NMP 含盐溶液,该工艺对NMP的萃取回收率都可以达到90%以上。

表5 冷却母液353K等温蒸发过程中液相变化

表6 氯化钠总收率
(2)对经过萃取分离出NMP 的无机盐溶液进行等温减压蒸发实验,对不同蒸发水量时的液相进行化学分析,其组分变化趋势与本文作者研究绘制的在353K 时Na+//Cl-,-H2O 三元体系相图基本一致。对点M1处结晶析出的盐进行化学分析,可以得出在点M1至M2之间蒸发结晶析出的盐为氯化钠,这一过程中氯化钠的实际收率为80.44%,小于其理论值81.35%,此时其纯度为98.15%。将母液M4加水溶解过饱和的氯化钠后进行冷却,冷却至298K 后有盐结晶析出,对该盐进行化学分析得知该盐为Na3PO4·12H2O,纯度为98.88%,其他指标均符合工业磷酸三钠的标准。冷却结晶回收磷酸钠的实际收率Yb'=92.28%。在经过两次蒸发后,该工艺对氯化钠的总收率可达到96.68%,经处理后其纯度为99.27%。以1000g 废水为基准进行计算,在经过两次蒸发分盐之后,废水的余量为8.04g。如在工业化生产中将磷酸三钠冷却结晶母液返回前段蒸发结晶过程进行循环蒸发提取,可在实现水的全部处理和零排放的同时,提高对氯化钠及磷酸三钠的提取率,实现其组分的资源化利用。

