金属吸附剂用于去除血清蛋白及核苷检测
王 悦,刘晓燕,张海霞
(兰州大学 化学化工学院,甘肃 兰州 730000)
血清是非常复杂的混合物,其中某些高丰度蛋白会对血清中小分子的检测过程造成干扰[1-2].若能设计合成一种可以去除血清中高丰度蛋白的吸附剂,在样品前处理过程将蛋白的干扰去除,对小分子目标物的检测来说,是一种有效方法.
目前常用去除高丰度蛋白的方法包括基于亲和技术的去除方法,如利用染料[3]、免疫[4]、多肽[5]亲和色谱法以及其它亲和层析技术[6]、沉淀法和超滤离心法[7]、金磁微粒去除法[8-9]以及等电捕获法及制备电泳技术[10].最近,基于Cu2+[11-17]、Ni2+[18-22]、Zn2+[23]等可以和蛋白质表面的组氨酸基团进行螯合的金属亲和蛋白吸附剂被广泛用于去除或富集富含组氨酸的蛋白质.
海藻酸钠(SA-Na)和羧甲基纤维素钠(CMC-Na)分子中均含有大量游离的羟基和羧基,通过阳离子交换使其具有吸附金属离子的能力,可以对Cu2+进行有效吸附[24].Ca2+的离子空间最适合与SA-Na形成稳定的配合物.CMC-Na可以有效增强复合材料的强度.SA-Na和CMC-Na对Cu2+的固定不仅可以使Cu2+与蛋白质表面的组氨酸残基发生螯合作用,而且避免了Cu2+在中性条件下生成Cu(OH)2沉淀,失去与蛋白质的配位作用,使复合材料起到对蛋白质选择性富集和分离的作用.
本论文基于去除复杂样品中高丰度蛋白后,直接检测小分子的思路,使用SA-Na和CMC-Na作为基质,使用Ca2+为交联剂,得到复合纳米片SA-Ca/CMC-Ca,将Cu2+固定到材料表面,得到 SA-Ca/CMC-Ca@Cu2+,用来富集富含组氨酸的蛋白质.通过该方法对高丰度蛋白进行去除后,可以满足血清中的核苷类物质的直接色谱进样检测.
1 试验部分
1.1 仪器与试剂
海藻酸钠(SA-Na),AR级,aladdin (北京);羧甲基纤维素钠(CMC-Na),CP级,国药集团 (上海);无水氯化钙(CaCl2),纯度96%,武汉市化学试剂厂(武汉);尿素,AR级,科密欧 (天津);五水硫酸铜(CuSO4·5H2O),纯度不低于99.0%,西陇化工(成都);牛血红蛋白(BHb)、牛血清蛋白(BSA)和溶菌酶(LYZ)均购于北京拜尔迪生物科技公司(北京);胞苷、胸苷、尿苷、肌苷均购于阿拉丁(上海);超纯水,Milli-Q系统(Millipore, Bedford, MA, USA).
傅立叶变换红外(FT-IR)光谱,Vertex70 (Bruker);紫外可见分光光度计,TU-1810 (北京普析通用公司);精密天平,NBL 214e型号(武汉艾德姆衡器有限公司);真空干燥箱,DZF-6020 (上海一恒科技有限公司);透射电子显微镜(TEM),JEOL电子显微镜(美国波士顿);扫描电子显微镜(SEM),日立SU8010电子显微镜(日本);恒温振荡器,国华SHA-C (常州国华电器有限公司);冷冻离心机,湘仪H-2050R (长沙湘仪离心机仪器有限公司).
色谱分析在液相色谱(Dionex Ultimate 3000)上完成,全自动进样系统,色谱柱为反相C18柱(5 μm, 4.6×150 mm, Hedera ODS-2),紫外检测器(DAA-3000RS)进行检测.
1.2 材料制备
配制含有质量分数分别为6%氢氧化钠和4%尿素的水溶液97.0 g,将3.0 g SA-Na溶于其中,经过充分搅拌使其形成透明溶液,得到质量分数为3.0%的SA-Na溶液;同理将3.0 g CMC-Na溶于其中,得到质量分数为3%的CMC-Na溶液.
将上述两种溶液按照SA-Na/CMC-Na的质量比分别为7∶3、6∶4、5∶5、4∶6、3∶7 的比例进行混合,混合成总质量为10.0 g的溶液.磁力搅拌均匀后,加入50.0 mL的3% CaCl2溶液进行交联,充分搅拌20 min后,抽滤并用超纯水充分洗涤,材料放入60 ℃烘箱中干燥,干燥后对材料进行研磨,即可得到SA-Ca/CMC-Ca复合材料.
称取上述各种比例研磨好的SA-Na/CMC-Ca复合材料5份,每份50.0 mg,将其分别与5.0 mL不同浓度的硫酸铜溶液(0.2、0.4、0.6、0.8、1.0 mol/L)在磁力搅拌下反应4.0 h,使材料嫁接上Cu2+,然后用超纯水对材料进行充分洗涤,去除材料表面物理吸附的Cu2+,洗净后将材料放入60 ℃真空干燥箱烘干,研磨,即可得到SA-Ca/CMC-Ca@Cu2+.
1.3 吸附试验
1.3.1 SA-Ca/CMC-Ca材料对Cu2+的吸附量
将吸附铜离子后的材料与硫酸铜溶液进行分离,取上清液,使用紫外分光光度计605 nm下测定吸光度值,通过原始硫酸铜的吸光度与吸附铜离子后上清液的吸光度计算铜离子在材料上的吸附量,并与火焰原子吸收法测定结果进行对照.
1.3.2 SA-Ca/CMC-Ca@Cu2+材料对BHb、BSA、LYZ的吸附
准确称取2.0 mg SA-Ca/CMC-Ca@Cu2+,分别加入到5.0 mL不同质量浓度(2.0、4.0、6.0、8.0、10.0、12.0、14.0、16.0 mg/mL)的BHb溶液中进行吸附.每隔10 min高速离心后,取上清液稀释,然后取500 μL与2.5 mL考马斯亮蓝溶液显色10 min,使用UV-Vis计在595 nm处测定吸光度值,并计算材料对BHb的吸附量.同样,取2.00 mg材料对4.0 mg/mL的BSA蛋白溶液和1.0 mg/mL的LYZ蛋白溶液进行吸附,操作同上.
1.3.3 SA-Ca/CMC-Ca@Cu2+材料去除人血血清中蛋白质
准确称取10.0 mg SA-Ca/CMC-Ca@Cu2+,对稀释10倍的1.0 mL人血血清中蛋白质吸附10 min,离心取上清液后,另取10.0 mg材料对上清液再次吸附10 min,离心取上清液.将上清液稀释后,取500 μL与2.5 mL考马斯亮蓝溶液混合并显色测定吸光度,计算出材料对血清中蛋白质的去除率.
1.4 核苷检测
1.4.1 pH对吸附的影响
10 mg材料吸附1.0 mL pH值分别为3.0~9.0的胸苷、肌苷、胞苷和尿苷混合液(2.0 μg/mL),吸附20 min后进行离心去除SA-Ca/CMC-Ca@Cu2+,取上清液进UPLC进行检测.核苷检测使用的色谱梯度洗脱条件为:A,乙腈;B,12.5 mmol/L甲酸铵溶液;0~2.5 min,B:95%~86%;2.5~4 min,B:86%~30%;4~10 min,B:30%,流速:0.7 mL/min,紫外检测波长:259 nm.
1.4.2 核苷检测回收率的测定
分别使用0.1、0.5、1.0、3.0、5.0 μg/mL的胸苷、肌苷、胞苷和尿苷混合标准液做线性曲线.取100 μL血清,在血清中分别加入10 μg/mL的混合核苷标准样品0、20、100、300 μL,稀释至1.0 mL,配置成含有0、0.2、1.0、3.0 μg/mL混合核苷的血清样品,分别使用10.0 mg材料对样品吸附两次,每次10 min,离心后取最终上清液进液相进行检测,计算4种核苷在未加标时的浓度以及加标低、中、高3个浓度下的回收率.
2 结果与讨论
2.1 材料的合成与表征
图1是材料制备和使用的示意图,图2分别为合成不同阶段材料的红外光谱图.由图2可以看出,SA-Na和CMC-Na的FT-IR谱图中出现特征吸收峰C=O(1 680 cm-1),-OH (3 400 cm-1),-CH2(2 930 cm-1和1 460 cm-1),在SA-Ca/CMC-Ca和SA-Ca/CMC-Ca@Cu2+中同样有这些特征吸收峰,证明了复合材料中同时包含海藻酸钠和羧甲基纤维素钠两种材料.同时还发现,与其他3种材料比较,SA-Ca/CMC-Ca@Cu2+在1 000 cm-1处C-O的吸收峰发生了红移,证明了Cu2+与材料其中的羧基发生了配合作用.
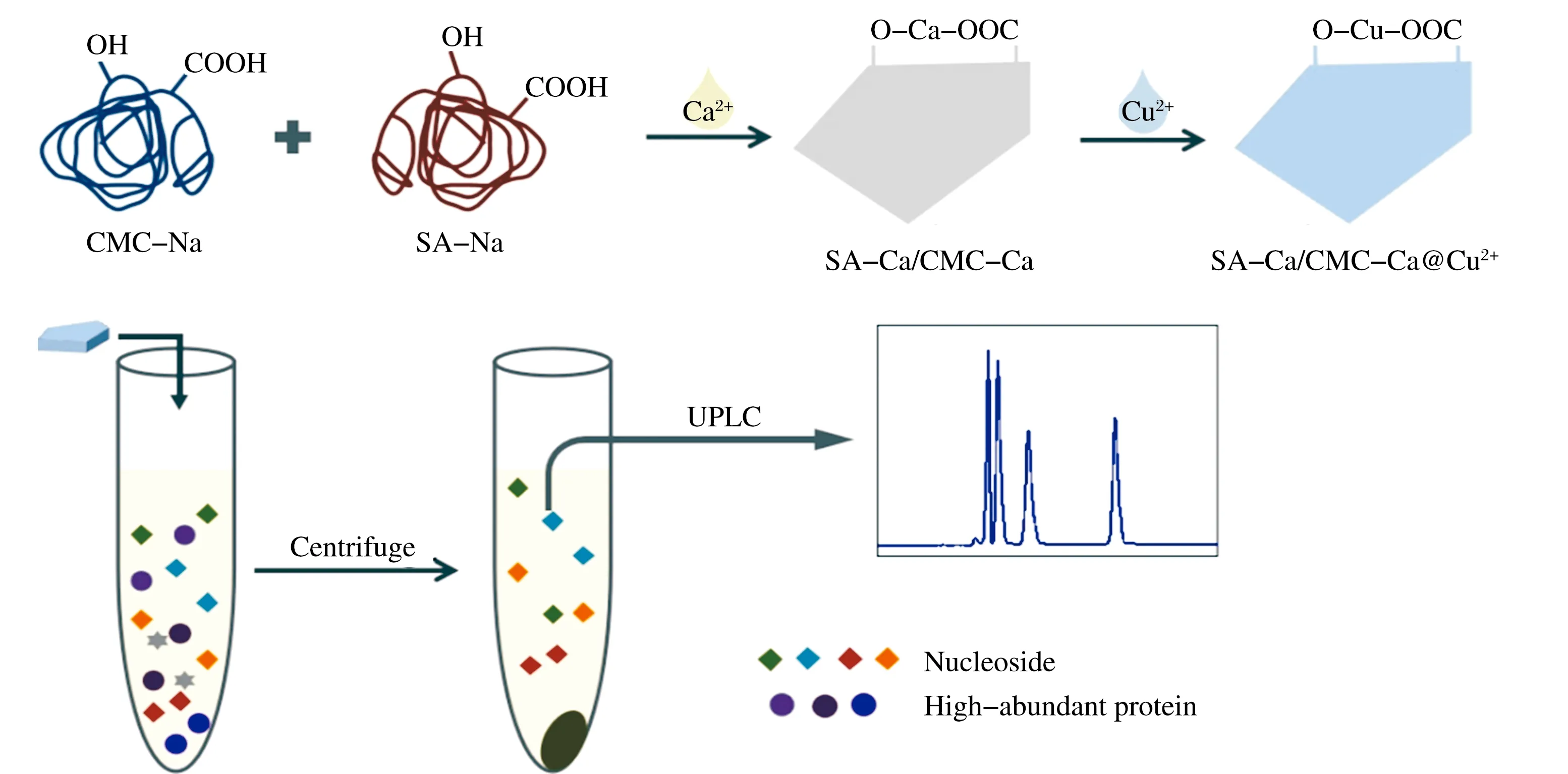
图1 样品制备以及蛋白质吸附和核苷检测过程
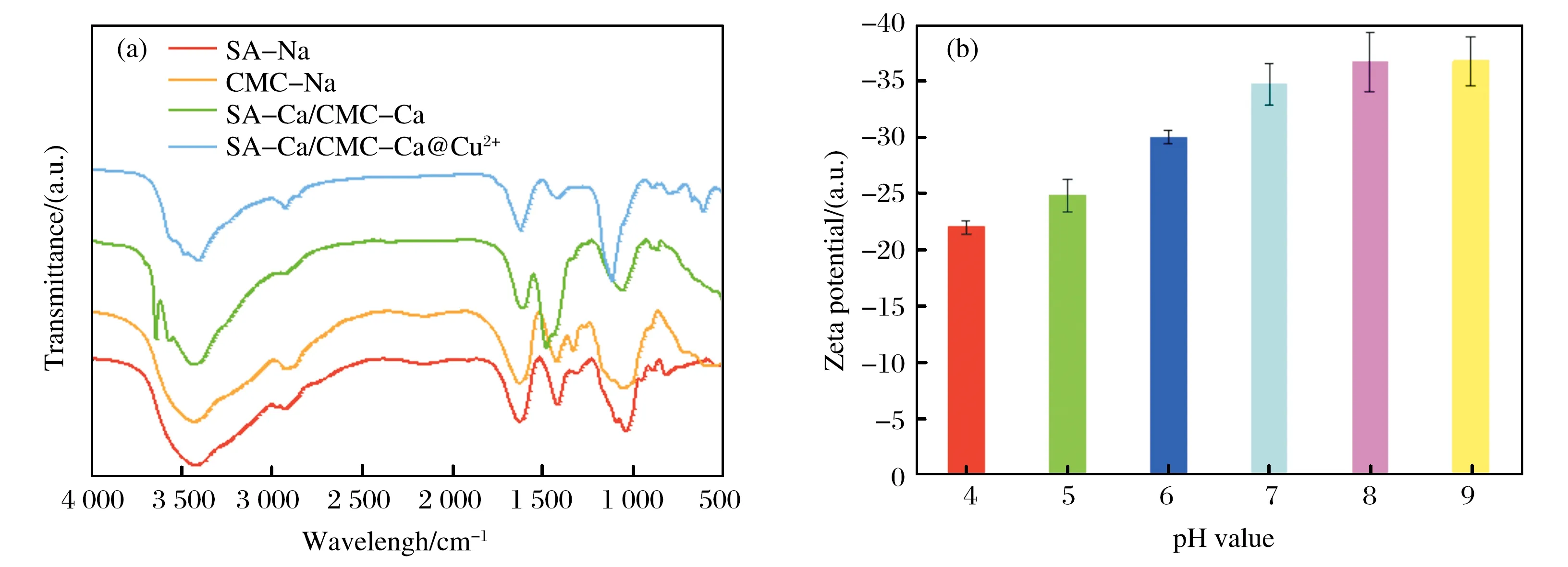
图2 (a) SA-Na, CMC-Na, SA-Ca/CMC-Ca, SA-Ca/CMC-Ca@Cu2+的红外光谱图,(b) SA-Ca/CMC-Ca@Cu2+材料表面Zeta电势
由Zeta电势结果可知, pH在4.0~9.0范围内,所合成的SA-Ca/CMC-Ca@Cu2+材料的电势均为负值,且随着pH的逐渐增加,材料的表面电势逐渐变负,在pH为7.0后趋于稳定,说明Cu2+的加入对材料的负电性没有影响,反而为材料提供了与蛋白质配合的位点.由于所研究的含组氨酸的BHb和BSA蛋白表面均带正电荷,说明材料对蛋白质的吸附除了Cu2+与咪唑基的配位作用以外,还有静电作用.
从图3的扫描电镜(SEM)图可以看出,材料在吸附Cu2+之后,颗粒更加分散,可能是由于在吸附Cu2+时剧烈搅拌的冲击作用导致.这使得材料的比表面积增加,更多地吸附蛋白质.从图3透射电镜(TEM)图可以看出SA-Ca/CMC-Ca@Cu2+具有许多孔状结构.BET测定结果表明材料的比表面积为16.507 9 m2/g.

图3 SA-Ca/CMC-Ca (a, c) 和SA-Ca/CMC-Ca@Cu2+ (b, d) 的SEM和TEM图
图4为不同比例SA-Na与CMC-Na合成的复合材料对Cu2+的吸附量的影响.从图4可以看出,SA-Na与CMC-Na的质量比对Cu2+的吸附量并没有显著性差异,所测得的材料对Cu2+的吸附量平均为0.55 g/g.为了进一步得到更准确的结果,将各比例的材料混合均匀后,使用火焰原子吸收法对SA-Ca/CMC-Ca@Cu2+上的Cu2+含量进行测定,其质量分数为37.20%,换算可得,Cu2+的吸附量为0.59 g/g,与紫外吸光法所测得的0.55 g/g的结果相近.

图4 SA-Na/CMC-Na在不同比例下对Cu2+的吸附量
2.2 吸附模型
利用吸附模型对蛋白质吸附行为进行了探究.吸附动力学模型通常使用准一级模型或准二级模型进行模拟.准一级和准二级模型代表影响吸附过程的不同限制因素.若拟合曲线更符合准一级模型,即拟合曲线为直线,则表示限制因素主要为颗粒内传质阻力.准二级模型则认为吸附机制是吸附过程的限制因素,两者截然不同.
准一级动力学方程:
lg(Qe-Qt)=lgQe-k1t
(1)
准二级动力学方程:
(2)
其中,Qe和Qt分别表示平衡时吸附量和t时刻吸附量.k1和k2分别为准一级吸附速率常数(min-1) 和准二级吸附速率常数(g/mg h).
BHb表面裸露的组氨酸个数为14个,BSA表面裸露的组氨酸个数为4个,而LYZ表面没有裸露的组氨酸,因此在理论上,SA-Ca/CMC-Ca@Cu2+对BHb这3种蛋白质的吸附量应该为BHb>BSA>LYZ.从图5可以看出,SA-Ca/CMC-Ca@Cu2+对BHb的吸附在50 min的时候达到平衡,最大吸附量大约为33 g/g.对BSA的吸附在40 min时达到平衡,最大吸附量大约为9.8 g/g.而对LYZ的吸附量只有0.1 g/g左右.与理论上预测的吸附量顺序一致.此外,没有固定Cu2+的SA-Ca/CMC-Ca材料对BHb的吸附量与SA-Ca/CMC-Ca@Cu2+对LYZ的吸附量相同,说明SA-Ca/CMC-Ca@Cu2+对BHb优越的吸附量主要是基于铜离子与组氨酸的相互作用,而由于LYZ表面不包含有裸露的组氨酸,且LYZ表面电荷带有正电荷,因此,SA-Ca/CMC-Ca@Cu2+对其的吸附主要是基于非特异性吸附.
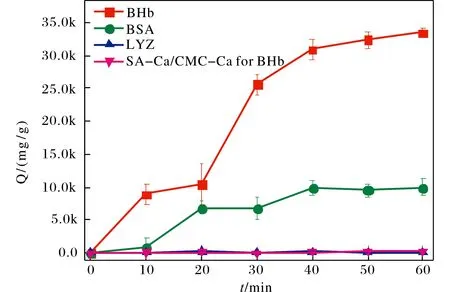
图5 SA-Ca/CMC-Ca@Cu2+对BHb、BSA、LYZ的吸附曲线和SA-Ca/CMC-Ca对BHb的吸附曲线
为了验证 SA-Ca/CMC-Ca@Cu2+对BHb的吸附动力学行为,我们分别进行了准一级动力学模型以及准二级动力学模型的拟合,结果如图6所示,并且拟合所得的相关参数如表1所列.
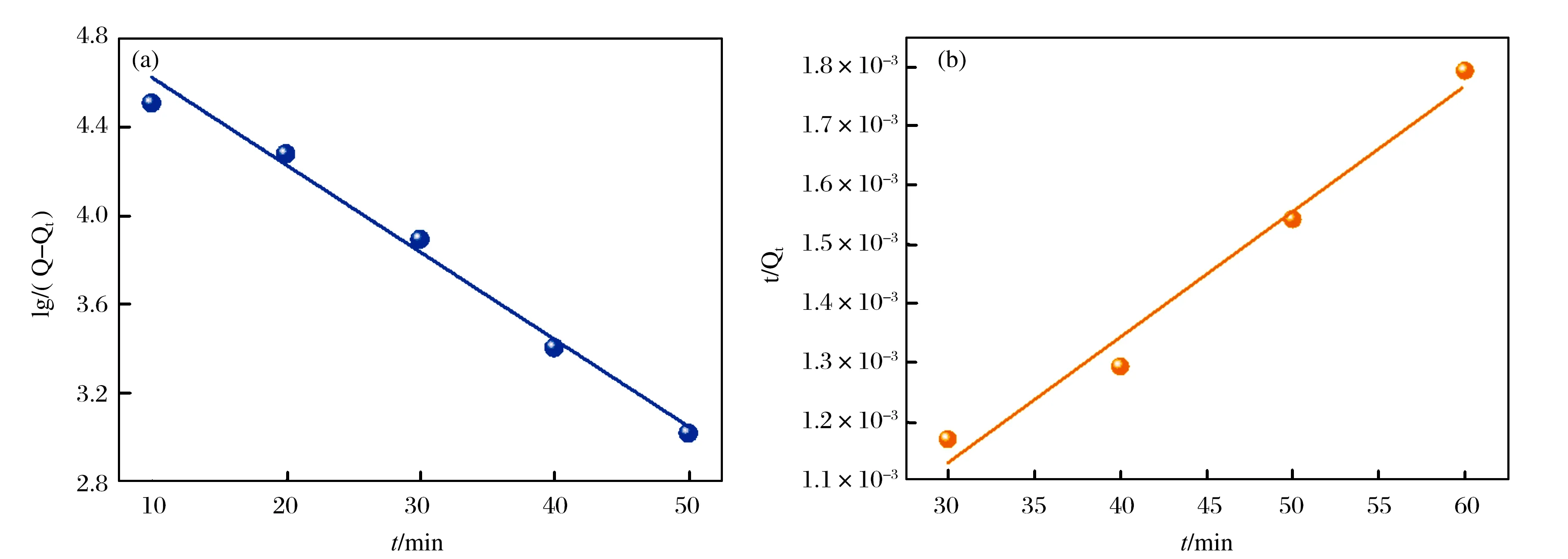
图6 SA-Ca/CMC-Ca@Cu2+对BHb吸附的(a)准一级模型拟合曲线和(b)准二级模型拟合曲线
从表1看出,准一级模型的R2大于准二级模型的R2值,因此材料对BHb的吸附更加符合准一级动力模型.由于在试验过程中材料对蛋白质的吸附量大,只能使用少量的材料完成试验,因此由线性曲线得到的理论吸附量与试验所得的吸附量存在较大的误差.

表1 准一级动力学模型、准二级动力学模型相关参数值
与查阅到的文献对比结果如表2所列.本试验制备的SA-Ca/CMC-Ca@Cu2+对BHb的吸附量最大,吸附达到平衡的时间较短,说明材料具有很好的吸附性能.
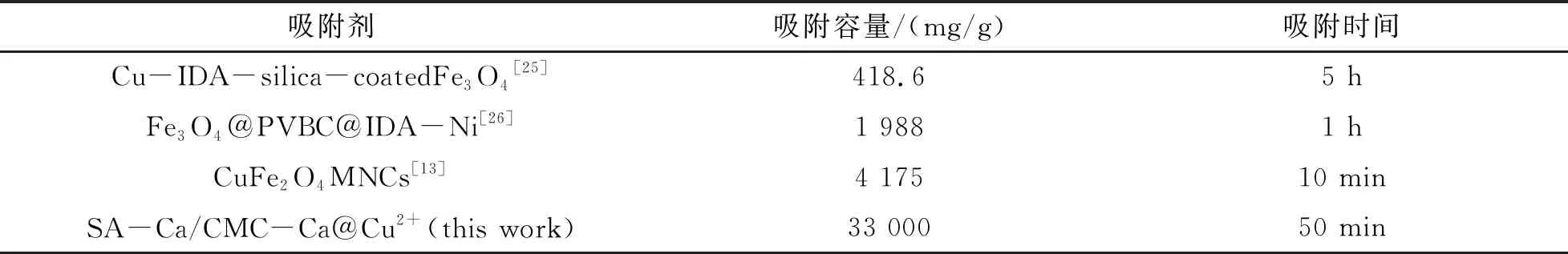
表2 与文献中报道材料对BHb吸附量的比较
2.3 吸附等温模型
我们计算了SA-Ca/CMC-Ca@Cu2+材料对BHb的吸附等温模型,并用Langmuir方程和Freundlich方程进行拟合.
(1)Langmuir方程:
(3)
式中,Ce:平衡浓度(mg/L);Qmax为材料的最大单层吸附量(mg/g),KL为Langmuir吸附常数(L/mg).该模型认为吸附行为为单分子层吸附模式[27].
(2)Freundlich方程
(4)
式中,Kf为Freundlich吸附常数(L/mg);1/n:吸附指数,可粗略地表示吸附强度随着温度提高,1/n趋1.Freundlich模型描述了表面不均一或表面吸附粒子后产生相互作用的表面吸附行为[28].
从图7可以看出,在试验过程当中,当BHb的质量浓度达到14 g/L时,材料已经不能完全吸附BHb.SA-Ca/CMC-Ca@Cu2+对BHb的热力学吸附行为结果如图8所示,拟合所得的相关参数如表3所列.
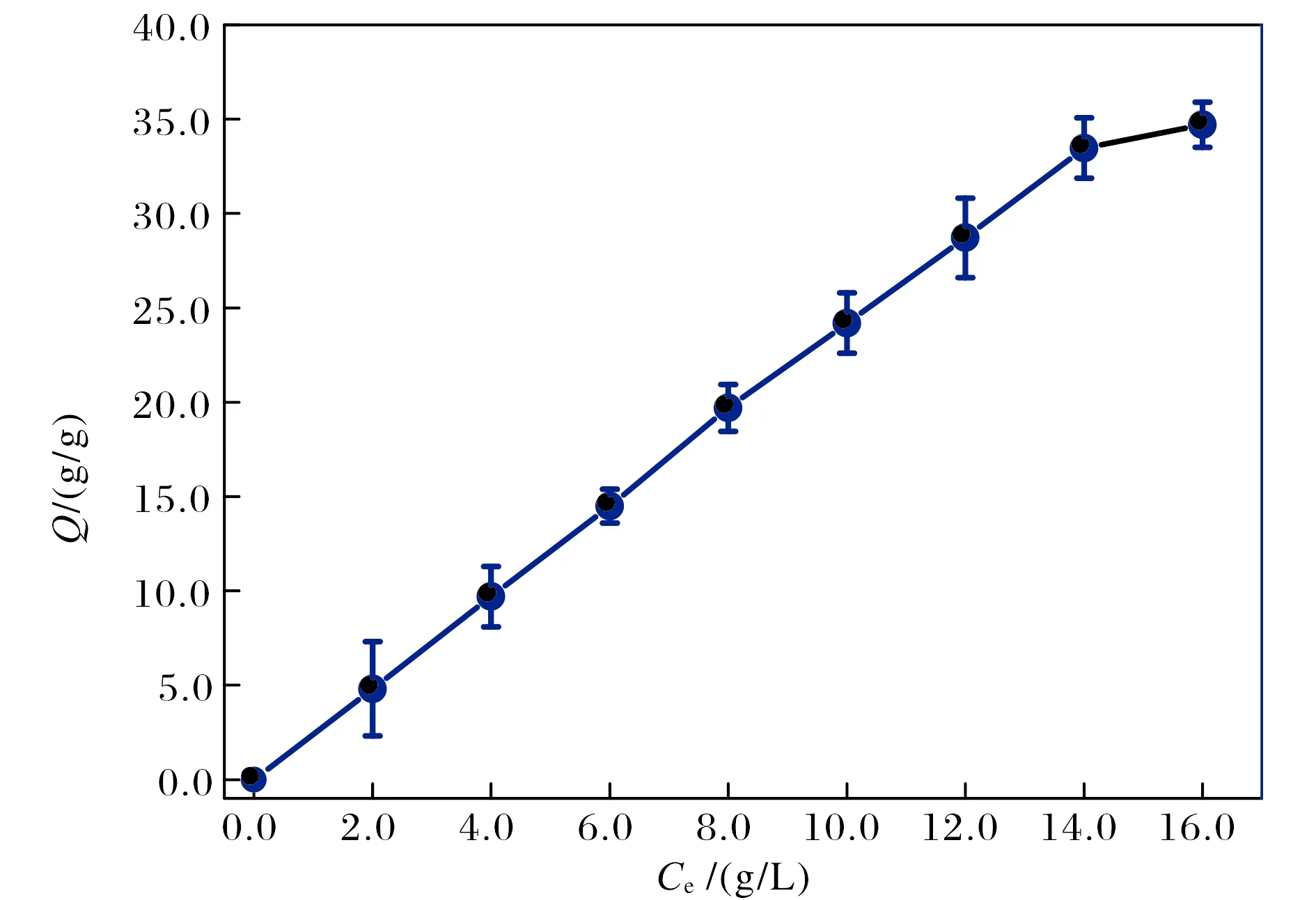
图7 SA-Ca/CMC-Ca@Cu2+材料对BHb吸附的Qe-Ce图
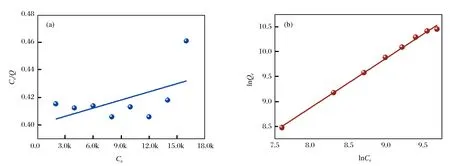
图8 SA-Ca/CMC-Ca@Cu2+材料对BHb吸附的 (a) Langmuir等温吸附方程和 (b) Freundlich吸附等温方程
从表3看出,Freundlich方程的R2值大于Langmuir方程的R2值.因此,SA-Ca/CMC-Ca@Cu2+对BHb的吸附更符合Freundlich等温吸附模型,属于多层吸附,基于上述对材料表面Zeta电势的测定结果,所制备的材料不仅可以通过对含有组氨酸的蛋白进行吸附,也可以通过静电作用对酸性蛋白吸附,所以该吸附机理导致多层吸附的发生.同样,因材料对BHb非常大的吸附量,造成了试验过程当中的误差也较大,因此所得到的理论数值与实际试验所得数值相差较大.
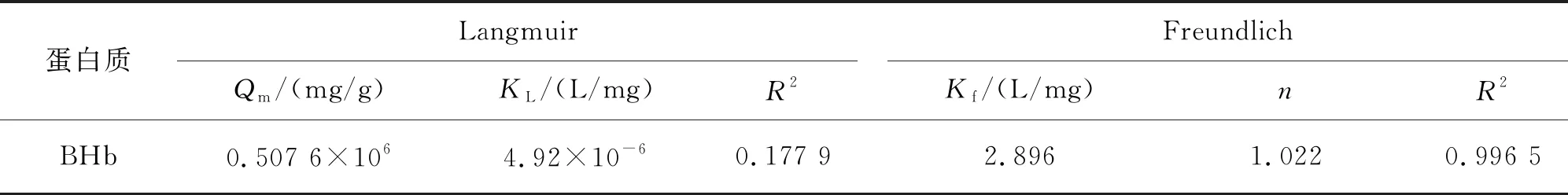
表3 Langmuir等温吸附模型和Freundlich等温吸附模型的相关参数值
2.4 材料对血清中蛋白的去除
利用10 mg SA-Ca/CMC-Ca@Cu2+对200 μL血清进行吸附试验.第一次吸附10 min可以去除血清中80%以上的蛋白质,吸附20 min并且进行第二次20 min的吸附后,血清中蛋白的去除率可达98%以上.我们也进行了凝胶电泳验证,在经过两次吸附后,血清中蛋白的条带消失.该材料可以实现对血清蛋白的高效去除,达到了液相色谱对样品处理的要求,使血清直接进样成为可能.
2.5 核苷的检测
基于上述合成材料对血清中蛋白质的高效去除能力,将其应用于蛋白样品中4种小分子核苷(胞苷、尿苷、肌苷和胸苷)的检测,核苷作为遗传物质的主要组成部分,参与许多重要的生命活动.图9为该试验检测的4种核苷的结构图,在对实际样品进行试验前,首先验证了该材料在不同条件下对核苷化合物的吸附.
图9 4种核苷的结构图
图10为5.0 mmol/L的PBS缓冲溶液(pH在3.0~9.0之间)中,4种核苷化合物被材料吸附前后的上清液的色谱图.在不同pH条件下,材料对4种核苷吸附后所得的色谱峰面积与吸附前相近,说明材料在该pH范围对4种核苷化合物没有吸附作用,可以用于蛋白样品中对蛋白质的吸附去除.
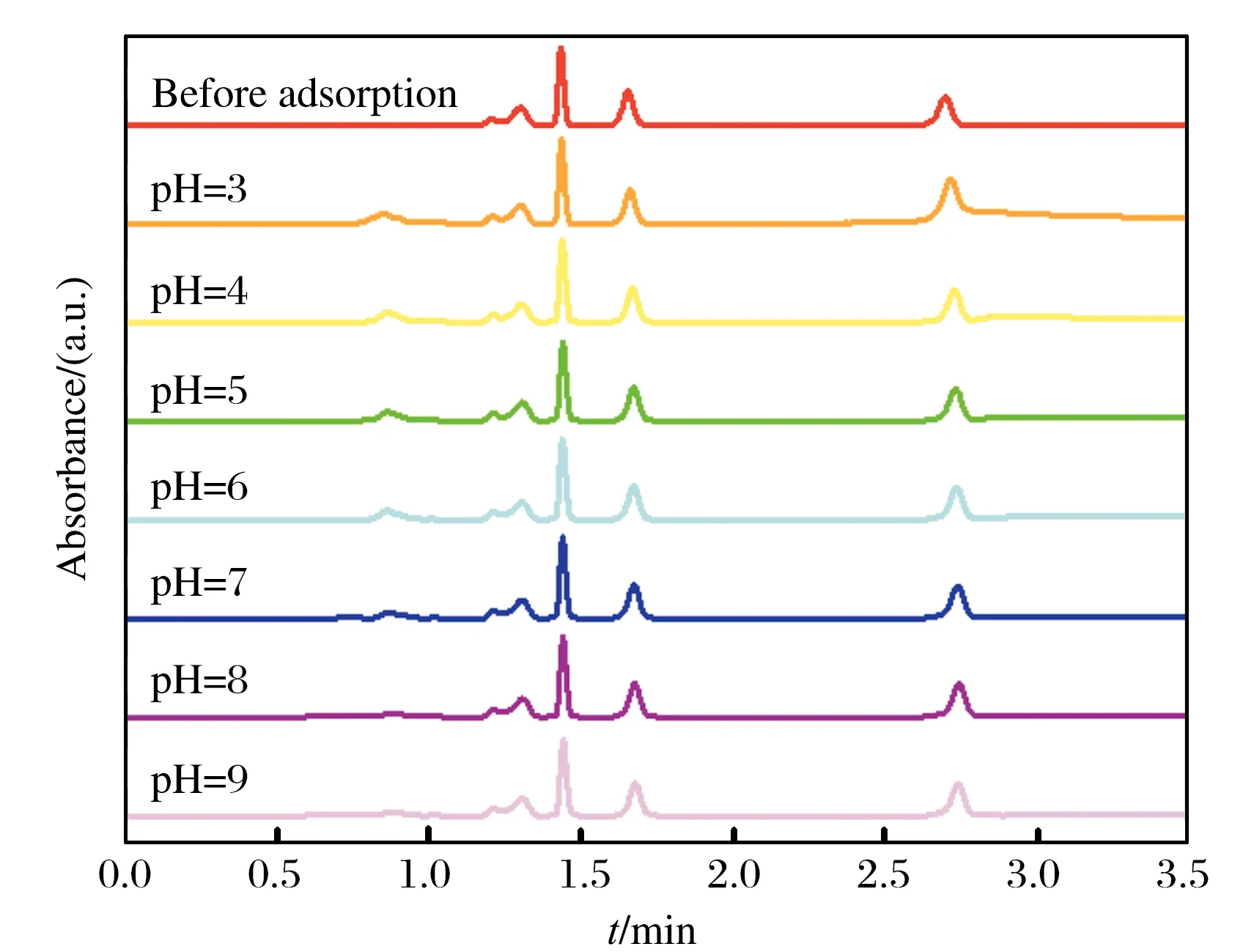
图10 不同pH条件下四种核苷被SA-Ca/CMC-Ca@ Cu2+吸附前后上清液的色谱图
基于人体生理pH条件为7.4,因此我们在pH为7.0的条件下,检测实际血样中4种核苷,并对样品中4种核苷进行加标回收率测定,结果如图11所示、表4所列.由图11及表4可以看出,在空白血清样品中含有少量胞苷、尿苷和肌苷,而胸苷未检出.加标试验结果显示,胞苷、尿苷和胸苷的回收率较为稳定,均在100%左右,而肌苷的回收率较低.从图9可以看出,肌苷结构中N元素量较高,与Cu2+之间产生配位作用的可能性较大,因此可能会在蛋白质吸附过程中,部分肌苷随着材料对蛋白质的吸附而被包埋,随着材料的吸附被一同被离心除去.
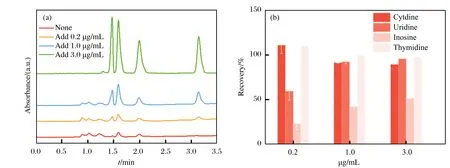
图11 SA-Ca/CMC-Ca@Cu2+对4种核苷加标样品处理前后的 (a) 液相谱图及 (b) 回收率
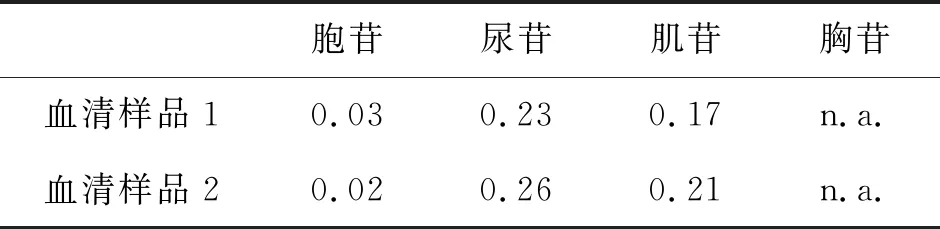
表4 实际血清样品中4种核苷的质量浓度
基于此,所制备的材料可以用于色谱检测中高蛋白样品中蛋白质的去除,进而对与Cu2+无相互作用的小分子化合物进行检测.
3 结论
本试验采用了海藻酸钠和羧甲基纤维素钠对Cu2+的吸附作用,制备了一种低成本的金属亲和吸附剂,进一步利用Cu2+与组氨酸的配位作用对表面具有裸露组氨酸的蛋白质如BHb、BSA进行吸附与去除.在实际样品血清中,对蛋白的去除率可以达到98%以上,满足液相色谱检测过程中对样品处理的要求.该材料可以用于蛋白样品中蛋白质的去除而不影响小分子化合物的测定,有望成为色谱检测过程中,对高蛋白样品中小分子测定的前处理方法.

