儿童急性淋巴细胞白血病临床特征及预后因素分析
陈 茜,李培岭,刘 豹,闫彦睿,石太新
(新乡医学院第一附属医院儿科,河南 卫辉 453100)
在世界范围内,每年约有24万新确诊儿童急性白血病(acute leukemia,AL)病例,其中急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)约占儿童急性白血病的75%~80%,是儿童最常见的恶性肿瘤[1]。近年来,随着分子生物学、细胞遗传学等各学科的发展及综合诊疗技术不断进步,儿童ALL的5年无事件生存率由最初的20%,上升至目前的80%[2],发达国家儿童ALL的总生存率已达到90%[3],虽然儿童ALL整体治疗效果在逐步提升,但仍有20%左右患儿最终复发,导致生存率降低,成为治疗失败的主要原因之一,尤其是存在高危因素的患儿[4]。探讨ALL儿童的临床特征及预后因素,对减少复发、提高生存率有重要意义。因此,本研究对近10年来我院收治ALL儿童的临床资料进行回顾性分析,以期为临床治疗及预后判断提供参考依据。
1 资料与方法
1.1 研究对象
通过病案室检索2008年1月1日-2017年12月31日在新乡医学院第一附属医院就诊且年龄≤14岁急性白血病患儿的共283例,其中ALL患儿169例,通过纳入及排除标准,最后132例患儿有完整的临床及随访资料进行回顾性分析。本研究已获得医院伦理委员会批准(编号:2018124),所有患儿的监护人均签署知情同意书。
纳入标准:年龄≤14岁;符合儿童ALL诊断标准,并依据骨髓形态学、免疫学、细胞遗传学和分子生物学(morphology、immunology、cytogenetics、molecular biology,MICM)进行分型诊断[5];诊断明确后接受规范化治疗。
排除标准:未经我院首诊、初治;诊断明确即放弃或转院治疗或化疗时间小于14天;既往有其他组织起源恶性肿瘤。
1.2 治疗方案
参照儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[5]或CCLG(中国儿童白血病协作组)-ALL-2008方案[6]进行规范的危险度分组治疗。
1.3 随访
通过门诊及电话对患儿进行随访,并建立数据库,随访时间截止至2019年12月31日,中位随访时间58个月,主要记录初诊时主要症状及体征、年龄、性别、白细胞计数、血小板计数和血红蛋白浓度,以及免疫分型、融合基因、染色体、复发部位及时间、死亡原因及时间、最后一次随访时间。
1.4相关定义
总生存率(overall survival,OS)定义为自诊断之日起至任何原因引起死亡或研究观察终止之日;无事件生存率(event free survival,EFS)定义为自诊断之日到发生第1次事件(包括复发、死亡、第2肿瘤、放弃治疗、随访截止的时间)。
1.5统计学处理
使用SPSS 22.0统计学软件进行数据分析,计数资料用例数和百分比表示,率的比较用卡方检验,生存分析采用Kaplan-Meier法,组间生存率比较采用log-rank检验,多因素COX比例回归模型用于分析独立预后因素,P<0.05为差异有统计学意义。
2结果
2.1临床特征
年龄与性别:132例患儿中男性74例(56.06%),女性58例(43.94%),男女比例为1.28∶1,诊断时的中位年龄为5.45岁。其中,1岁以下占2.27%,1~10岁占83.33%,10岁以上占14.39%。临床症状:主要初诊症状发热占39.39%,面色苍黄占29.54%,骨关节疼痛占14.39%,皮肤出血点占9.09%。初诊体征肝肿大占69.70%,脾肿大占61.36%,淋巴结肿大占75.00%。根据危险度分组:低危组67例(50.76%),中危组36例(27.27%),高危组29(21.97%),见表1。

表1 132例ALL患儿初诊临床特征
2.2 实验室检查
外周血象:白细胞<10×109/L占46.98%,白细胞≥10×109/L占53.02%;血红蛋白<110g/L占90.91%,血红蛋白≥110g/L占9.09%;血小板<100×109/L占73.48%,血小板≥100×109/L占26.52%。免疫分型:B细胞型117例占88.64%,T细胞型15例占11.36%。融合基因检查:融合基因检测阳性率28.09%,其中TEL/AML1阳性占10.11%,BCR/ABL阳性占5.62%,E2A/PBX阳性占4.49%,MLL-AF4阳性占3.37%,其它异常融合基因占4.49%。染色体检查:正常核型占86.02%,异常核型占13.98%,其中超二倍体占5.38%,亚二倍体及t(9;22)各占2.15%,其它结构异常占4.30%,见表2。

表2 132例ALL患儿初诊实验室检查
2.3 治疗效果
114例患儿在诱导缓解治疗结束后达完全缓解(complete remission,CR),CR率86.36%;15例(11.36%)患儿因各种原因中途放弃治疗或失访;死亡患儿16例(12.12%),其中因严重感染相关死亡6例,放弃治疗及复发相关死亡7例,出血相关死亡3例;15例(11.36%)患儿复发,复发的中位时间37个月,其中因单独骨髓复发9例,单独中枢神经系统复发4例,睾丸白血病复发1例,另有1例为骨髓及中枢神经系统同时复发;所有患儿均未出现第二肿瘤,见表3。
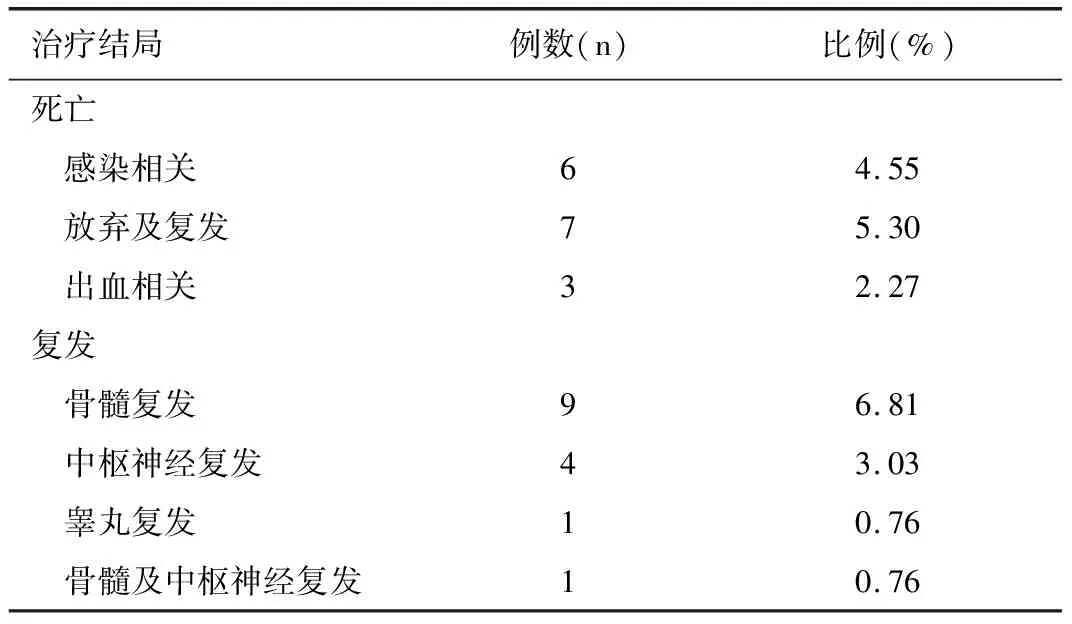
表3 132例ALL患儿治疗结局
2.4 生存情况
本组ALL患儿5年OS率为(85.82±3.39)%,5年EFS率为(70.80±4.17)%,见图1、2。按危险度分组治疗,低、中、高危组患儿5年 EFS率分别为(80.37±5.14)%、(72.26±8.16)%、(46.81±9.58)%,通过Log-rank检验,组间差异有统计学意义(χ2=27.83,P=0.00),见图3。

图1 132例ALL患儿5年总生存率

图2 132例ALL患儿5年无事件生存率

图3 不同危险组的5年无事件生存率比较
2.5 单因素预后分析
单因素分析显示:初诊年龄<1岁、1-10岁、>10岁三组比较,对长期生存率的影响有统计学意义(χ2=15.65,P=0.00);白细胞计数<10×109/L、10-50×109/L、>50×109/L三组比较,对长期生存率的影响有统计学意义(χ2=10.22,P=0.01);正常染色体核型、超二倍体、其他异常核型三组比较,对长期生存率影响有统计学意义(χ2=6.48,P=0.04);低、中、高危三组比较,对长期生存率的影响有统计学意义(χ2=27.83,P=0.00);而性别(χ2=2.12,P=0.14)、血红蛋白(χ2=0.41,P=0.52)、血小板(χ2=3.02,P=0.55)、免疫分型(χ2=2.60,P=0.11)、TEL/AML1(χ2=1.07,P=0.30)对长期生存率的影响均无统计学意义(具体见表4)。

表4 ALL患儿的单因素预后分析[n(%)]
2.6 多因素分析
对有意义的单因素逐步行多因素COX回归分析显示:危险度分组是影响预后的独立危险因素(HR:1.76,95%CI:1.02~3.02,P<0.05),并且随着危险度的升高,其长期生存率明显降低,见表5、图3。

表5 影响预后的多因素COX回归分析
3 讨论
3.1 性别对预后的影响
ALL是一种高度异质性疾病,不同亚型在临床特征、生物学特点、对治疗的反应和复发风险方面有所不同,并与不同的预后相关。ALL在成人及儿童可均发病,据报道,我国15岁以下儿童白血病的发生率约为4/10万,而儿童ALL约占白血病2/3,男女发病比例接近1.6∶1[7],本研究中男女比例为1.28∶1,均为男性占优势。男性因为血睾屏障的存在,不仅有更高的睾丸白血病风险,而且会影响化疗药物的疗效,故既往研究认为男性与不良预后有关,但随着化疗药物的优化及髓外白血病的预防,使得性别对预后无明显影响[8],本研究中性别对预后的影响无统计学意义,与报道相符。
3.2 初诊症状与预后的关系
发热和面色苍黄是本次研究中初诊常见的症状。在最近的一项研究中[9],对203例ALL儿童在确诊前的症状进行了分析,常见的症状是乏力,其次是发热、骨关节疼痛,以及体重减轻等不太常见的症状。这表明在ALL诊断的最初表现中存在相当大的差异性,可能反映了该疾病的生物学变异。很少有关于体格检查阳性结果的研究报道,本研究发现初诊时60%以上ALL患儿有肝、脾、淋巴结肿大,这强调了详细的体格检查在诊断过程中的重要性,对怀疑和证实临床及实验室检查至关重要。
3.3 免疫分型对预后的影响
儿童ALL中T-ALL约占7%~15%,且在诱导失败、早期死亡、复发等风险均高于B-ALL,因而认为T-ALL预后较差[10]。但近年来由于化疗方案的不断优化,T-ALL患儿预后有了显著的改善,亦有研究表明T-ALL相较B-ALL预后并无明显差异[11]。本研究中T-ALL患儿占11.4%,对T系、B系两组患儿的5年EFS进行对比,发现T-ALL的5年EFS低于B-ALL,但两组之间差异无统计学意义,分析可能原因:本研究病例数偏少,且通过将T-ALL纳入中高危组进行高强度的化疗,极大改善了患儿预后。
3.4 染色体和TEL-AML1融合基因对预后的影响
目前ALL的分子生物学及细胞遗传学研究,尤其是对于预后的影响,是国际上研究的热点。Hunger[12]等研究表明TEL-AML1融合基因、超二倍体是有利的预后因素,而存在t(4;11)/MLL-AF4、t(9;22)/BCR-ABL融合基因提示预后较差。本研究中把染色体分为正常染色核型、超二倍体与其它异常核型进行比较,三组对预后的影响有统计学差异,提示染色体为预后影响因素,同时发现正常核型和超二倍体患儿5年EFS明显高于其它异常核型组,且超二倍体组5年EFS最高,支持超二倍体为有利的预后因素,考虑可能与其体内白细胞自发凋亡及白血病细胞内甲氨蝶呤聚谷氨酸酯的浓度增加有关。TEL-AML1融合基因由t(12;21)染色体易位产生,在儿童B-ALL中占20%~25%,被认为是良好的预后因素[13]。本研究中,TEL/AML1阳性检出率为10.1%,阳性组5年EFS率高于阴性组,提示TEL/AML1阳性可能为良好的预后因素,但两者差异无统计学意义,考虑与样本量偏小有关,后续可扩大样本量进一步探究。
3.5 总体生存情况
近年来,儿童ALL整体治疗效果逐步提高,在美国等发达国家儿童ALL的总生存率已达到90%左右[14]。国内陈晓娟等报道[15],应用CCLG-ALL-2008方案治疗580例ALL儿童的5年OS和EFS分别为80.67±0.02%和79.07±0.02%;本研究与国内报道相比,5年OS和EFS与国内报道接近,但与发达国家有差距,仍有进一步提升空间。
3.6 危险度分组对预后的影响
危险度分组是ALL预后和个体化治疗的关键,有研究已证明不同危险程度的患儿有着不同的预后,根据患儿不同的临床及生物学特性,进行适当的危险度分组和个体化治疗,可以减少不良反应,提高患儿长期生存率和生活质量[16]。本研究多因素COX回归分析显示:危险度分组是影响患儿EFS的独立预后因素,与文献报道一致。本研究也有局限性,包括其回顾性、相对较小的样本量,故在未来可考虑进行大样本、前瞻性的研究,并将泼尼松诱导反应、微小残留病灶水平等与预后相关的重要因素纳入分析。
综上所述,充分认识ALL患儿的临床特征,对于临床治疗及预后判断有很大的指导意义。危险度分组是决定长期生存率的重要预后因素,根据危险度分组指导选择个体化的治疗方案,有助于提高生存率。儿童ALL的发病是一个复杂的过程,病因及发病机制未完全明确,尚需更多中心、大样本的长期临床观察来提高我国ALL儿童临床特征的认识和进行更加深入的预后研究。

