硫氧还蛋白相互作用蛋白在结肠癌中表达的变化及其调节结肠癌细胞增殖机制研究
席连峰
(河南省滑县中心医院普外科 滑县456400)
结肠癌是我国发病率较高的消化道恶性肿瘤之一,且近年来发病率呈逐步升高趋势[1]。其发生与环境、饮食、遗传因素及多种基因表达异常有关,但具体发病机制仍未完全阐明。硫氧还蛋白相互作用蛋白(TXNIP)是一类氧化还原调节蛋白,与硫氧还蛋白结合后能够使硫氧还蛋白清除自由基的抗氧化作用减弱,进而使细胞内自由基增多并影响细胞增殖活力。已有研究报道,TXNIP在食管癌、乳腺癌等多种恶性肿瘤中均呈显著的低表达趋势,提示TXNIP可能具有抗肿瘤作用[2~3]。为了明确TXNIP在结肠癌发生发展中的生物学作用,本研究首先通过临床样本分析了TXNIP在结肠癌中表达变化,而后通过离体培养结肠癌SW480细胞分析了TXNIP调节结肠癌细胞增殖的机制。现报道如下:
1 资料与方法
1.1 临床样本信息 选取2018年3月~2019年12月在我院接受根治性手术治疗的结肠癌患者的结肠癌组织和癌旁组织,共54例。所有患者均经术后病理证实为结肠癌,术前未接受过放化疗或其他抗肿瘤治疗,临床病理资料完整。获得结肠癌组织和癌旁组织后,在液氮内冷冻30 min后取出,放入超低温冰箱保存备用。
1.2 实验材料SW480细胞株购自中科院上海细胞资源中心,TXNIP慢病毒购自上海吉玛公司,p38 MAPK抑制剂SB203580购自Sigma公司,RIPA蛋白裂解液、BCA蛋白定量试剂盒购自上海碧云天公司,MTS细胞增殖活力检测试剂盒购自Promega公司,TXNIP、CyclinD1、Bcl-2、p53的单克隆抗体购自Abcam公司。多功能酶标仪及化学显影仪均购自Bio-rad公司。
1.3 实验方法
1.3.1 细胞培养及分组SW480细胞用含有10%胎牛血清(FBS)的DMEM进行贴壁培养,贴壁细胞铺满90%后用胰蛋白酶进行消化并按1:3比例传代;传代得到足够数量的SW480细胞后进行分组,对照组用不含药物的DMEM处理,TXNIP组用TXNIP慢病毒感染,TXNIP+SB组用TXNIP慢病毒感染并用含20μmol/L的SB203580 DMEM处理。
1.3.2 细胞增殖活力检测SW480细胞接种在96孔培养板内,不同条件处理24 h后向培养孔内加入MTS试剂盒的检测液、20μl/孔,在培养箱内继续培养4 h后取出,充分震荡培养板并在酶标仪上检测波长490 nm处的吸光值、记录为OD值。
1.3.3 Western blot检测 结肠癌组织和癌旁组织,用RIPA蛋白裂解液对组织进行裂解并提取蛋白;SW480细胞接种在6孔培养板内,不同条件处理24 h后用RIPA蛋白裂解液对细胞组织进行裂解并提取蛋白。得到蛋白后,用BCA试剂盒测定总蛋白含量并取30μg进行Western blot检测,将蛋白样本加入聚丙烯酰胺凝胶中并进行电泳、电转膜、5%脱脂牛奶封闭及TXNIP、CyclinD1、Bcl-2、p53第一抗体孵育过夜。第2天,孵育第二抗体后在化学显影仪中曝光得到蛋白条带,根据条带的灰度值计算蛋白表达量。
1.4统计学方法 采用SPSS22.0统计学软件分析数据,计量资料的两组间比较采用t检验、三组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 结肠癌中TXNIP表达的变化 结肠癌组织和癌旁组织中TXNIP的表达量分别为(0.36±0.07)和(0.91±0.16)。结肠癌组织中TXNIP的表达量明显低于癌旁组织,差异有统计学意义(t=23.142,P=0.000)。见图1。

图1 结肠癌组织和癌旁组织中TXNIP的蛋白条带
2.2 不同病理特征结肠癌中TXNIP表达的比较不同直径结肠癌中TXNIP的表达量比较无显著性差异(P>0.05);TNMⅢ期结肠癌中TXNIP的表达量明显低于TNMⅠ~Ⅱ期结肠癌(P<0.05);低/未分化结肠癌中TXNIP的表达量明显低于中/高分化结肠癌(P<0.05);合并淋巴结转移的结肠癌中TXNIP的表达量明显低于不合并淋巴结转移的结肠癌(P<0.05)。见表1。
表1 不同病理特征结肠癌中TXNIP表达比较(±s)

表1 不同病理特征结肠癌中TXNIP表达比较(±s)
?
2.3 TXNIP慢病毒对SW480细胞增殖活力的影响TXNIP组SW480细胞的OD值明显低于对照组(P<0.05);TXNIP+SB组SW480细胞的OD值明显高于TXNIP组(P<0.05)。见图2。

图2 三组SW480细胞增殖活力的比较
2.4 TXNIP慢病毒对SW480细胞中增殖基因表达的影响TXNIP组SW480细胞中CyclinD1、Bcl-2表达量明显低于对照组,p53表达量明显高于对照组(P<0.05),TXNIP+SB组SW480细胞中CyclinD1、Bcl-2的表达量明显高于TXNIP组,p53的表达量明显低于TXNIP组(P<0.05)。见图3,表2。
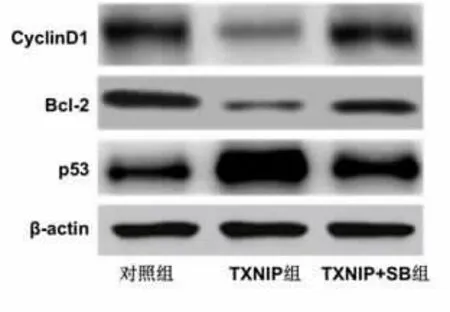
图3 三组SW480细胞中CyclinD1、Bcl-2、p53的蛋白条带
表2 三组SW480细胞中CyclinD1、Bcl-2、p53表达量比较(±s)

表2 三组SW480细胞中CyclinD1、Bcl-2、p53表达量比较(±s)
注:与对照组比较,*P<0.05;与TXNIP组比较,#P<0.05。
?
3 讨论
TXNIP是一类氧化还原调节蛋白,既拮抗硫氧还蛋白的抗氧化功能,也能调节细胞内的线粒体功能,最终实现对细胞增殖的抑制作用及对细胞凋亡的促进作用。已有多项离体细胞实验证实,过表达TXNIP能够使肝癌、前列腺癌、肺癌等多种恶性肿瘤细胞的凋亡被增强、增殖受抑制[4~5]。提示TXNIP能够在离体恶性肿瘤细胞中发挥抗肿瘤作用。本研究在此基础上具体分析了TXNIP在结肠癌发生发展过程中是否发挥抗肿瘤作用,通过分析结肠癌中TXNIP表达的变化可知:结肠癌组织中TXNIP的表达明显减少且TNMⅢ期、低/未分化、合并淋巴结转移的结肠癌中TXNIP表达减少的趋势较TNMⅠ~Ⅱ期、中/高分化、不合并淋巴结转移的结肠癌组织更为明显。说明TXNIP的低表达不仅参与了结肠癌的发生,还在结肠癌的病理进程中起到调控作用。结合TXNIP在离体细胞中抑制增殖、促进凋亡的作用推测,低表达的TXNIP能够使其增殖抑制作用减弱,进而促进了结肠癌的发生与发展。
本研究为了验证关于TXNIP调控结肠癌细胞增殖的推测,进一步以SW480结肠癌细胞株作为实验对象,通过感染TXNIP慢病毒的方式使细胞中TXNIP发生过表达,在过表达TXNIP后对细胞增殖进行检测。结果显示,TXNIP组细胞的增殖活力明显低于对照组,说明过表达TXNIP能够降低SW480细胞的增殖活力、TXNIP具有抑制结肠癌细胞增殖的作用。CyclinD1、Bcl-2、p53是已知与结肠癌增殖和凋亡调控密切相关的基因,CyclinD1能够在细胞周期中起到正向调控作用,加速细胞周期并使大量细胞进入有丝分裂阶段、进而促进细胞增殖[6]。Bcl-2能够在细胞凋亡中起到抑制作用,通过减少线粒体中细胞色素C的释放来抑制线粒体途径凋亡的发生,进而有利于细胞增殖[7]。p53能够在细胞凋亡中起到正向调控作用,一方面通过增强caspase的活性来促进细胞凋亡,另一方面通过诱导细胞周期停滞来抑制细胞增殖[8]。本研究对上述增殖基因分析显示,TXNIP组细胞中CyclinD1、Bcl-2的表达明显减少,p53表达明显增多,这一结果与细胞增殖活力的变化相吻合,说明TXNIP能够使结肠癌细胞的增殖受到抑制。
在明确TXNIP参与结肠癌细胞增殖的调控后,本研究进一步深入探究了介导该调控作用的分子机制。糖尿病相关细胞实验证实TXNIP能够通过激活p38 MAPK通路来促进胰岛MIN6细胞发生凋亡[9];肝脏相关的动物实验证实敲除TXNIP后能够通过抑制p38 MAPK的激活来减轻肝细胞的缺血再灌注损伤。p38 MAPK属于MAPK家族,发生活化后对细胞凋亡、细胞增殖、细胞周期等环节均具有调控作用[10]。SB203580是p38 MAPK激活的抑制剂,本实验在过表达TXNIP的同时联合使用SB203580,当p38 MAPK的激活被SB203580抑制后,TXNIP抑制SW480细胞增殖、调节SW480细胞中增殖基因表达的作用均明显减弱,说明TXNIP抑制结肠癌细胞增殖的作用与p38 MAPK的激活有关。p38 MAPK通路的激活部分介导了TXNIP对结肠癌细胞增殖及相关基因表达的调控效应。
综上所述,结肠癌中TXNIP的表达明显减少且TXNIP能够通过激活p38 MAPK通路来抑制结肠癌细胞增殖,今后可进一步设计动物实验来验证TXNIP对结肠癌移植瘤生长的调控作用。

