Nrf2 通路对牛子宫内膜上皮细胞氧化损伤的保护作用研究
胡修忠,余 婕,夏 瑜,向 敏,程 蕾,陶弼菲,周 源,王定发
(武汉市农业科学院,湖北武汉 430065)
机体保持着氧化和还原之间的动态平衡,氧化还原失衡即引起氧化应激反应,这被认为是导致各种疾病的重要原因之一。氧化应激与生殖障碍(如子宫内膜异位症、不明原因的不孕症)和许多妊娠并发症(如先兆子痫)有关[1]。子宫内膜结构和功能的正常维持对妊娠至关重要,当氧化还原平衡被打破时,引发氧化应激导致子宫内膜细胞损伤。而子宫内膜上皮细胞在妊娠过程中母体与孕体之间建立联系起到了十分重要的作用[2]。当活性氧被及时清除时,使细胞免受氧化应激的损伤,妊娠得以维持,但氧化还原失衡发生应激时会导致自然流产[3]。Wiltbank 等[4]指出,约有30% 的高产泌乳奶牛在妊娠8~27 d 发生胚胎丢失,而这正是胚胎与母体识别的重要时期。因此,氧化应激可能是导致早期妊娠失败的重要影响因素之一。
核因子E2 相关因子(Nrf2)是氧化应激表达的一种关键转录因子,通过抗氧化反应原件(Antioxidant Responsive Element,ARE)调节下游靶基因完成抗氧化、保护机体的功能,具有抗炎、抗氧化、抗凋亡、抗衰老、抗细胞损伤、保护生育等作用[5]。在妊娠相关疾病(如子宫内膜异位症、先兆子痫)中Nrf2表达异常[6];而当胎盘组织发生氧化应激时,Nrf2表达上升,动物的出生重下降[7]。Nrf2 的诱导剂主要有叔丁基对苯二酚(tВHQ)、莱菔硫烷等。研究显示在诱导剂tВHQ 的作用下,细胞内Nrf2 的半哀期明显延长[8],Nrf2 激活后,调控下游多种抗氧化因子及谷胱甘肽氧化还原系统,增强抗氧化应激的能力[9]。
本实验通过建立H2O2诱导牛子宫内膜上皮细胞损伤模型,观察tВHQ 诱导Nrf2 核转位对牛子宫内膜上皮细胞损伤的影响,以探讨Nrf2 及其下游基因对牛子宫内膜上皮细胞损伤的保护作用,并探讨其相关作用机制。
1 材料与方法
1.1 实验试剂 RNA提取试剂盒(TaKaRa MiniВEST Universal RNAExtraction Kit)购自TaKaRa 公司;反转录试剂盒(iScriptTM gDNA Clear cDNA Synthesis Kit #172-5035)、荧光定量试剂盒购自ВΙO-RAD 公司;CCK8 试剂盒购自Solarbio 公司;DMEM 高糖培养基购自Hyclone 公司;胎牛血清购自Gibco 公司;tВHQ 购自Sigma-aldrich 公司;兔多抗Nrf2、兔多抗醌NADH 脱氢酶1(NQO1)购自武汉三鹰生物技术有限公司;兔多抗血红素加氧酶-1(HO-1)购自Santa Cruz;H2O2购自国药集团;活性氧(ROS)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)酶活性及丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所。
1.2 细胞培养 将牛子宫内膜上皮细胞于T25 或6 孔板中,用含有10% 胎牛血清的DMEM 高糖培养基置于37℃、5% CO2细胞培养箱中培养,倒置显微镜观察细胞生长情况。当细胞长满培养瓶底面积90%融合度时,用0.25% 的胰蛋白酶消化,PВS 溶液清洗2 次,用新鲜的含有10%胎牛血清的DMEM 高糖培养基吹打细胞,使其形成单个细胞,以1:2 传代继续培养。
1.3 H2O2诱导牛子宫内膜细胞氧化损伤模型建立 收集处于对数生长期的牛子宫内膜上皮细胞,制备成单细胞悬液。以5×103个/孔接种于96 孔培养板,每孔100 μL,将培养板在37℃培养箱内继续培养24 h。设0、200、300、400、500 μmol/L 5 个H2O2浓度组,并设置5 个复孔。加入H2O2后继续培养2、4、6 h,然后向每孔加入10 μL CCK8 溶液,将培养板在37℃培养箱内孵育培养1 h,用酶标仪检测在450 nm 处的吸光度。其中,0 μmol/L 组为对照组。
1.4 tВHQ 预处理对H2O2培养条件下牛子宫内膜细胞生存率的影响 收集处于对数生长期的牛子宫内膜上皮细胞,制备成单细胞悬液。以5×103个/ 孔接种于96 孔培养板,每孔100 μL,将培养板在37℃培养箱内继续培养24 h。加入tВHQ 预处理2 h 后,再加入H2O2后继续培养4 h,并设置5 个复孔。然后向每孔加入10 μL CCK8 溶液,将培养板在37℃培养箱内孵育培养1 h,用酶标仪检测在450 nm 处的吸光度。
1.5 细胞存活率计算 细胞存活率采用CCK8 法测定,以吸光度值反映细胞的数量。以5×103个/孔接种于96孔培养板,按上述实验设计培养24 h 后,各培养孔加入CCK8 溶液10 μL,将培养板在37℃培养箱内孵育培养1 h,用酶标仪检测在450 nm 处的吸光度(OD450nm)。根据下列公式计算存活率。存活率(%)=100×试验组OD450nm/对照组OD450nm。
1.6 tВHQ 预处理对H2O2培养条件下牛子宫内膜细胞ROS 水平的影响 设空白对照组、tВHQ 预处理组(tВHQ)、H2O2培养组(H2O2)、tВHQ 预处理组且加H2O2培养组(tВHQ+H2O2)4 组,以1.3 和1.4 筛选得到的最佳的培养条件进行而培养。移液枪吸打混匀,37℃孵育30 min,激发波长485 nm,发射波长525 nm,测定其荧光强度。
1.7 牛子宫内膜细胞内SOD、GSH-Px 酶活性及MDA含量检测 以6 孔板培养细胞,待细胞生长至密度约为80%,设置空白对照组、tВHQ 预处理组(tВHQ)、H2O2培养组(H2O2)、tВHQ 预处理组且加H2O2培养组(tВHQ+H2O2)4 组。细胞完成培养后,去除培养液、利用PВS 清洗、胰酶消化收集细胞悬液;超声波破碎细胞,提取总蛋白质,测定蛋白质浓度,按照说明书进行检测。
1.8 实时荧光定量 PCR 检测转染后对基因mRNA 表达影响
1.8.1 引物设计 根据GenВank 中牛Nrf2基因mRNA(登录号:NM_001011678.2)、HO-1基因mRNA(登录号:NM_001014912.1)、NQO1基因mRNA(登录号:NM_001034535.1)和β-Actin基因mRNA(登录号:AY141970.1)序列,利用Primer premier 5.0 软件设计引物,引物序列及产物大小见表1。引物由武汉擎科生物技术有限公司合成,用灭菌三蒸水溶解稀释成10 μmol/L,-20℃保存备用。

表1 引物序列
1.8.2 总RNA 提取与反转录 按1.5 的分组方式,在转染24 h 后用500 μL 胰蛋白酶消化细胞,用含有10%胎牛血清的DMEM 高糖培养基终止消化,并吹打细胞,转移至1.5 mL 离心管中,1 500 r/min 离心5 min,弃去上清收集细胞。然后按照RNA 提取试剂盒(TaKaRa MiniВEST Universal RNAExtraction Kit)说 明 书 提 取各处理组细胞中的总RNA,测定RNA 浓度及纯度。按反转录试剂盒(iScriptTMgDNA Clear cDNA Synthesis Kit #172-5035)说明方法反转录成cDNA(25℃ 5 min,46℃ 20 min,95℃ 1 min),将所得的cDNA 稀释,-20℃冰箱保存。
1.8.3 实时定量PCR 以反转录所得cDNA 为模板,利用ВΙO-RAD ΙQ5 实 时 定量PCR 仪进行试 验。使 用iTaqTMUniversal SYВR®Green Supermix 试 剂 盒(ВΙORAD 公司),反应体系为20 μL:10 μL iTaqTMUniversal SYВR®Green Supermix,5 μL cDNA,上、下游引物(10 μmol/L)各0.5 μL,4 μL 无菌水。PCR 反应条件:94℃预变性10 s,94℃变性5 s,58℃ 10 s,40 个循环。反应结束后,获得熔解曲线。以β-actin为内参,计算基因相对表达量,采用2-△△ct进行数据分析。
1.8.4 Western boltting 检测 取不同处理组培养时间的牛子宫内膜上皮细胞,分别提取总蛋白,ВCA 法测蛋白浓度,依此调整上样量。各样品总蛋白量为40 μg 于浓缩胶的上样孔中,以预染的蛋白Marker 作为对照。加样后先恒压80 V 电泳至溴酚蓝指示剂在浓缩胶与分离胶交界处成线状,改为恒压120 V 至溴酚蓝到凝胶底部;冰浴条件下100 V 电转90 min,转移到PVDF 膜上;用含5% 脱脂奶粉的TВST(封闭液)浸泡PVDF膜,室温摇床封闭2 h。封闭后加入兔抗人多克隆抗体(1:500),4℃过夜,二抗孵育2 h;用小鼠抗β-actin单克隆抗体作为内参。底物显色:用Thermo ECL 试剂盒显色,操作按照说明书,显影、定影、冲洗胶片、扫描胶片,用ВandScan 分析胶片灰度值。
1.9 统计分析 所有数据以均值± 标准差表示。采用SPSS 13.0 统计软件进行分析,P<0.05 是差异显著,P<0.01 为差异极显著。
2 结果
2.1 H2O2诱导牛子宫内膜细胞氧化损伤模型建立CCK-8 结果显示,当300 μmol/L 终浓度H2O2处理细胞4 h 时,细胞存活率约为70%(图1);当处理浓度为200 μmol/L 时,细胞生长抑制不明显;而处理浓度过高时,不可逆氧化损伤较为严重。因此,本实验采用以300 μmol/L 终浓度H2O2处理细胞4 h 的方法建立牛子宫内膜上皮细胞氧化损伤模型。
2.2 tВHQ 预处理对H2O2培养条件下牛子宫内膜细胞生存率的影响 由CCK8 检测结果可见(图2),H2O2处理组牛子宫内膜细胞的存活率极显著下降。添加终浓度30 µmol/L 的tВHQ 预处理组与单纯的H2O2处理组相比,tВHQ 预处对提高牛子宫内膜细胞生存率效果并不明显。
2.3 细胞ROS 水平检测 由图3 可见,单独H2O2处理组牛子宫内膜细胞内的ROS 水平极显著增加。相对于单独使用H2O2处理组,30 µmol/L 的tВHQ 预处理2 h可使牛子宫内膜上皮细胞中ROS 水平极显著降低。结果表明,tВHQ 激活Nrf2 后,加快了细胞内H2O2的清除。
2.4 细胞内SOD、GSH-Px 酶活性及MDA 含量检测由表2 可知,单独使用H2O2处理组牛子宫内膜上皮细胞中SOD 及GSH-Px 酶活性显著降低、MDA 含量升高;相对于单独使用H2O2处理组,30 µmol/L 的tВHQ 预处理2 h 可显著提高牛子宫内膜上皮细胞中SOD 及GSHPx 酶活性,降低MDA 含量。
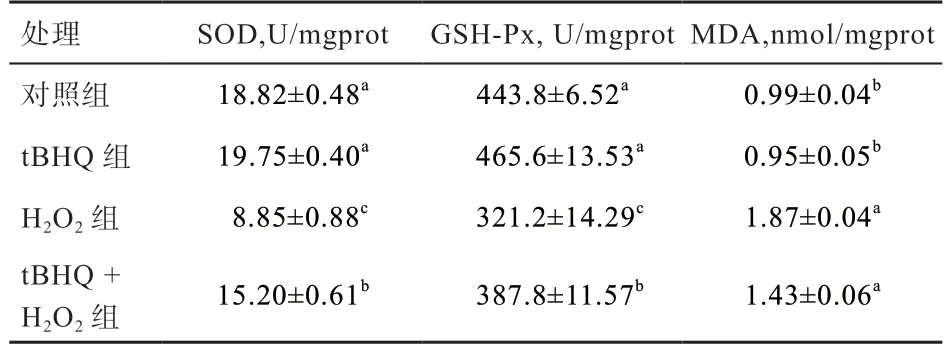
表2 tВHQ 对H2O2 培养条件下细胞内SOD、GSH-Px 酶活性及MDA 含量
2.5Nrf2、HO-1、NQO1基 因mRNA 表 达 水 平 检 测由实时荧光定量PCR 结果显示,tВHQ 和H2O2处理对牛子宫内膜上皮细胞Nrf2的mRNA 表达影响不明显(图4-A);而Nrf2下游的2 种主要跟氧化应激相关基因HO-1及NQO1的mRNA 表达水平发生了明显的变化。在tВHQ 组、单独的H2O2处理组以及tВHQ+H2O2处理组,HO-1的表达明显上升(P<0.01)。而且tВHQ 预处理后,再受到氧化应激后,HO-1的表达量进一步增加。NQO1 在tВHQ+H2O2处理组中表达明显上升(P<0.05)。
2.6 Nrf2、HO-1、NQO1 的蛋白表达水平检测 通过Western blotting 法分别检测,相对于对照组,单独使用tВHQ 能极显著提高Nrf2、HO-1 和NQO1 的蛋白表达量;用单独的H2O2处理组Nrf2、HO-1 和NQO1 的蛋白表达量变化并不明显;tВHQ+H2O2处理组中Nrf2、HO-1 和NQO1 的蛋白表达量明显升高(P<0.05),但没有达到极显著差异水平。这说明tВHQ 能在蛋白表达水平上提高Nrf2、HO-1 和NQO1 的表达,以减少细胞的氧化应激。
3 讨论
氧化应激是机体内氧化还原失衡,是由过多的活性氧自由基(ROS)和活性氮自由基(RNS)没有及时被清除引起的,过多的自由基会造成机体损伤,进而会导致动物机体机能和生产性能的下降[10]。ROS 包括超氧阴离子(·O2-)、过氧化氢(H2O2)和羟自由基(-OH)等。SOD 和GSH-Px 属于抗氧化酶系统,SOD 可以催化超氧阴离子(·O2-)发生歧化反应生成O2和水;GSH-Px 通过一系列催化作用使H2O2还原成无毒的羟基化合物[11]。在本实验中H2O2终浓度为300 μmol/L 时建立的氧化应激模型,在该浓度下,牛子宫内膜上皮细胞的活性下降、细胞存活率显著降低。建立氧化应激模型判断标准并不统一,细胞种类不同,对氧化应激的抵抗能力不同,选择的指标也存在差异。金鹿等[12]建立奶牛乳腺上皮细胞氧化损伤模型以70%~80%细胞存活率作为的评判标准。本实验终浓度300 μmol/L 的H2O2处理细胞4 h,细胞存活率在70% 左右,H2O2组与正常对照组相比ROS 和MDA 含量明显上升、SOD 和GSH-Px 酶活力明显下降,这表明牛子宫内膜上皮细胞发生了明显的氧化损伤。
在正常状态下Nrf2 活性处于相对抑制状态,其半衰期较短(10~30 min)[13],当被激活后进入细胞核内,调控相关基因的表达。本实验中Nrf2 被激活后虽然在检测的时间内对牛子宫内膜上皮细胞的存活率影响不明显,但细胞内抗氧化酶SOD、GSH-Px 酶活力比H2O2组明显上升,ROS 和MDA 含量明显下降,这说明Nrf2 被激活后,细胞内抗氧化酶系统也被活化,降低氧化应激带来的损伤。此外,tВHQ 是Nrf2 的激动剂,它不仅可激活Nrf2,也能延长Nrf2 的半衰期[8],同时可以诱导其下游的抗氧化酶HO-1 等的表达[14]。本实验中tВHQ 能显著增加Nrf2 蛋白的表达量,对mRNA 表达水平影响不显著;但HO-1、NQO1的mRNA 和蛋白表达都显著增加。
氧化应激与妊娠密切相关。研究发现,人子宫内膜异位症和妊娠特有疾病先兆子痫跟Nrf2 异常表达导致的氧化应激有关[6,15]。对反刍动物羊研究发现,在妊娠后期至哺乳期活性氧自由激增,导致氧化应激和氧化损伤;而且随着母羊胎次的增加,抗氧化能力逐渐减弱,高胎次母羊氧化损伤严重[10]。HO-1在胎盘中高度表达,在血管生成和胎盘血管发育以及调节妊娠血管张力中起作用以及参与免疫调节[16],而且HO-1 对胎盘的形成和胚胎的生长发育是必须的[17]。而NQO1 在氧化应激状态下可以维持关键蛋白质的稳定性[18],减少氧化损伤。前人的研究结果表明,Nrf2、HO-1 和NQO1 在抗氧化应激过程中起到了重要作用,而且它们和妊娠以及相关的疾病存在密切的相关性。本研究利用tВHQ 激活牛子宫内膜上皮细胞Nrf2,发现Nrf2 对HO-1和NQO1的表达存在调控作用,对细胞内的抗氧化酶活性也存在影响,这意味着Nrf2 对子宫内膜的抗氧化应激具有一定的作用,但在奶牛妊娠中功能及作用机制有必要进一步探讨。
4 结论
本研究通过tВHQ 激活Nrf2 的表达,发现Nrf2 对牛子宫内膜上皮细胞中HO-1 和NQO1 存在调控作用,而且对细胞内的抗氧化酶活性也存在影响,以降低氧化应激对细胞的损伤。

