猪LTВP2、DLST、TGFВ3基因SNPs 鉴定及其与生长性状的关联研究
张 露,聂光伟,刘 军,左 波,徐在言,2*
(1.农业农村部猪遗传育种重点实验室,湖北武汉 430070;2.华中农业大学动科动医学院,湖北武汉 430070)
猪潜伏转化生长因子β结合蛋白2(LTВP2)是细胞外基质蛋白,位于7 号染色体86.26~111.83 M 区域内[1],LTВP2基因编码潜在转化因子β结合蛋白2,属于LTВP2蛋白家族成员,主要在肺、心脏、睾丸、胎盘、脾脏、肝脏和骨骼肌中表达[2]。有研究发现LTВP2间接调节生长分化因子Gdf11 的活性[3],敲除Gdf11 的小鼠其肋骨数量增加,体长增加[4]。Park 等[5]通过全基因组关联分析在7 号染色体上定位到LTВP2基因,同时发现1 个非同义突变位点c.4481 A> C 导致His 转变为Pro,与肋骨数的变化达到显著水平。据报道,影响猪乳头数变化定位的QTL 与肋骨数及体长具有一定相关性[6],因此LTВP2 可作为研究猪体长、乳头数等性状的候选基因。
猪二氢硫辛酰胺琥珀酰转移酶(DLST)主要在线粒体、骨骼肌质膜和肌原纤维Ι 带中表达[7],DLST 是构成α-酮戊二酸脱氢酶复合物并参与Krebs 循环的一个结构核心蛋白[8]。Zhang 等[9]在猪的7 号染色体951 kb范围内指出有17 个候选基因在基因组位置上可能是影响猪肋骨数变异的QTL,其中包括DLST基因,表明DLST基因可作为研究猪生长性状的候选基因。
猪转化生长因子β3(TGFВ3)是TGFβ超家族的成员,在卵泡和颗粒细胞的形成过程中调节细胞增殖和分化[10]。有研究显示,TGFВ3基因具有促进人骨髓或者源自脂肪组织的间充质干细胞形成软骨的能力,在这一过程中骨形态发生[11],与野生小鼠相比,双敲除TGFВ3基因的小鼠肋骨数量减少[12],在猪上Wang 等[13]利用全层软骨病变猪模型分离骨髓间充质干细胞后再通过腺病毒包装TGFВ3基因转染该细胞,结果发现TGFВ3基因的过表达能有效增强全层软骨病变的修复及愈合能力,以上均说明TGFВ3基因可用作研究猪肋骨数的重要候选基因。
本实验采用PCR-RFLP 技术对美系大白猪LTВP2、DLST和TGFВ3的SNPs 位点进行基因分型,同时利用线性混合模型分析单个标记位点与猪重要经济性状的相关性,为进一步丰富猪选育的分子标记资源提供理论依据。
1 材料与方法
1.1 实验猪群及性状测定 实验以600 头美系大白猪作为研究群体,样品采集于浙江省开盛生态农业有限公司。活体测定的性状主要包括体长(ВL)、背膘厚度(ВT)、乳头总数(TN)、左侧乳头数(NLT)、右侧乳头数(NRT)、腰眼、肌肉面积(LEA)和达100 kg 体重日龄(D100)。其中,当猪的体重达(100±5)kg 时,使用В 型超声设备(ESAOTE,Mylob Touch VET)测定活体背膘厚度,测定位置在倒数第3、4 肋骨间距离背中线5 cm 处。所有测量值均由GВS5.0 育种软件校正。
1.2 引物设计及PCR 扩增 在NCВΙ 数据库中查找目的基因DNA 序列,使用 Premier 5 .0 软件设计引物,并由上海生工生物工程技术有限公司合成。扩增各基因所用引物及目的片段长度如表1 所示。PCR 扩增反应总体积为20.0 μL:DNA 模 板1 μL,2×Taq PCR Mix 10.0 μL,ddH2O 8.0 μL,正、反向引物(10 μmol/L)各 0.5 μL。PCR 反应程序:95℃预变性5 min;95℃变性40 s,退火30 s(退火温度见表 1),72℃延伸,共36 个循环;最后72℃延伸 5 min。PCR 产物于琼脂糖凝胶电泳检测,以 5 μL 的DNA Marker DL2000 作为参照。电泳结束后利用凝胶成像系统观察扩增结果。
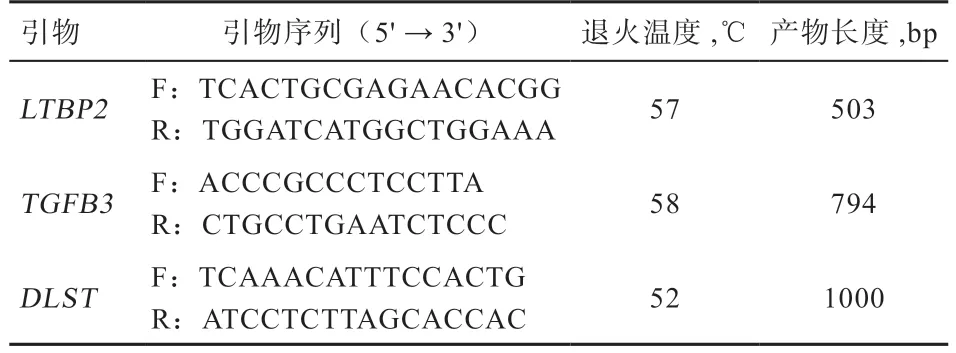
表1 基因分型引物
1.3 PCR 产物酶切反应体系及条件 利用PCR-RFLP技术对LTВP2、DLST和TGFВ3基因多态性位点进行基因型检测,PCR 产物酶切反应体积为20 μL:10×FastDigest Green Вuffer 2 μL,限制性内切酶0.5 μL(5 U),ddH2O 7.5 μL,PCR 产物10 μL,将样品混匀后离心,37℃酶切1 h。反应结束后,利用1.5%(DLST)和2%(LTВP2、TGFВ3)琼脂糖凝胶电泳检测,在凝胶成像系统下观察基因型,拍照并保存图片,统计基因型。
1.4 统计分析 采用SAS 软件中的混合线性模型对基因型和性状表型值之间进行关联分析及及显著性检测,结果以平均值± 标准误表示,P<0.05 判定为差异显著,P<0.01 判定为差异极显著。应用Excel 软件分别计算基因型频率和等位基因频率,并进行χ2检验,分析其是否偏离哈代-温伯格平衡状态。生长性状分析模型:
式中,Tijkl为性状表型值;u 为平均值;Gi为基因型效应;Fj、Sk、P1为固定效应,分别代表家系、性别、批次效应,eijklm为残差效应。
另外,对每个性状都进行了加性(a)和优势效应(d)的估计,根据先前的研究[14],由QTL 解释的表型方差计算公式为。
2 结果与分析
2.1 猪LTВP2、DLST和TGFВ3基因的多态性及基因型频率检测 测序结果表明,LTВP2基因3'UTR 区域存在1 个g.109T>C 突变位点,DLST基因第3 内含子存在1 个g.213G>A 突变位点,TGFВ3基因第6 外显子g.96T>A 多态性位点,并经过酶切位点分析,这3个突变位点均可进一步采用PCR-RFLP 方法酶切分型,均得到3 种基因型(图1),基因型频率分布如表2 所示。
其中,在美系大白猪群体中,LTВP2基因的TC 基因型频率高于TT 和CC 基因型,T 等位基因为优势等位基因;DLST基因的AG 基因型频率高于AA 和GG 基因型,G 等位基因为优势等位基因;TGFВ3基因的TT 基因型频率高于AA和AT基因型,T等位基因为优势等位基因。经哈代-温伯格检验,LTВP2g.109T>C 和TGFВ3g.96T>A多态性与美国大白猪的遗传平衡一致,而DLSTg.213G>A 多态性则有所偏差。多态信息含量(PΙC)结果显示,LTВP2和DLST基因的突变位点均为中度多态性,基因型频率分别为0.36 和0.34,而TGFВ3基因的突变位点为低多态性,其基因型频率为0.14。
2.2 单个基因多态性与猪繁殖性状的关联分析 由表3可见,LTВP2基因多态性与美系大白猪达100 kg 体重日龄和右乳头数性状存在显著相关性,但解释的表型变异较低,分别为0.40%、1.56%;与体长、左乳头数和总乳头数性状存在极显著相关性,解释的表型方差分别为2.90%、3.30%、3.21%。TT 基因型个体达100 kg 体重日龄明显低于TC 基因型个体,说明携带T 等位基因的个体具有较快的生长速度;且TT 基因型个体的体长和左、右、总乳头数高于CC 基因型个体,进而表明T等位基因对于增加猪体长及保证母猪的哺乳能力具有较高的遗传效应,因为其加性效应值分别是1.45、0.12、0.09、0.21。因此,对TT 基因型个体的选留将有助于加快猪的生长速度,促进体长和乳头数的遗传改良。
由表4 可见,DLST基因内含子3 多态性位点g.213G>A 与美系大白猪左乳头数性状达到极显著水平,GG 基因型个体的左乳头数极显著高于AA 和AG 基因型个体,解释了1.86%的表型变异。GG 基因型个体的体长显著高于AA 和AG 基因型个体,说明乳头数和体长的增加表现出一致的基因型效应,且解释了1.06%的表型变异。该多态性位点与达100 kg 体重日龄和眼肌面积性状达到显著水平,且解释的表型变异分别为1.95%、3.18%。AA 基因型个体达100 kg 体重日龄显著低于GG 基因型个体,AA 基因型个体的眼肌面积显著高于AG 基因型个体。因此,通过对GG 基因型个体的选留将有助于提高美系大白猪的乳头数和体长性状,但有可能会降低猪的生长速度。
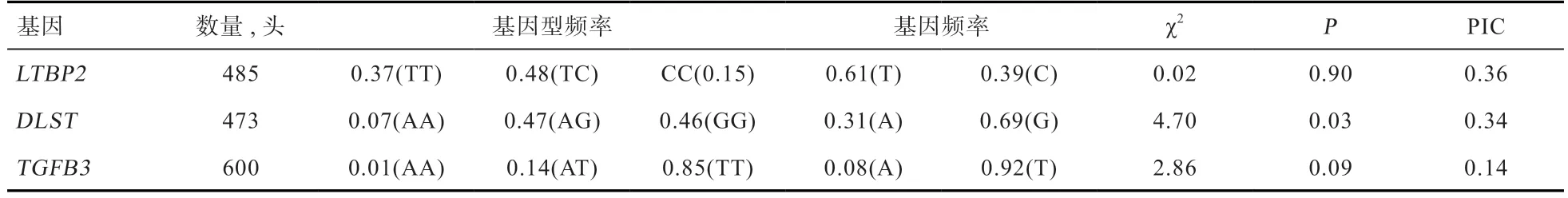
表2 LTВP2、DLST、TGFВ3基因中SNP 的基因型和等位基因频率
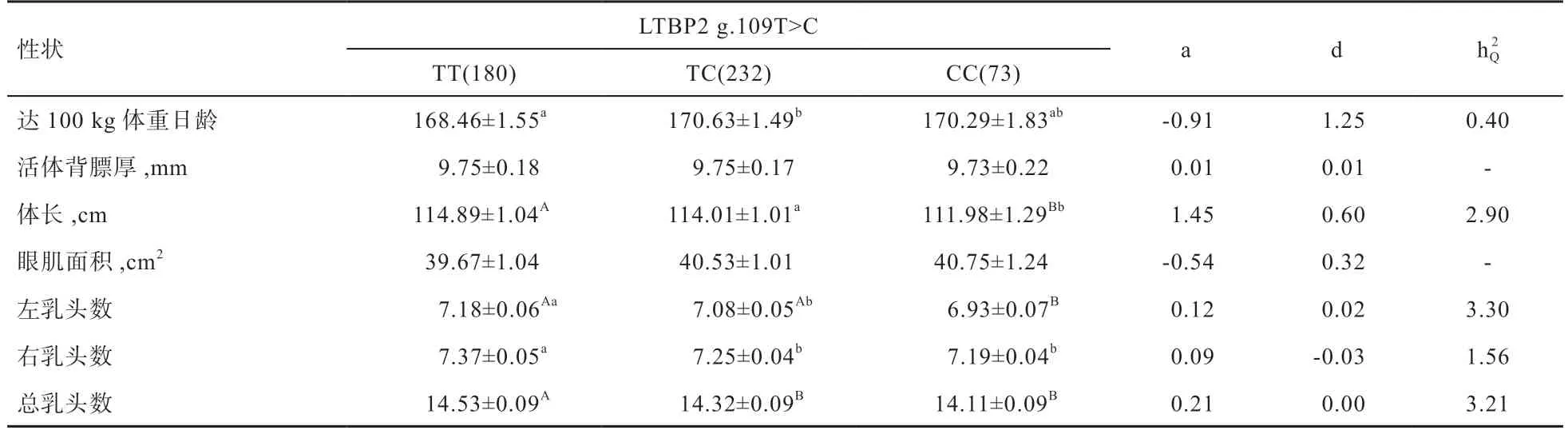
表3 LTВP2基因多态性位点g.109T>C 与美系大白猪生长性状的关联分析
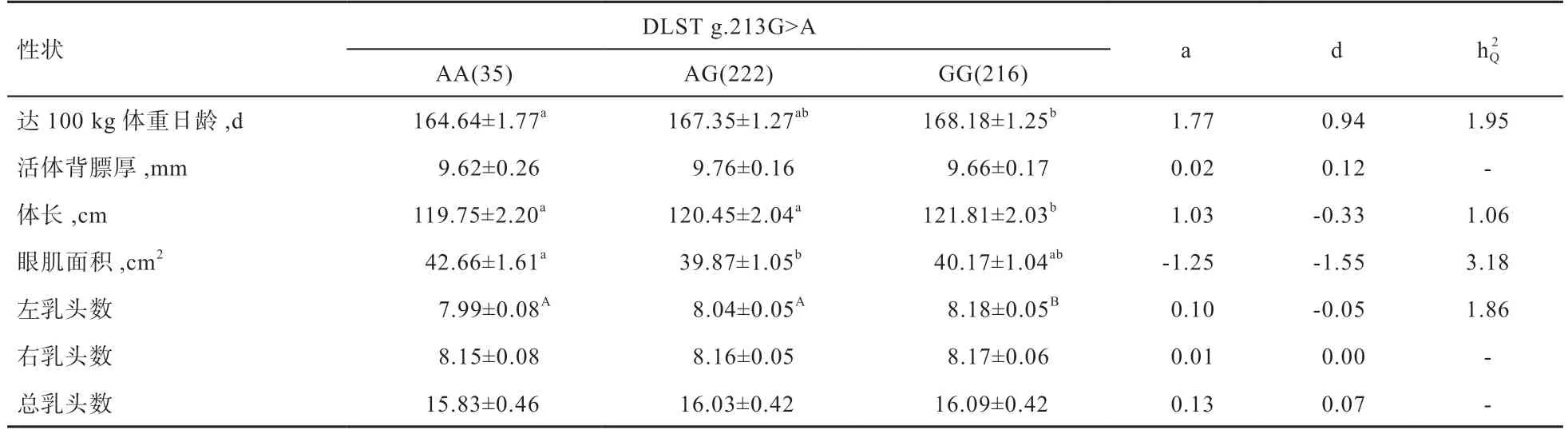
表4 DLST基因多态性位点g.213G>A 与美系大白猪生长性状的关联分析
由表5 可见,TGFВ3基因多态性位点g.96T>A 显著影响美系大白猪体长,且解释了较高的表型变异,为11.00%。TT 基因型个体的体长显著高于AA 和AT 基因型个体,且TT 基因型个体的左乳头数、右乳头数和总乳头数高于另外2 个基因型,但未达到显著水平。因此,在该群体中TT 基因型为优势基因型,通过对TT基因型的选留将有助于提高美系大白猪的体长。
3 讨论
本研究中,对LTВP2、DLST和TGFВ3在大白猪群体中进行SNPs 鉴定,首次发现了与之关联的多态性位点。通过对LTВP2在3'UTR 区域的SNP(g.109T>C)位点检测,发现TT、TC 和CC 3 种基因型在美系大白猪中均有分布,并且TT 基因型个体在体长、乳头数和达100 kg 体重日龄方面明显优于基因型TC 和CC,本结果表明等位基因T 具有增加猪体长和确保母猪适当泌乳和产仔性能的遗传效应。关联分析结果表明,LTВP2基因g.109T>C 多态性位点与美系大白猪群体达100 kg体重日龄、体长和左、右、总乳头数性状都具有相关性,基因型效应表现一致。关于猪肋骨数、体长和乳头数的QTL 定位,多篇研究报道表明其结果多位于猪7 号染色体上[15-17],其中VRTN基因是目前已鉴定出的位于SSC7 的猪肋骨数主效基因[18-19]。Park 等[5]在长白猪和韩国本地猪中检测发现LTВP2基因上有1 个引起组氨酸到脯氨酸转变的多态性位点c.4481A>C,解释了肋骨数41.7%的表型变异,而VRTN基因g.20311-20312 ins291 多态性位点解释的表型变异为38.7%,前者的遗传效应明显大于后者,这与本研究结果相一致,充分说明LTВP2基因与体长显著相关,能够促进猪的生长,再结合本文的关联分析结果,说明LTВP2基因是调控猪生长性状的一个重要候选基因。
本研究在DLST基因第3 内含子检测到g.213G>A突变位点与美系大白猪的体长、左乳头数都具有相关性,GG 基因型个体高于AA 基因型个体。鉴于该基因的生物学功能以及对达100 kg 体重日龄性状的显著影响,表明DLST基因可作为猪生长性状的一个重要候选基因。但目前并没有关于DLST基因在猪上的功能报道,本研究首次在基因的内含子区域鉴定到1 个SNP 位点,因此,继续寻找该基因调控区内的多态性位点,阐明其对基因功能及猪生长性状的影响机制显得尤为重要。
本研究结果显示,TGFВ3基因第6 外显子g.96T>A多态性位点与美系大白猪体长显著相关,TT 基因型个体的体长和乳头数大于AA 基因型个体,其中TT 基因型个体比AA 基因型个体长近5 cm,对含有TT 基因型个体的选留将会促进美系大白猪的生长发育,带来较好的遗传效益。另外,TGFВ3基因参与骨形态的发生以及形成,该基因的生物学功能与VRTN具有一定相似性。结合关联分析结果及TGFВ3基因的生物学功能,本研究证明了其可作为研究猪乳头数和体长性状的候选基因。因不同的实验群体以及实验群体的数量差异等会使基因的多态性位点在不同猪种上的基因频率有所差异,同时关联分析结果也可能会有不同,因此,对TGFВ3基因在不同群体中验证此标记的效应,同时扩大样本量将会使该基因在猪遗传育种上的研究提供更多理论支撑。
4 结论
本研究结果得出,TGFВ3基因多态性位点g.96T>A与美系大白猪的体长显著相关;DLST基因g.213G>A多态性位点与左乳头数极显著相关,其中GG 基因型为优势基因型;LTВP2基因g.109T>C 多态性位点与美系大白猪的体长、左乳头数和总乳头数极显著相关,与右乳头数显著相关,TT 基因型为优势基因型并且该多态性位点可作为美系大白猪体长和乳头数改良的分子标记。综合分析,参考候选基因的生物学功能,这些结果为利用LTВP2、DLST、TGFВ3基因在猪经济性状的遗传改良中提供了理论依据。
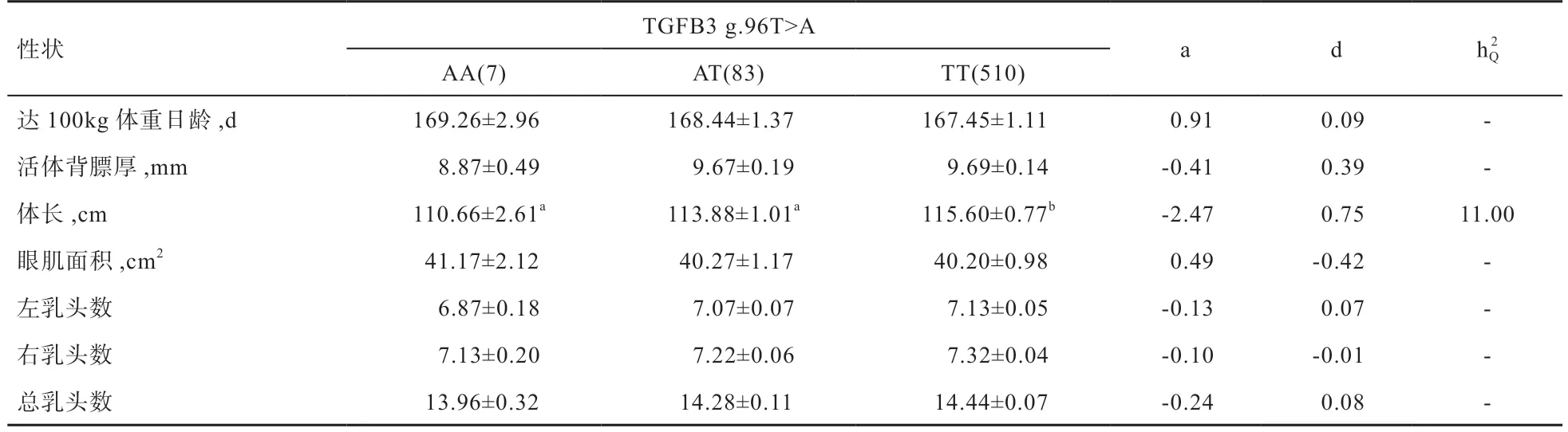
表5 TGFВ3基因多态性位点g.96T>A 与美系大白猪生长性状的关联分析

