免疫阻断失败Rh血型不合的新生儿溶血病1例*
黄蓉 何成涛 白夷 胡文静
资料与方法
1 病例资料 产妇,33岁,O型,Rh血型:ccdee。其丈夫为O型,Rh血型:CcDee(表1)。2015年初次妊娠,不规则抗体阴性,孕28周注射抗-D免疫球蛋白300 μg,足月剖宫产分娩一男婴,未出现黄染,产后72 h内又注射抗-D免疫球蛋白300 μg(自行注射)。无流产史,2018年第二次妊娠14周,血清中测出抗-C、抗-D和抗-G抗体,36周抗-C效价1∶2,抗-D效价1∶8,临床未进行干预治疗。鉴于其为稀有血型,孕38周时进行储存式自身备血。孕39周行剖宫产术,娩出一活男婴,3 570 g,因“新生儿Rh血型不合溶血病”收住入院。
2 试剂与方法
ABO血型反定型试剂(上海血液生物技术有限公司,批号:20180818)、Rh血型分型卡(长春博迅生物技术有限公司,批号:20180602/20190611)、抗人球蛋白卡(奥森多公司,批号:AHC671A);筛选细胞与谱细胞试剂(荷兰Sanquin,批号:8000250431)。对孕妇、其丈夫、新生儿进行ABO血型、Rh分型检测;孕妇孕14周、28周、32周、36周检测不规则抗体和效价;新生儿检测:直接抗人球蛋白试验、游离与释放试验[1]、血清总胆红素、直接胆红素和间接胆红素。
结 果
孕妇ABO血型为O型,Rh分型为ccdee(表1);孕妇血清与抗筛细胞反应,抗人球蛋白卡结果为阳性(表2),用谱细胞进行抗体鉴定实验,血清与谱细胞反应结果初步显示为抗-C和抗-D(表3),再通过双重吸附实验(double elution)[2]得出该抗体是抗-C、抗-D和抗-G的混合体(图1)。选择纯合子谱细胞用卡式法做抗体效价检测,孕14周抗-C 1∶2,抗-D 1∶2; 28周抗-C 1∶2,抗-D 1∶2;32周抗-C 1∶2,抗-D 1∶4,36周抗-C 1∶2,抗-D 1∶8,由于抗-G为抗-C,D,无法做抗-G效价。抗-C稳定在1∶2,抗-D由1∶2增加到1∶8。其丈夫ABO血型为O型,Rh分型为CcDee;患儿ABO血型为O型,Rh分型CcDee(表1),溶血三项实验:直接抗人球蛋白实验(IgG和C3d片段的混合):阳性;游离抗体实验:阳性;抗体放散实验:阳性,游离和放散液抗体均检测出IgG型抗-C和抗-D,经双重吸附实验,证实为抗-C、抗-D和抗G的混合体,其效价为抗-C是1∶2,抗-D是1∶8。患儿生后12 h血清总胆红素:51.90 μmol/L,直接胆红素:8.88 μmol/L,间接胆红素:43.02 μmol/L。确诊为:新生儿Rh血型不合溶血病。

表1 孕妇、丈夫及其患儿血型血清学反应结果

表2 孕妇血清与抗筛细胞反应结果
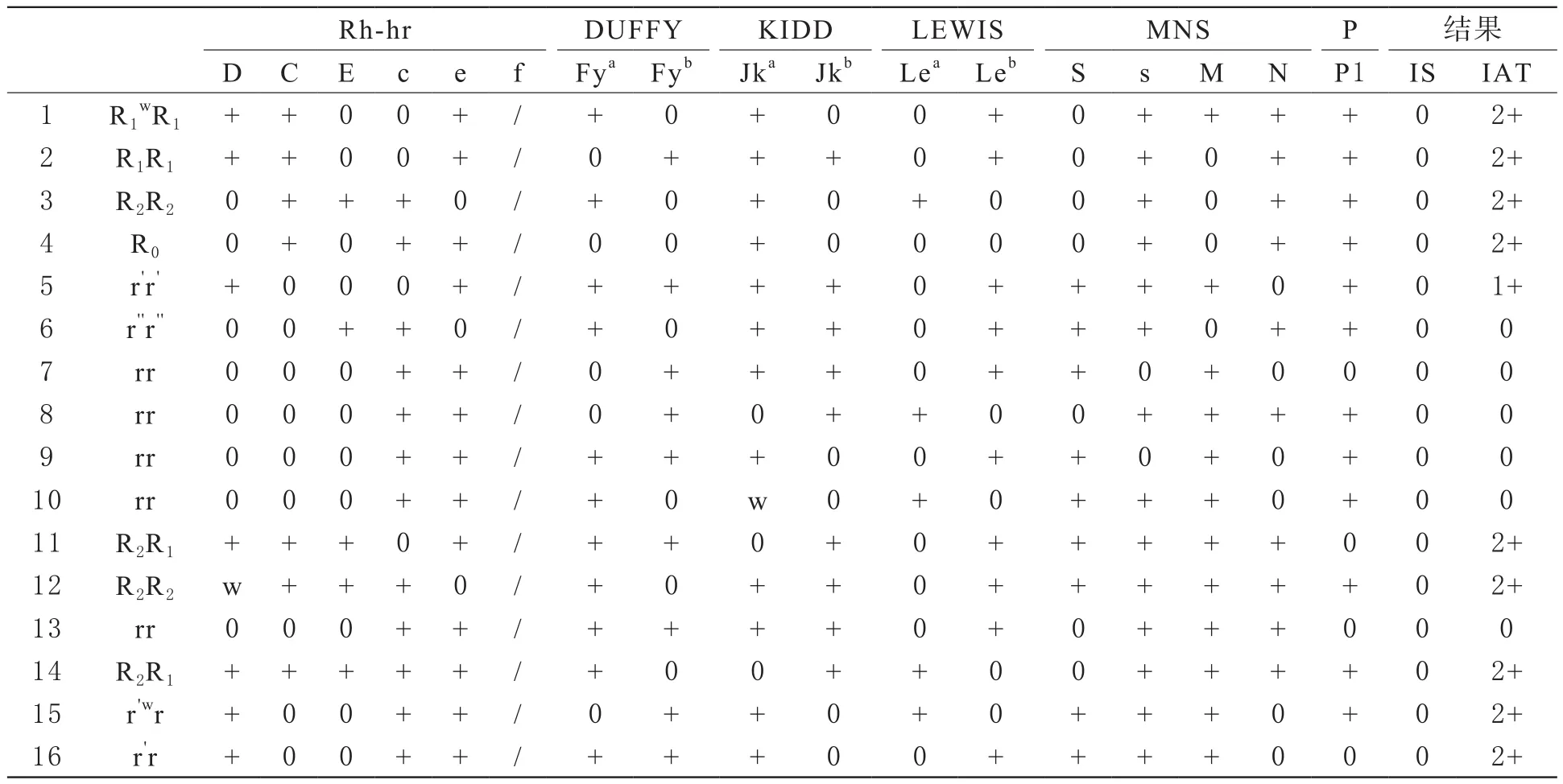
表3 孕妇血清与谱细胞反应结果
讨 论
Rh血型系统是继ABO血型系统之后的重要血型系统,也是人类血型系统中较为复杂的一种。Rh血型抗原共有5种,即C,c,D,E和e,其中以D抗原的抗原性最强。孕妇的Rh系同种免疫反应往往发生于第二胎及以后,再次妊娠时,进入母体的胎儿红细胞上的Rh抗原会刺激母体免疫系统的回忆反应而产生相应的抗体,这些抗体通过胎盘进入胎儿血液循环,与胎儿红细胞结合产生免疫反应,使红细胞凝集破坏而发生胎儿新生儿溶血病(HDFN)。
该病例中,孕妇血型为RhD阴性,初次妊娠不规则抗体阴性,孕28周注射抗-D免疫球蛋白300 μg,分娩后新生儿脐血检验为RhD阳性,又于产后72 h内再次注射抗-D免疫球蛋白300 μg,注射的时机与剂量符合国外的抗-D免疫球蛋白预防使用指南,但在第二胎仍产生了抗-D抗体,免疫抑制失败。李彤彤[3]等曾报道过注射抗-D免疫球蛋白仍然发生新生儿溶血病2例,文中认为是过量注射抗-D免疫球蛋白所致; Maayan-Metzger A等[4]在未检测胎母出血的基础上注射抗-D免疫球蛋白,可能因胎儿红细胞进入母体的量超过抗-D免疫球蛋白的结合能力而阻断失败;刘巧英等[5]提到,国内的抗-D免疫球蛋白基本都靠香港代购,代购过程中的质量问题不能保证。抗-D免疫球蛋白为血液制品,贮存条件为2~8℃冷藏,冷链运输,若贮存运输过程不符合要求,接种效果难以保证。一般在接种7日内,检测抗-D抗体,显示弱阳性,提示接种成功。国外很多国家制订了抗-D免疫球蛋白预防使用指南[6~8],大多数推荐在孕28周及产后72 h内的孕妇注射抗-D免疫球蛋白进行免疫预防,用药指征必须是RhD阴性孕妇,注射前抗-D抗体检测阴性。而目前我国对孕产妇使用抗-D免疫球蛋白的管理有待完善。
该病例中孕妇Rh分型为ccdee,其血清中抗-C、抗-D和抗-G三种不规则抗体同时存在。随着二胎政策的开放,两种或多种不规则抗体的联合存在现象也越来越常见,尤其对于CDE抗原均阴性的孕妇,极易刺激机体产生针对C,D,E抗原的抗体。孙迪等[9]报道了多次妊娠产生IgG型抗-C抗-D混合抗体1例;舒群峰等[10]报道了1例D阴性献血者曾因输D阳性血后多次妊娠产生抗-D抗-C抗-G和抗-E抗体;何子毅[11]等提到30%含抗-D血清中存在抗-C或抗-G,而有抗-C、抗-D的大多数血清是抗-D+G或抗-D+G+C。当新生儿Rh溶血贫血需输血或胆红素升高需换血时,应注意含G抗原红细胞与抗-G抗体的反应,需选用Rh血型为ccdee型的红细胞进行输注。这些Rh血型抗体的存在一方面提示我们输血的时候应选择无相应抗原的红细胞输注,另一方面可以评价和预估胎儿新生儿溶血病(HDFN)的发生发展。
由于Rh血型抗原表位是多肽,在胎儿出生时已发育成熟,与相应的IgG抗体结合亲和力较强,因此,其血型抗体引起的新生儿黄疸发生时间较早,发展凶猛,如不及时治疗会导致核黄疸[12]。对于Rh血型不合溶血病,临床治疗方案可取决于母体抗体效价检测结果[13]。产前血浆置换、药物治疗(包括静脉滴注丙种球蛋白、维生素C,口服维生素E等)及宫内输血可提高胎儿免疫力,以防胎儿红细胞遭受破坏;产后光疗、换血以及大量免疫球蛋白静滴可大大降低胆红素浓度,避免核黄疸的发生。有文献报道[13],母体抗体滴度>1∶64,则提示胎儿受累较为严重;>1∶16则提示胎儿受累比较轻微。该病例中,孕妇抗-C稳定在1∶2,抗-D由妊娠14周的1∶2增加到36周的1∶8,抗体滴度上升缓慢,也均未超过1∶16,因此,临床未给予相关治疗。其患儿刚出生时面红、呼吸平稳,偶有呻吟,心电监护血氧饱和度稳定;溶血三项实验阳性,临床给予静脉滴注丙种球蛋白封闭抗体;生后12 h检测血清总胆红素:51.90 μmol/L,直接胆红素:8.88 μmol/L,间接胆红素:43.02 μmol/L,未达换血指征,给予光疗;生后24 h,面红黄,继续光疗退黄;生后第7 d,皮肤轻度黄染,各项生命体征稳定,予以出院。总之,Rh血型抗体易引起新生儿溶血病,即使注射抗-D免疫球蛋白也不能完全阻止Rh血型不合新生儿溶血病的发生。因此,对于RhD阴性(尤其CDE均阴性)的孕妇应有计划地备孕,一旦怀孕应进行抗体鉴定和抗体效价的监测,必要时进行抗-D免疫球蛋白的接种[14,15]。笔者建议国内应不断完善母婴Rh血型不合HDFN的预防措施,积极有效地开展产前诊断工作,最大程度保障母儿安全。
利益冲突所有作者均声明不存在利益冲突

