不同喷雾干燥入口温度下鸡蛋清差异蛋白质组学分析
刘丽莉 史胜娟 陈 珂 张孟军 郝威铭 李媛媛
(1. 河南科技大学食品与生物工程学院,河南 洛阳 471023;2. 食品加工与安全国家级教学示范中心,河南 洛阳 471023)
鸡蛋清蛋白质的氨基酸组成与人体的十分接近,是理想的蛋白质来源[1]。鸡蛋清中富含铁、钙、锌、钾和磷等,是对人体健康起关键作用的矿物质。另外,因为鸡蛋清蛋白占干物质的80%以上[2],具有优异的发泡和凝胶性能等多种功能特性[3],常被作为制作烘焙产品、蛋白和肉制品的原材料应用于食品加工中。
喷雾干燥是指通过将样品喷入一种热的干燥介质中,热空气与液滴迅速接触,水分瞬间蒸发,从而可以快速得到脱水产品。由于粉末材料的固有特性,如减少包装、贮藏和运输费用,将喷雾干燥作为一种重要的技术纳入蛋清蛋白的生产过程是非常重要的。此外,其干燥接触时间相对较短(5~100 s)[4]。非标记定量(iTRAQ)技术具有重复性高,定量较好等优势。Raikos等[5]将2-DE结合质谱鉴定的蛋白质组学方法应用于鸡蛋蛋白的分离和鉴定中,成功鉴定出簇蛋白(clusterin)、卵转铁蛋白(ovotransferrin)、卵白蛋白(ovalbumin)、thetical protein FIJ 10305和activin receptor type IIA 5种蛋白。Guérin-Dubiard等[6]采用2-DE和质谱连用技术,鉴定出16种蛋白,其中Tenp和VMO-1两种蛋白首次被发现,其他的蛋白分别是卵糖蛋白(ovoglycoprotein,又称alpha 1-acid glycoprotein)、卵白蛋白、卵白蛋白X(ovalbumin-related protein X,OVAX)、卵转铁蛋白、TENP(transiently expressed in neural precursors)及溶菌酶C。Omana等[7]运用组学的方法研究了鸡蛋在贮藏过程中蛋清蛋白质组的差异。
蛋白质组学是高通量研究蛋白质组最常用的方法,被广泛应用于多个学科。目前,关于蛋清粉在不同喷雾干燥入口温度下差异蛋白质组学的研究尚未见报道。试验拟以干燥入口温度140,160,180 ℃的蛋清粉为研究对象,采用iTRAQ技术构建蛋清蛋白在干燥过程中的表达图谱,分析三者间的差异蛋白质组学变化[8],旨在更好地了解并筛选出鸡蛋清不同干燥温度过程中影响较大的功能蛋白,为解释喷雾干燥加工鸡蛋清的加工方式和生物功能性质等提供依据。
1 材料与方法
1.1 材料与仪器
新鲜鸡蛋:河南洛阳大商新玛特超市;
蛋清粉:自制,将蛋白、蛋黄分开,自然发酵(脱去葡萄糖,使蛋清具有更好的起泡和凝胶性),60 ℃巴氏杀菌处理4 min,再进行喷雾干燥处理,并于4 ℃保存备用;
Modified Trypsin蛋白酶:质谱级,美国PROMEGA公司;
NUPAGE 10% BT GEL 1.0MM 12W、Protease Inhibitor Cocktail、Bond-BreakerTMTCEP Solution (TCEP)、PierceTMBCA Protein Assay Kit:美国Thermo Fisher Scientific公司;
iTRAQ 8PLEX、AB SCIEX、IAM碘乙酰胺、氨水:美国Sigma公司;
恒温混匀仪:TMR型,合肥艾本森科学仪器有限公司;
酶标仪:Varioskan LUX型,赛默飞世尔科技公司;
Q-液相色谱—质谱联用仪:Q-Exactive HF-X型,赛默飞世尔科技公司;
色谱柱:IMAC型,伯乐生命医学产品(上海)有限公司;
电泳仪:1645052型,伯乐生命医学产品(上海)有限公司。
1.2 凝胶电泳的测定
根据Katekhong等[9]的方法。将样品与缓冲液混合,煮沸4 min,2 700 r/min离心10 min,将含有20 μg蛋白质的每个样品溶液10 μL装入单独的孔中,于恒定电压(150 V)下电泳45 min,最后将其降解2.5 h。
1.3 iTRAQ技术测定
1.3.1 样品处理 将制备好的蛋清粉样品(每个样品4 μL,共12 μL蛋清)进行混合并稀释至12 μL PBS中,用112 μL 98%乙醇沉淀,用胰蛋白酶(即1/50,胰蛋白酶/蛋白质)切割,37 ℃下过夜。
1.3.2 质谱分析 用纳米反相柱洗脱肽阳离子。通过电喷雾电离将洗脱的肽阳离子转化为气相离子,并在热轨道聚变质谱仪上进行分析[10]。在120 k分辨率(m/z200)下,用5×105离子计数靶对m/z400~1 600的肽前体进行测量扫描。串联MS/MS在第1.5天与四极杆分离。动态排斥持续时间设置为45 s。开启单同位素前体选择,仪器以最高速度运行,循环时间为2 s。
1.3.3 蛋白质组数据分析 所有数据均采用Max Quant Software Reversion 1.5.3.8进行收集和量化。对于蛋白质分类,使用在线PANTHER库。为了在蛋清蛋白中发现过度表达的基因本体论(GOs),启动PANTHER过度表达试验,用Bonferroni校正对G.gallus(数据库中的所有基因)参考列表和注释数据集进行多次试验,完成GO分子功能和GO生物过程。
1.3.4 统计分析 分析前,使用自然对数转换[ylg(x+1)]转换蛋白质组数据[11]。首先,对蛋白质组数据集进行组间成分分析(BGA)。BGA通过对组均值进行主成分分析来关注组间变异性。组间差异的重要性由组间惯性与总惯性之比进行评估。使用蒙特卡罗排列试验检查组间差异的统计显著性。用Monte Carlo排列试验评价统计学意义。CIA可以应用于变量数远远超过样本数的数据集。
2 结果与分析
2.1 喷雾干燥入口温度对蛋清蛋白SDS-PAGE的影响
由图1可知,经不同喷雾干燥温度制得的蛋清粉的蛋白条带分布大体相似,且蛋白质组分变化较小。25~30 kD范围内,25 kDa处对应的是卵类黏蛋白,但条带A、B、C均没有卵类黏蛋白条带,可能是由于蛋清液在喷雾干燥前加水稀释处理或在喷雾干燥过程中,卵黏蛋白等聚集物被除去,所以在电泳图上并没有卵类黏蛋白的特征条带。条带A、B、C中并没有新的分子量蛋白质生成,说明蛋白质的一级结构没有因为干燥温度的变化而发生改变。采用SDS-PAGE对蛋清蛋白进行质检,发现蛋清蛋白条带清晰、无杂质,符合后续试验要求。
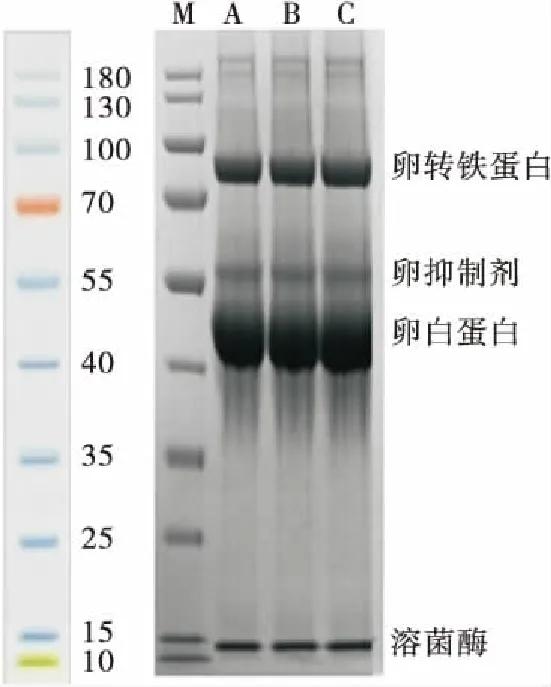
M. Marker A. 140 ℃ B. 160 ℃ C. 180 ℃图1 3种蛋清粉的SDS-PAGE图Figure 1 SDS-PAGE of three kinds of egg white powder
2.2 差异表达蛋白质的鉴定及统计分析
由表1可知,试验中共有62种蛋白质被定量,且每一对之间差异表达的蛋白质组显示重叠(图2),如25个蛋白质在160 ℃ vs 140 ℃和180 ℃ vs 140 ℃之间重叠[12]。以160 ℃与140 ℃的倍数变化阈值分别为>1.20或<0.83,其中8个蛋白质被指定为显著上调[13],而33个蛋白质在160 ℃后显著下调。同样的标准(折叠变化阈值>1.20或<0.83)用于选择180 ℃与140 ℃组显著变化(P<0.05)的差异蛋白质[14],有18个差异蛋白被认为显著上调,而28个差异蛋白在180 ℃后显著下调。
2.3 差异表达蛋白质聚类分析
通过对140,160,180 ℃组的62个差异蛋白进行层次聚类分析,以揭示蛋白质变化的模式[15],结果如图3所示。由图3可知,3组差异蛋白共得到10个对应于不同蛋白质变化模式的簇[16]。簇B、E和簇H由干燥温度140~180 ℃前后差异显著的蛋白质组成。具体来说,180 ℃ 干燥后,簇B、E显示出10种蛋白质的表达量明显下降,而簇H显示出13种蛋白质在增加。簇F和簇G、C中,与140 ℃组相比,簇F共有5种蛋白质在160 ℃组中的表达量过高,但当干燥温度上升至180 ℃时,这些蛋白质表达量显著降低,与140 ℃组的相当,表明这些蛋白的高丰度可被视为低干燥出粉率的信号[17]。簇G、C共有9个与簇F相反的蛋白质组成,预测这些蛋白质在蛋清干燥过程中具有积极作用[18]。簇I和簇A、D在140 ℃组和180 ℃组之间表现出较大差异,但干燥温度在160 ℃组和180 ℃组之间的蛋白质丰度差异不大。蛋白的差异模式有助于筛选与干燥和胚胎发育相关联的蛋白[19]。

表1 差异蛋白质分析结果统计
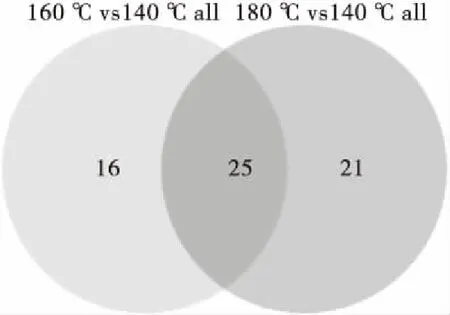
图2 160 ℃ vs 140 ℃和180 ℃ vs 140 ℃蛋清蛋白粉韦恩图Figure 2 Venn diagrams of egg white protein powder at 160 ℃ vs 140 ℃ and 180 ℃ vs 140 ℃

图3 差异表达蛋白质聚类分析Figure 3 Results of cluster analysis of differentially expressed proteins
2.4 差异表达蛋清蛋白粉的GO功能注释分析
综上可知,160 ℃ vs 140 ℃和180 ℃ vs 140 ℃两组蛋清蛋白共鉴定62个差异蛋白,采用生物信息学软件对已鉴定到的62个差异表达蛋清蛋白进行分析[20]。使用PANTHER分析在蛋清中检测到蛋白质进行分类,并确定样本中存在过多的蛋白质类别[21]。在20个生物过程和2个分子功能(图4和表2)中发现显著的过表达,且大部分的差异丰富的蛋白质与生物过程有关,例如细胞过程的GO-term反应(GO:0009987)、生物调节的GO-term反应(GO:0065007)和结合作用的GO-term反应(GO:0005488)等的富集度最高,表明参与细胞调节和免疫及催化反应调节的蛋白质数较多[22]。大多数差异丰度蛋白与亲本GO-terms对细胞外区(GO:0005576)、细胞部分(GO:0044464)和细胞(GO:0005623)等有关,其参与的蛋白质数较多显著过度表达,说明了蛋清对细胞的保护作用[23]。此外,在160 ℃ vs 140 ℃和180 ℃ vs 140 ℃两组对比中,180 ℃ vs 140 ℃组中的蛋清差异蛋白数较多,可能是因为温度差异越大,对蛋白质组的差异影响越大。查阅相关文献[24]可知,其差异表达蛋白的某些注释功能与蛋清液是相似的。

A. 细胞过程 B. 生物调节 C. 单体过程 D. 生物过程调控 E. 应激反应 F. 代谢过程 G. 多细胞有机体过程 H. 发展过程 I. 生物过程负调节 J. 细胞成分组织或生物发生 K. 胞外区 L. 细胞 M. 细胞器 N. 细胞部分 O. 细胞外区 P. 膜 Q. 薄膜部分 R. 细胞器部分 S. 结合 T. 分子功能调节

表2 差异蛋白的GO术语和途径
2.5 差异表达蛋清蛋白粉的KEGG代谢通路分析
由图5可知,140 ℃ vs 160 ℃后差异蛋白显著变化与嘌呤代谢(gga00230)、剪接体(gga03040)和mRNA监测途径(gga03015)3条KEGG途径有关[25]。140 ℃ vs 180 ℃后差异蛋白显著变化与mRNA监测途径(gga03015)、烟酸和烟酰胺代谢(gga00760)和脂肪细胞因子信号途径(gga04920)3条KEGG途径有关。6个显著变化的蛋白被归类为代谢途径,而显著变化的差异蛋白则在溶酶体途径(gga04142)中富集。大部分差别丰富的蛋白质与KEGG途径(gga04080和gga04142)等有关[26],其参与的蛋白质间接表达了参与途径,为进一步分析蛋清粉品质提供了较好的支撑[27]。

图5 160 ℃ vs 140 ℃和180 ℃ vs 140 ℃蛋清粉的差异蛋白的KEGG通路图
2.6 蛋白质相互作用网络分析(PPI)
筛选标准为蛋白质互作得分>0.9,共有18种差异表达蛋白(表3)的68种相互作用(图6)。大部分蛋白质被消除,因为相互之间没有任何联系[28],其中NP_989936.1、NP_001161204.1、NP_001026172.1、NP_990483.1、XP_025006934.1、NP_001077389.1和XP_015148067.1的连接度较高,具有7~11个互作蛋白,主要连接的通路有GO:0009987、GO:0065007、GO:0005488、GO:0005576、GO:0044464、GO:0005623、gga04080、gga03040、gga03015等[29]。
2.7 指示蛋白的筛选
查阅相关文献[30],再结合分析代谢通路比较组160 ℃ vs 140 ℃、180 ℃ vs 140 ℃两组间共有的62个差异表达蛋白,从差异蛋白筛选出与蛋清蛋白密切相关的指示蛋白。由图7可知,有4种蛋白质在喷雾干燥过程中丰度变化显著,分别是卵白蛋白相关蛋白Y、卵白蛋白前体、卵类黏蛋白亚型X2及卵类黏蛋白亚型1前体。丰度变化显著的原因可能是入口干燥温度或样品处理时发生的物理变化造成的。陈珂等[31]研究表明,喷雾干燥工艺会对鸡蛋清蛋白的结构和功能特性造成一定的影响。

表3 网络互作显著变化的蛋白质

图6 蛋白互作网络图Figure 6 Protein interaction network
2.7.1 卵白蛋白相关蛋白-Y和卵白蛋白前体 卵白蛋白相关蛋白-Y和卵白蛋白前体均属于卵白蛋白中的一种,其各自的蛋白氨基酸序列高度同源且同属于一个家族,但其发挥的作用各不相同;而这些不同与各自特殊的生理生化功能有关[32]。鸡蛋清喷雾干燥过程中,卵白蛋白相关蛋白-Y和蛋白前体的丰度发生显著变化,很可能是随着干燥温度的升高,蛋清卵白蛋白发生加速降解或卵白蛋白和碱性蛋白在干燥过程中发生结合造成的,其具体原因有待验证。
2.7.2 卵类黏蛋白亚型X2和卵类黏蛋白亚型1前体
卵类黏蛋白亚型X2和卵类黏蛋白亚型1前体均属于卵类黏蛋白中的一种。卵类黏蛋白是鸡蛋清中的主要抗原蛋白之一,同时也是一种蛋白酶抑制剂和多功能的糖蛋白,其占蛋清蛋白的10%左右,并且有着高度同源的氨基酸序列[33],等电点为4.0~4.6,蛋白分子量约为(28.0±1.5) kD。利用iTRAQ技术对蛋清蛋白进行鉴定,在鸡蛋清蛋白中并没有鉴定出卵类黏蛋白,但鉴定出卵类黏蛋白亚型X2和卵类黏蛋白亚型1前体,可能是干燥过程中,卵类黏蛋白受温度的影响导致变性或者降解使这两种蛋白质形成了结合物或者发生其他变化,但仍需进一步验证。
3 结论
基于非标记定量(iTRAQ)技术和液相色谱—串联质谱(LC-MS/MS)技术,分析蛋清蛋白在不同喷雾干燥入口温度的差异表达蛋白质,并对其进行生物信息学分析。结果表明,160 ℃ vs 140 ℃和180 ℃ vs 140 ℃两组中共有62种差异蛋白质,其中共同拥有的差异蛋白25个。蛋白质层次聚类分析热图表明,得到的差异蛋白质信息合理。将上述差异蛋白进行生物信息学分析得出其主要涉及发育过程、结合、刺激反应、催化、生物调节等生物学过程和分子功能。由蛋白质相互作用网络分析可以得到全面系统的分子层面的细胞活动模型,以便于对分子机制的深入研究。
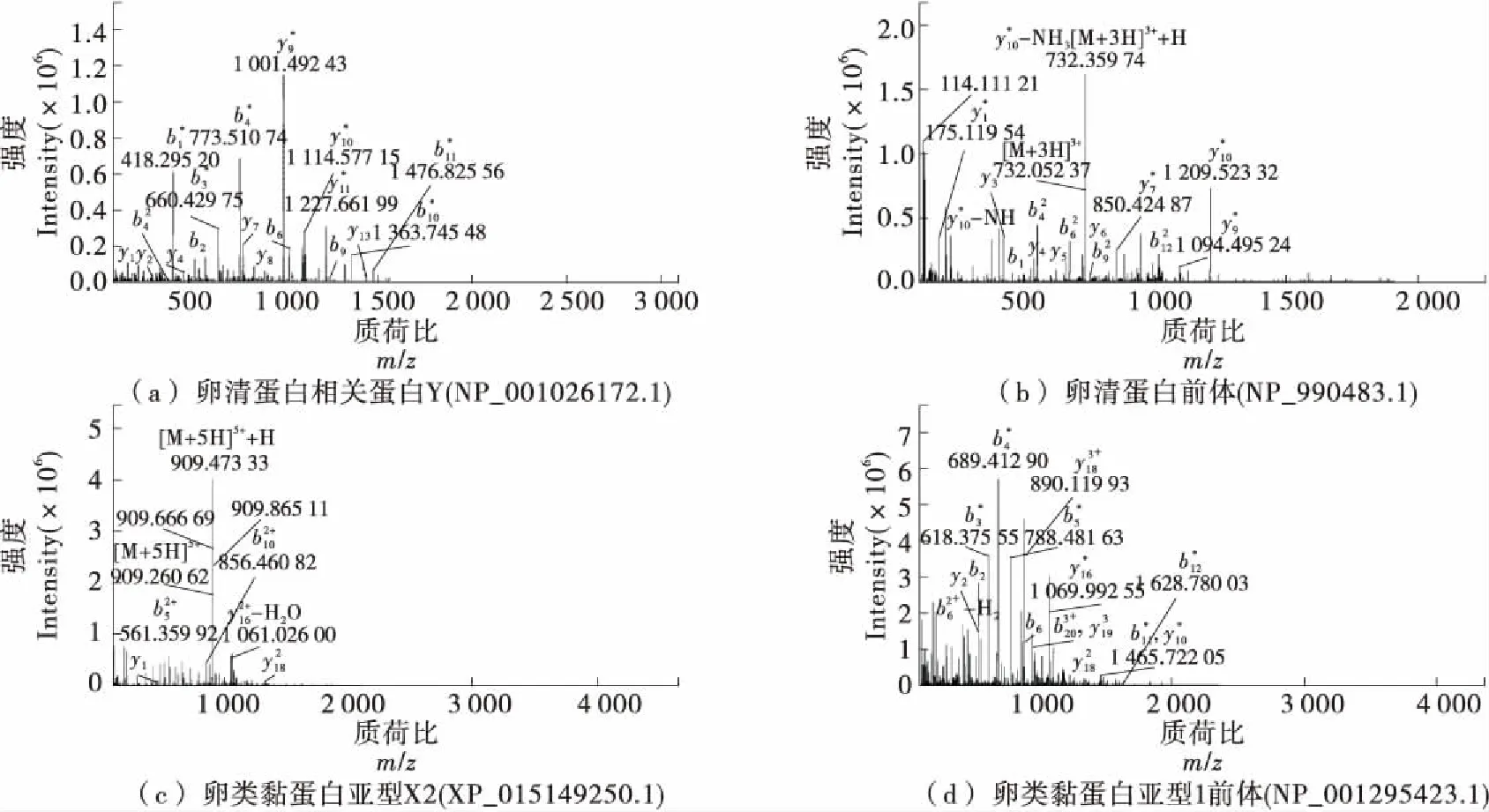
图7 二级质谱图Figure 7 Secondary mass spectrum
在不同入口干燥温度蛋清蛋白差异蛋白质组中发现有4个蛋白质变化较为明显,分别为卵白蛋白相关蛋白-Y、卵白蛋白前体、卵类黏蛋白亚型X2和卵类黏蛋白亚型1前体,在功能注释、信号通路和蛋白质互作中变化显著。因此,这4个差异蛋白质均有望作为蛋清蛋白干燥过程中的指示蛋白。

