lncRNA XIST靶向miR-410对谷氨酸诱导视网膜神经细胞损伤的调控机制研究
王丽纯 舒宝童 马宇 刘意
视网膜神经细胞损伤可引发视神经功能障碍。缺血性脑出血、糖尿病、缺氧等诱导的氧化应激反应可促使视网膜神经细胞损伤,最终导致视功能丧失[1]。因此,基于视网膜神经细胞损伤机制寻找相关分子标志物有助于防治视网膜神经细胞损伤。长链非编码RNA-X染色体失活特异转录物(long non-coding RNA X-inactive specific transcript,lncRNA XIST)属于内源性非编码RNA,可促进神经元凋亡[2]。XIST高表达可促进心肌细胞凋亡[3],XIST还可调控骨关节炎软骨细胞的增殖和凋亡[4]。但XIST在视网膜神经细胞损伤中的调控机制尚未阐明。靶基因预测软件starBase预测显示,微小RNA-410(microRNA-410,miR-410)可能是XIST的靶基因。研究表明,缺血性脑卒中患者中miR-410过表达对氧化应激诱导的细胞凋亡具有保护作用[5]。相关报道指出,核因子E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf-2)信号通路激活可发挥抗氧化应激作用从而减轻组织损伤[6]。但XIST是否通过调控miR-410及Nrf-2信号通路而影响视网膜神经细胞损伤尚未可知。谷氨酸(glutamic acid,Glu)属于视网膜兴奋性神经递质,可促使神经元细胞凋亡,还可促使视网膜缺血、缺氧及糖尿病视网膜病变等视网膜神经细胞损伤及凋亡[7]。因此,本研究采用Glu诱导体外培养的视网膜神经细胞建立细胞损伤模型,探讨沉默XIST对视网膜神经细胞凋亡的影响,分析其对miR-410的调控作用,初步探究其可能作用机制,为视网膜神经细胞的保护及相关疾病药物的研发提供理论依据。
1 材料与方法
1.1 材料SPF级健康SD小鼠10只, 3~5 d 龄,购自上海凯学生物科技有限公司,动物合格证号为SCXK(沪):2016-0008。DMEM培养基、胰蛋白酶、胎牛血清均购自美国Gibco公司;Lipofectamine2000购自美国Thermo Fisher公司;Glu购自美国Amresco公司;lncRNA XIST小干扰RNA(si-lncRNA XIST)、乱序无意义阴性序列(si-con)、miR-410模拟物(mimics)、阴性对照(miR-con)、miR-410特异性寡核苷酸抑制剂 (anti-miR-410)、阴性对照(anti-miR-con)均购自广州锐博生物科技有限公司;Trizol、反转录试剂盒、SYBR Green试剂盒均购自日本TaKaRa公司;膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡试剂盒购自美国Sigma公司;细胞核蛋白提取试剂盒与总蛋白提取试剂盒均购自美国Sigma-Aldrich公司;乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒购自美国罗氏公司;兔抗鼠活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved Caspase-3)、活化的含半胱氨酸的天冬氨酸蛋白水解酶9(Cleaved Caspase-9)抗体与辣根过氧化物酶(HRP)标记的山羊抗兔二抗均购自武汉艾美捷科技有限公司;兔抗鼠Nrf-2、NADH 脱氢酶 1(NQO1)、血红素氧合酶 1(HO-1)抗体均购自美国CST公司。
1.2 方法
1.2.1 原代培养视网膜神经细胞参照文献[8]原代培养视网膜神经细胞,具体步骤为:颈椎脱臼法处死小鼠,取眼球后去除角膜、晶状体及玻璃体,分离出视网膜神经上皮层,剪碎,用12.5 g·L-1胰蛋白酶与2 g·L-1透明质酸酶(11)消化,置于37 ℃、含体积分数5%CO2培养箱内消化20 min,使用加含有体积分数15%胎牛血清的培养基终止消化,4 ℃条件下800 r·min-1离心5 min,弃上清,加入含有体积分数10%胎牛血清的培养液,用200目无菌筛网过滤,收集细胞,调整细胞密度为100个·mL-1,按每孔150 μL接种于24孔板,于37 ℃、含体积分数5%CO2培养箱内培养24 h,加入阿糖胞苷(10 mg·L-1),每隔3 d更换一次培养液。
1.2.2 Glu处理及实验分组收集培养7 d的原代小鼠视网膜神经细胞,参照文献[9]选用20 μmol·L-1的Glu分别处理视网膜神经细胞0 h、6 h、12 h、24 h、48 h,采用流式细胞术检测各组细胞凋亡率,筛选Glu适宜作用时间用于后续研究。
取对数生长期视网膜神经细胞,加入20 μmol·L-1的Glu处理24 h,记作Glu组。同时将正常培养的细胞作为NC组。将si-con、si-lncRNA XIST、pcDNA和pcDNA-lncRNA XIST转染至视网膜神经细胞,分别记作si-con组、si-lncRNA XIST组、pcDNA组和pcDNA-lncRNA XIST组;将si-con、si-lncRNA XIST、miR-con、miR-410 mimics、si-lncRNA XIST与anti-miR-con、si-lncRNA XIST与anti-miR-410转染至视网膜神经细胞,随后使用20 μmol·L-1的Glu处理24 h,分别记作Glu+si-con组、Glu+si-lncRNA XIST组、Glu+miR-con组、Glu+miR-410组、Glu+si-lncRNA XIST+anti-miR-con组、Glu+si-lncRNA XIST+anti-miR-410组。所有实验均重复9次或每组设9个复孔。
1.2.3 检测LDH活性收集各组细胞,根据LDH活性检测试剂盒检测各组LDH活性,严格按照试剂盒说明书进行操作。
1.2.4 流式细胞术检测细胞凋亡收集各组细胞,加入2.5 g·L-1胰蛋白酶消化,调整细胞密度至 10×103个·mL-1,预冷PBS洗涤细胞,4 ℃条件下经1000 r·min-1离心5 min(离心半径6 cm),收集细胞沉淀至流式管内,加入500 μL Binding Buffer重悬细胞,分别加入5 μL Annexin V-FITC,混匀,加入5 μL PI,混匀,室温避光孵育20 min,置于FACS Calibur流式细胞仪及应用Cellauest软件检测各组细胞凋亡。
1.2.5 qRT-PCR检测XIST、miR-410表达参照Lipofectamine2000转染试剂说明书进行转染,转染48 h后收集各组视网膜神经细胞,采用Trizol法提取细胞总RNA,按照反转录说明书将总RNA反转录为cDNA。XIST正向引物:5’-CAGACGTGTGCTCTTC-3’,反向引物:5’-CGATCTGTAAGTCCACCA-3’;β-actin正向引物:5’-TGCTGTCCCTGTATGCCTCT-3’,反向引物:5’-TGATGTCACGCACGATTT-3’;miR-410正向引物:5’-TAACACTGTCTGGTAACGATGT-3’,反向引物:5’-CATCTTACCGGACAGTGCTGGA-3’;U6正向引物:5’-CTCGCTTCGGCAGCACA-3’,反向引物:5’-AACGCTTCACGAATTTGCGT-3’。引物均由上海生工生物工程股份有限公司设计合成。以cDNA为模板进行qRT-PCR反应,反应体系:SYBR Premix Ex Taq Ⅱ(2×)10 μL,cDNA 2 μL,上下游引物各0.8 μL,ROX Reference Dye(50×)0.4 μL,ddH2O 6.0 μL;反应条件:95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火60 s,72 ℃延伸30 s,共40个循环。XIST以β-actin为内参,miR-410以U6为内参,采用2-ΔΔCt法计算XIST、miR-410相对表达量。
1.2.6 双荧光素酶报告基因检测lncRNA XIST与miR-410的靶向调控关系靶基因预测软件starBase预测显示,lncRNA XIST的序列中含有与miR-410互补的核苷酸序列,将结合位点序列插入荧光素酶报告基因载体构建野生型报告基因载体WT-lncRNA XIST,利用基因突变技术将结合位点进行突变,同时将突变的结合位点插入荧光素酶报告基因载体构建突变型报告基因载体MUT-lncRNA XIST,取对数生长期视网膜神经细胞,分别将WT-lncRNA XIST、MUT-lncRNA XIST与miR-con、miR-410 mimics共转染至视网膜神经细胞,分别命名为miR-con组与miR-410组,继续培养48 h,检测各组细胞相对荧光素酶活性。
1.2.7 Western blot检测收集各组细胞,根据细胞核蛋白与总蛋白提取试剂盒分别提取细胞核蛋白与细胞总蛋白,采用BCA法测定蛋白浓度, SDS-PAGE分离蛋白,将分离的蛋白凝胶转移至PVDF膜,室温条件下采用50 g·L-1脱脂奶粉封闭2 h,分别加入Cleaved Caspase-3(1800)、Cleaved Caspase-9(1800)、Nrf-2(1500)、HO-1(1500)、NQO1(1500)一抗,4 ℃孵育过夜,TBST洗涤,加入二抗稀释液(13000),室温孵育1 h,TBST洗涤,滴加增强型化学发光试剂(enhanced chemiluminescence,ECL)显影,应用Image J软件分析各条带灰度值。
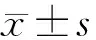
2 结果
2.1 Glu诱导时间对视网膜神经细胞损伤和凋亡的影响随着Glu诱导时间的延长,视网膜神经细胞凋亡率显著升高(P<0.01),细胞凋亡蛋白Cleaved Caspase-3、Cleaved Caspase-9的表达水平均显著升高(均为P<0.01),LDH活性显著升高(P<0.01),其中Glu诱导24 h、48 h时显著高于其他时间点(均为P<0.05),而Glu诱导24 h与48 h之间作用效果差异均无统计学意义(均为P>0.05),因而后续研究使用的Glu诱导时间为24 h(见图1、表1)。

图1 Western blot检测Glu诱导不同时间视网膜神经细胞中Cleaved Caspase-3和Cleaved Caspase-9蛋白表达
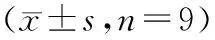
表1 Glu诱导时间对视网膜神经细胞LDH活性、细胞凋亡率及Cleaved Caspase-3和Cleaved Caspase-9蛋白表达的影响
2.2 Glu诱导时间对视网膜神经细胞lncRNA XIST和miR-410表达的影响随着Glu诱导时间的延长,视网膜神经细胞中lncRNA XIST的表达水平显著升高(P<0.01),miR-410的表达水平显著降低(P<0.01),其中Glu诱导24 h、48 h时显著差异于其他时间点(均为P<0.05),而Glu诱导24 h与48 h之间表达差异均无统计学意义(均为P>0.05)(见表2)。
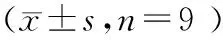
表2 Glu诱导时间对视网膜神经细胞lncRNA XIST和miR-410表达的影响
2.3 沉默lncRNA XIST抑制Glu诱导视网膜神经细胞损伤和凋亡与NC组比较,Glu组视网膜神经细胞凋亡率、LDH活性及Cleaved Caspase-3、Cleaved Caspase-9蛋白相对表达量均显著升高,差异均有统计学意义(均为P<0.05);与Glu+si-con组比较,Glu+si-lncRNA XIST组视网膜神经细胞凋亡率、LDH活性及Cleaved Caspase-3、Cleaved Caspase-9蛋白相对表达量均显著降低,差异均有统计学意义(均为P<0.05)(见图2和表3)。

图2 Western blot检测NC组、Glu组、Glu+si-con组、Glu+si-lncRNA XIST组细胞中Cleaved Caspase-3和Cleaved Caspase-9蛋白表达
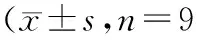
表3 沉默lncRNA XIST对Glu诱导视网膜神经细胞LDH活性、细胞凋亡率及Cleaved Caspase-3和Cleaved Caspase-9蛋白表达的影响 )
2.4 lncRNA XIST靶向调控miR-410的表达靶基因预测软件starBase预测显示,lncRNA XIST与miR-410存在互补序列(见图3)。双荧光素酶报告实验结果显示,转染野生型报告基因载体WT-lncRNA XIST的细胞中,miR-410组荧光素酶活性为0.54±0.06,显著低于miR-con组的1.00±0.09(P<0.05);转染突变型报告基因载体MUT-lncRNA XIST的细胞中,miR-410组(1.23±0.14)与miR-con组(1.19±0.11)荧光素酶活性相比差异无统计学意义(P>0.05)。qRT-PCR检测结果显示,与si-con组(1.03±0.11)相比,si-lncRNA XIST组(4.28±0.49)视网膜神经细胞中miR-410的表达水平显著升高(P<0.05);与pcDNA组(0.98±0.12)相比,pcDNA-lncRNA XIST组(0.54±0.08)视网膜神经细胞中miR-410的表达水平显著降低(P<0.05)。
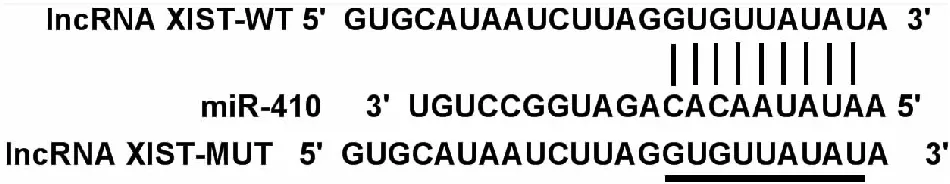
图3 lncRNA XIST与miR-410存在互补序列
2.5 过表达miR-410抑制Glu诱导视网膜神经细胞损伤和凋亡与Glu+miR-con组比较,Glu+miR-410组视网膜神经细胞凋亡率、LDH活性及Cleaved Caspase-3、Cleaved Caspase-9蛋白相对表达量均显著降低,差异均有统计学意义(均为P<0.01)(见图4和表4)。
图4 Western blot检测Glu+miR-con组和Glu+miR-410组细胞中Cleaved Caspase-3和Cleaved Caspase-9蛋白表达
表4 转染miR-410对Glu诱导视网膜神经细胞LDH活性、细胞凋亡率及Cleaved Caspase-3和Cleaved Caspase-9蛋白表达的影响
2.6 干扰miR-410部分逆转沉默lncRNA XIST抑制的Glu诱导视网膜神经细胞损伤和凋亡相较于Glu+si-lncRNA XIST+anti-miR-con组,Glu+si-lncRNA XIST+anti-miR-410组视网膜神经细胞凋亡率、LDH活性及Cleaved Caspase-3、Cleaved Caspase-9蛋白相对表达量均显著升高,差异均有统计学意义(均为P<0.01)(见图5和表5)。
图5 Western blot检测Glu+si-lncRNA XIST+anti-miR-con组和Glu+si-lncRNA XIST+anti-miR-410组细胞中Cleaved Caspase-3和Cleaved Caspase-9蛋白表达
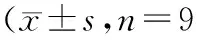
表5 转染anti-miR-410部分逆转沉默lncRNA XIST对Glu诱导视网膜神经细胞LDH活性、细胞凋亡率及Cleaved Caspase-3和Cleaved Caspase-9蛋白表达的影响 )
2.7 lncRNA XIST对Glu诱导视网膜神经细胞Nrf-2信号通路的影响与NC组相比,Glu组视网膜神经细胞中Nrf-2、HO-1、NQO1蛋白相对表达量均显著降低,差异均有统计学意义(均为P<0.05);与Glu+si-con组相比,Glu+si-lncRNA XIST组视网膜神经细胞中Nrf-2、HO-1、NQO1蛋白相对表达量均显著升高,差异均有统计学意义(均为P<0.05);与 Glu+si-lncRNA XIST+anti-miR-con组相比,Glu+si-lncRNA XIST+anti-miR-410组视网膜神经细胞中Nrf-2、HO-1、NQO1蛋白相对表达量均显著降低,差异均有统计学意义(均为P<0.05)(见图6和表6)。
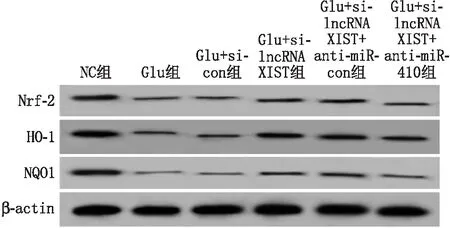
图6 Western blot检测各组细胞中Nrf-2、HO-1和NQO1蛋白表达
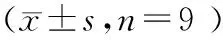
表6 lncRNA XIST对Glu诱导视网膜神经细胞Nrf-2、HO-1和NQO1蛋白表达的影响
3 讨论
lncRNA可通过竞争性结合miRNA从而参与视网膜疾病的发生发展过程。研究表明,miRNA在视网膜神经细胞中异常表达并可能参与缺血缺氧性视网膜病变的发生过程[10-12]。因而,积极探寻新型分子标志物可为视网膜损伤治疗药物的研发提供新思路。
本研究结果显示,Glu诱导的视网膜神经细胞凋亡率和LDH活性显著升高。研究表明,沉默lncRNA XIST可通过调节miR-449抑制急性心肌梗死大鼠的心肌细胞凋亡[13]。急性肺炎时抑制XIST可通过靶向miR-370-3p/TLR4而减轻内毒素诱导的WI-38细胞凋亡及炎症损伤[14]。本研究结果与鲍月宁等[15]研究结果相似,提示成功构建视网膜神经细胞损伤模型,Glu诱导的视网膜神经细胞中lncRNA XIST的表达水平显著升高,沉默lncRNA XIST后视网膜神经细胞凋亡率显著降低,LDH活性显著降低,提示沉默lncRNA XIST可抑制视网膜神经细胞凋亡及减轻炎症损伤。本研究结果显示,沉默lncRNA XIST后视网膜神经细胞中Cleaved Caspase-3、Cleaved Caspase-9表达水平显著降低,与马伟等[16]研究结果相似,提示沉默lncRNA XIST可能通过下调Cleaved Caspase-3、Cleaved Caspase-9的表达而抑制线粒体途径活化,进而抑制视网膜神经细胞凋亡。
本研究通过双荧光素酶报告实验与qRT-PCR实验证实,lncRNA XIST可靶向结合miR-410并可抑制miR-410的表达。miR-410通过PI3K/Akt信号通路对大鼠的七氟醚麻醉诱导的认知功能障碍发挥神经保护作用[17]。miR-410通过抑制PTEN/AKT/mTOR信号通路,在6-羟基多巴胺诱导的帕金森病细胞模型中发挥神经保护作用[18]。本研究结果显示,Glu诱导的视网膜神经细胞中miR-410的表达水平明显降低,miR-410过表达后视网膜神经细胞凋亡率和LDH活性显著降低,Cleaved Caspase-3、Cleaved Caspase-9蛋白的相对表达量也均明显降低,提示miR-410过表达可抑制Glu诱导的视网膜神经细胞凋亡及减轻氧化应激损伤。本研究结果还显示,干扰miR-410表达联合沉默lncRNA XIST处理后,Glu诱导的视网膜神经细胞凋亡率明显升高,LDH活性明显增强,Cleaved Caspase-3、Cleaved Caspase-9蛋白相对表达量均显著升高,提示沉默lncRNA XIST可能通过上调miR-410的表达从而减轻Glu诱导的视网膜神经细胞损伤。
Nrf-2信号通路是一种抗氧化通路,正常生理条件下,Nrf-2位于细胞质且与Keap1蛋白结合;当细胞处于氧化应激状态时Nrf-2与Keap1分离,Nrf-2进入细胞核并激活下游HO-1、NQO1,从而增强细胞抗氧化应激能力[19-20]。本研究结果显示,Glu诱导的视网膜神经细胞中Nrf-2、HO-1、NQO1蛋白表达水平均显著降低,说明Glu可抑制Nrf-2信号通路激活;沉默lncRNA XIST后Nrf-2、HO-1、NQO1蛋白表达水平均显著升高,而干扰miR-410后Nrf-2、HO-1、NQO1蛋白表达水平均显著降低,提示沉默lncRNA XIST可能通过上调miR-410表达而激活Nrf-2信号通路,从而发挥抗氧化应激作用。
综上所述,lncRNA XIST在Glu诱导的视网膜神经细胞中呈高表达,而miR-410表达下调,沉默lncRNA XIST可能通过上调miR-410的表达从而抑制神经细胞凋亡及减轻细胞损伤,且其可能是通过激活Nrf-2信号通路而发挥作用的。本研究结果可为缺血缺氧性视网膜疾病的防治提供新方向。

