miR-429在糖尿病视网膜病变中的表达和对AKT信号通路的影响△
杨洁 冉明 郜会龙
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的微血管并发症之一,严重时可致盲。随着糖尿病病程的延长,持续的高血糖刺激会破坏患者视网膜的毛细血管,最终大多数的糖尿病患者会发生DR[1]。目前,DR的治疗非常棘手,多年来进展甚微,因此,研究DR发病和进展的具体分子机制十分必要。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种促进血管生成的细胞因子。有研究显示,VEGF参与了DR新生血管的形成[2]。
miRNA是一类长为19~20 nt的小分子非编码RNA,通过序列互补与各个靶基因相互结合,从而调节基因的表达[3]。有研究报道,miRNA通过调节靶基因,参与了细胞的增殖[4]、分化[5]、癌变[6]等过程,对许多疾病的发生和发展有着重大的影响。miR-429是原癌基因的产物,在多种肿瘤细胞中表达异常,有研究报道,miR-429能抑制食管癌细胞的迁移和侵袭[7]。DR的发病机制是当前研究的热点,但目前国内外尚未见miR-429与DR发生和发展相关的研究。我们拟通过收集DR患者的临床标本,检测其中miR-429的表达,并通过细胞实验分析miR-429在DR发病中可能扮演的角色,以期为DR的发病机制、诊断和治疗的靶点提供新思路。
1 材料与方法
1.1 入选者一般资料以2017年7月至12月在我院就诊的117例2型糖尿病患者为研究对象,采集其外周血全血标本5 mL。根据病情将患者分为DR组和无DR(non-DR,NDR)组,同时选取同期在我院体检的健康人78名作为对照组(HC组)。其中糖尿病依据WHO的诊断标准确诊,DR根据眼底检查和荧光素眼底血管造影确诊。三组研究对象的一般资料见表1。三组患者间的年龄、性别构成、体质量指数等差异均无统计学意义(均为P>0.05);由于NDR组和DR组均为糖尿病患者,故空腹血糖和糖化血红蛋白(glycosylated hemoglobin,HbA1c)均显著高于HC组(均为P<0.001),但NDR组与DR组间空腹血糖、餐后2 h血糖、HbA1c及糖尿病病程差异均无统计学意义(均为P>0.05)。所有入选者均知情同意,并签署知情同意书。本研究通过我院伦理委员会批准。

表1 三组研究对象的一般资料及对比
1.2 细胞与主要试剂人视网膜微血管内皮细胞(human retinal microvascular endothelial cell, HRMEC)购自英国Cell System公司;上皮细胞基础培养基购自瑞士Lonza Group公司;TRIzol、VEGF siRNA、miR-429 scramble、miR-429 mimic和miR-429 inhibitor均购自美国Thermo Fisher Scientific公司;转染试剂盒购自美国Sigma Aldrich公司;小RNA提取试剂盒、加尾法miRNA cDNA第一链合成试剂盒和miRNA荧光定量PCR检测试剂盒均购自中国康为世纪公司;反转录试剂盒和SYBR GREEN试剂盒均购自日本TOYOBO公司;VEGF抗体、Bad抗体、AKT抗体、pAKT抗体、NOS3抗体、pNOS3抗体和兔抗人抗体均购自英国Abcam公司;VEGF over-expression构建和pcDNA3.1载体均购自上海英骏生物技术有限公司。
1.3 细胞培养与处理HRMEC在上皮细胞基础培养基中培养,及时更换培养液,待细胞状态良好、密度为60%~80%时传代并分组,其中,检测VEGF mRNA或蛋白表达时分为5组:(1)空白对照组:细胞不作任何处理;(2)高糖组:细胞用33 mmol·L-1葡萄糖刺激24 h;(3)scramble组:细胞用33 mmol·L-1葡萄糖刺激24 h后,转染miR-429 scramble;(4)mimic组:细胞用33 mmol·L-1葡萄糖刺激24 h后,转染miR-429 mimic;(5)inhibitor组:细胞用33 mmol·L-1葡萄糖刺激24 h后,转染miR-429 inhibitor。检测Bad mRNA表达及AKT通路相关蛋白表达时分为5组:(1)空白对照组:同前处理;(2)高糖组:同前处理;(3)过表达组:细胞用33 mmol·L-1葡萄糖刺激24 h后,转染VEGF over-expression;(4)空载组:细胞用33 mmol·L-1葡萄糖刺激24 h后,转染pcDNA3.1空载;(5)siRNA组:细胞用33 mmol·L-1葡萄糖刺激24 h后,转染VEGF siRNA。其中各组转染操作严格按转染试剂盒说明书进行,转染6 h后行细胞换液,用无菌PBS轻轻冲洗3次,加入适量正常的上皮细胞培养基,继续培养24 h后收集各组细胞,进行后续实验。
1.4 RT-PCR检测收集三组患者的外周血检测miR-429及VEGF mRNA的表达,收集各组细胞分别检测VEGF、Bad mRNA的表达。主要步骤为:用TRIzol法提取总RNA,分光光度法进行定量,琼脂糖凝胶电泳检测RNA的完整性;用反转录试剂盒获得cDNA,根据SYBR GREEN试剂盒进行RT-PCR检测,其中miR-429 RNA的提取用小RNA提取试剂盒、cDNA的获得用加尾法miRNA cDNA第一链合成试剂盒,用miRNA荧光定量PCR检测试剂盒定量,用2-ΔΔCt法分析数据。根据从NCBI获得的基因信息设计引物(见表2),引物由上海英骏生物技术有限公司合成。

表2 基因引物信息
1.5 ELISA检测将各组细胞培养上清加入到96孔板中,每孔100 μL,4 ℃过夜,PBS洗涤两次后晾干。体积分数5%BSA 37 ℃封闭1 h,PBS洗涤2次。加入VEGF抗体37 ℃孵育1 h,PBST洗涤5次,晾干。将兔抗人抗体按合适比例稀释后加入微孔,每孔100 μL,37 ℃孵育1 h后PBST洗涤5次,晾干。加入TMB显色液每孔100 μL,室温显色10~20 min。每孔加入2 mmol·L-1H2SO450 μL终止反应,终止后10 min内,检测其450 nm波长处光密度值。
1.6 Western blot检测收集各组细胞,用SDS Loading Buffer处理蛋白样品,之后行SDS-PAGE电泳,电泳结束后转至PVDF膜,体积分数5% BSA 4 ℃封闭过夜,洗涤后加入一抗(Bad、NOS3、AKT、pNOS3 s1177、pAKT s473抗体稀释比例均为11000),于37 ℃孵育1 h,洗涤3次,加入二抗(稀释比例为1500),于37 ℃孵育30 min,洗涤后显影。
1.7 统计学分析用Graphpad prism 6对数据进行统计分析。计量资料用均数±标准差表示,多组间比较用方差分析,两两比较用t检验,计量资料之间的关联性用Pearson相关分析。检验水准:α=0.05。
2 结果
2.1 miR-429和VEGF mRNA在DR患者外周血中表达收集三组研究对象的外周血,RT-PCR检测其中miR-429和VEGF mRNA的表达水平,结果显示,DR组患者外周血中miR-429和VEGF mRNA的相对表达量均显著高于NDR组和HC组,NDR组均高于HC组,差异均有统计学意义(均为P<0.001)(见表3)。Pearson相关性分析结果显示,DR组患者外周血中miR-429和VEGF mRNA的表达呈显著正相关(相关系数为0.804,P<0.001)。

表3 RT-PCR检测三组研究对象外周血中miR-429和VEGF mRNA的相对表达量
2.2 miR-429对细胞中VEGF表达影响RT-PCR和ELISA检测结果显示,高糖组VEGF的mRNA相对表达量和蛋白水平均显著高于空白对照组(均为P<0.05),而mimic组VEGF的mRNA相对表达量和蛋白水平均较scramble组显著升高(均为P<0.01),inhibitor组VEGF的mRNA相对表达量和蛋白水平均较scramble组显著降低(均为P<0.05)(见表4)。
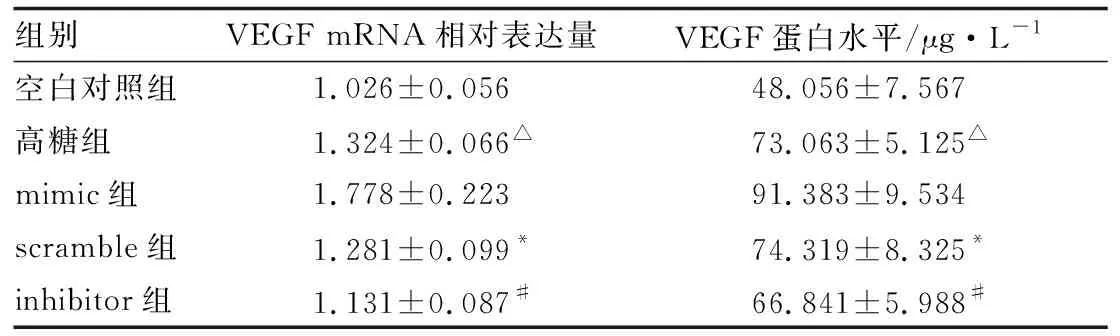
表4 各组HRMEC中VEGF mRNA的相对表达量和蛋白水平
2.3 VEGF对AKT通路影响RT-PCR检测结果显示,高糖组Bad mRNA相对表达量显著高于空白对照组,过表达组Bad mRNA相对表达量显著高于空载组,siRNA组Bad mRNA相对表达量显著低于空载组,差异均有统计学意义(均为P<0.05)(见图1A)。Western blot检测结果显示,高糖组Bad、pNOS3 s1177和pAKT s473蛋白的表达水平均显著高于空白对照组,过表达组Bad、pNOS3 s1177和pAKT s473蛋白的表达水平均显著高于空载组,siRNA组Bad、pNOS3 s1177和pAKT s473 蛋白的表达水平均显著低于空载组(见图1B)。

图1 RT-PCR和Western blot检测结果 A:RT-PCR检测各组Bad mRNA相对表达量(与空白对照组相比,#P<0.05;与空载组相比,*P<0.05);B:Western blot检测各组各因子蛋白表达电泳图。1:空白对照组;2:高糖组;3:空载组;4:过表达组;5:siRNA组
3 讨论
DR发病机制复杂,具体表现为眼底微血管病变,眼底微环境发生多种变化,如细胞自噬、氧化应激[8]、血管的炎性改变[9]等,同时因为机体对血管损伤的修复,会导致血管再生[10],从而使眼底微环境中VEGF、TNF-α、IL-1β等多种细胞因子表达增加[11]。血管受到多种细胞因子的作用,发生复杂的病变,且随着发病时间的延长,血管会彻底失去功能,严重影响眼底组织和细胞的血供,从而导致视力受损。
miRNA在DR的发生和发展中发挥了不同的作用。有研究报道,miR-21通过下调过氧化物酶体增殖物激活受体α(PPARα)来促进DR的发生[12]。本研究结果表明,miR-429和VEGF在DR患者外周血中表达上调,而且miR-429可促进VEGF在HRMEC中的表达。Gong等[13]研究表明,VEGF在DR中表达上调,而miR-15a可通过下调VEGF的表达来抑制DR的进展,这与本研究结果有类似之处。本研究结果还表明,VEGF可能是miR-429的靶基因。经靶基因预测软件TargetScan预测显示,miR-429与VEGF有可以互补结合的序列,这可能是miR-429促进VEGF表达上调的分子基础。当然,本研究有一定的局限性,NDR组和DR组患者的选取不够严格,许多临床资料没有进一步细化分析,尚需进一步研究。
在DR的发病机制中,血管的增生和炎性病变是不可忽略的因素。有研究报道[14],在DR动物模型中,NF-κB的亚基受到O-糖苷的糖基化修饰增加,并且会促进视网膜神经节细胞的死亡。这可能是因为高糖的刺激导致体内的糖苷和糖配体增加,从而导致多种功能蛋白的糖基化修饰水平增加。本研究结果表明,在高糖的刺激下,AKT的磷酸化水平是增加的,即高糖刺激可激活AKT通路,这与文献[14]报道基本相符。而本研究还发现,在转染VEGF over-expression后AKT的磷酸化水平进一步增加,这说明VEGF可促进AKT通路的激活,其具体的机制可能是VEGF促进下游分子的表达或功能的活化,而其下游分子参与了AKT通路的激活,或者VEGF通过反馈抑制或促进某些miRNA的功能,进而影响到AKT通路中关键分子的活化,导致AKT通路激活。
综上所述,本研究结果显示,在DR患者中,miR-429和VEGF的表达显著增加。在HRMEC中,miR-429可促进VEGF的表达上调,而且VEGF可促进AKT通路的激活。TargetScan分析发现miR-429可与VEGF结合,VEGF可能是miR-429的靶基因,说明miR-429有可能成为DR的治疗靶点。我们下一步将通过基因敲除、动物模型和细胞实验进一步确认VEGF与miR-429的相互作用,并研究其相互作用的具体分子机制,以期进一步阐明miR-429在DR发生和发展中的具体作用。

