蛋白质氧化对核桃蛋白界面性质的影响
孙领鸽 毛晓英 吴庆智 王丹丹 张 建 李宝坤 程卫东
(石河子大学食品学院 新疆石河子832003)
蛋白质能够自发地迁移至空气-水(A/W)界面或油-水界面(O/W),并在界面上形成蛋白吸附层,一般蛋白质的界面吸附过程是不可逆的。不同蛋白质具有不同的界面性质,主要受分子柔性、表面构象及亲/疏水氨基酸残基的分布方式等蛋白质分子特性以及pH、离子强度、温度和食品中其它组成成分等环境因素的影响[1]。蛋白质溶液的界面性质与蛋白质的起泡性和乳化性等功能性质密切相关[2]。界面张力下降是泡沫或乳化体系形成的首要条件,蛋白质通过在界面上快速吸附以及发生构象变化和分子重排降低界面张力,而张力降低的程度和速率是决定体系的形成的关键因素。同时,蛋白质分子通过分子间相互作用在空气-水或油-水界面上形成黏性膜阻止气泡或油滴重新聚集,从而保证泡沫或者乳化体系的稳定性[3-4]。近年来,随着蛋白质的起泡性和乳化性在食品加工中广泛应用,蛋白质的界面性质成为国内外学者的研究热点之一。例如:Zhang等[5]报道蛋白质起泡性与表面张力有关,表面张力对蛋白质乳化性和乳化稳定性也有重要影响。Lechevalier等[6]发现清蛋白、卵转铁蛋白和溶菌酶在空气/水界面上有协同作用;周春霞等[7]研究发现大豆球蛋白在空气-水界面上的吸附机制与油-水界面相同。
目前对于核桃蛋白的研究主要集中在蛋白质的提取纯化[8]、理化性质[9-10]、功能性质[11-12]以及活性多肽提取[13]等方面。纸皮核桃作为新疆地区特色产品之一,种植面积广,产量大,品质优良。然而,在核桃及其蛋白制品加工过程中,无论是脱脂之前还是脱脂之后,蛋白质始终会受到氧化应激环境的影响而发生氧化,导致蛋白质的性质发生改变。脂肪氧合酶催化多不饱和脂肪酸发生脂质过氧化反应产生的脂质自由基、脂质氢过氧化物和活性醛衍生物等均能诱导蛋白质发生氧化修饰[14]。丙二醛是脂质过氧化次生产物中含量最多的活性醛[15]。此前关于丙二醛与蛋白质氧化的研究主要集中在大豆蛋白的结构和功能性质方面[16-17],而在核桃蛋白尤其核桃蛋白的界面性质方面鲜有报道。
为了研究氧化对核桃蛋白水-空气界面性质的影响,本试验中采用浓度为0~10 mmol/L 的丙二醛溶液和核桃蛋白建立氧化模拟体系,研究核桃蛋白氧化后羰基值、粒径分布、Zeta 电位、表面张力、表面疏水性和起泡性质的变化,氧化后核桃蛋白分散体系的特征以及与蛋白泡沫体系有关的界面性质,从而为利用蛋白质起泡性等功能性质,提高核桃蛋白产品质量品质以及工艺设计和改进提供理论依据。
1 材料与方法
1.1 材料与试剂
新疆纸皮核桃,石河子市农贸市场;1,1,3,3-四乙氧基丙烷,美国Reanta 公司;所有试剂均为分析纯级。
1.2 仪器与设备
JYW-200A 表面张力仪,承德优特检测仪器有限公司;LGJ-18S 冷冻干燥机,北京松源华兴科技有限公司;NavoPlus 粒径分析仪,麦克默瑞提克(上海)仪器有限公司;SHZ-B 水浴恒温振荡器,上海博迅实业有限公司医疗设备厂;高速冷冻离心机,费默飞世尔科技(中国)有限公司;NanoPlus Zeta 电位及纳米粒度分析仪,英国Malvern 公司;ELE 高速均质剪切机,上海易勒机电设备有限公司。
1.3 试验方法
1.3.1 核桃分离蛋白的制备 核桃分离蛋白的制备参照毛晓英[10]的方法。
1.3.2 氧化核桃蛋白的制备 参照Adams等[15]的方法制备丙二醛,在波长267 nm 处测定丙二醛的浓度。将一定浓度的蛋白质溶液与已知浓度的丙二醛溶液混合,使得核桃蛋白溶液中丙二醛的浓度分别为 0,0.01,0.1,1,10 mmol/L。将制备好的氧化蛋白溶液在恒温水浴振荡器中振荡24 h,保证其充分反应。反应结束后在去离子水中透析72 h 除去未反应的丙二醛,透析过程中注意及时更换去离子水。通过冷冻干燥得到粉状的丙二醛氧化核桃蛋白。
1.3.3 羰基值的测定 采用2,4-二硝基苯肼法,试验操作参照Wu等[18]的方法。
1.3.4 粒径的分布 将核桃蛋白样品用0.01 mmol/L pH 8.0 磷酸盐缓冲溶液溶解,室温搅拌2 h 以8 000×g 离心30 min,通过稀释使得上清液最终质量浓度为1 mg/mL,采用粒径分析仪测定粒径分布。
1.3.5 相对分子质量的测定 参照Wu等[16]的方法,采用LC-20A 高效液相色谱仪检测核桃蛋白样品的分子质量分布情况。
1.3.6 Zeta 电位的测定 将样品用0.01 mmol/L pH 8.0 磷酸盐缓冲溶液按照1:200 的比例稀释,采用Zeta 电位及纳米粒度分析仪测定溶液电位[19]。
1.3.7 表面张力的测定 将蛋白质样品分散于去离子水中,配制成0.01 kg/L 的蛋白质溶液,采用JYW-200A 表面张力仪测定表面张力。
1.3.8 表面疏水性的测定 参照Huang等[20]的方法,测定核桃蛋白的表面疏水性。
1.3.9 起泡性的测定[21]取50 mL 1%蛋白质溶液于烧杯中,用高速均质剪切机以10 000 r/min 的转速搅拌2 min 后迅速倒入100 mL 量筒中,记录体积,计算起泡能力(FC);静置30 min 后,再次记录体积,计算泡沫稳定性(FS)。

式中,V——搅拌停止时泡沫与溶液的总体积,mL;50——原溶液的体积,mL
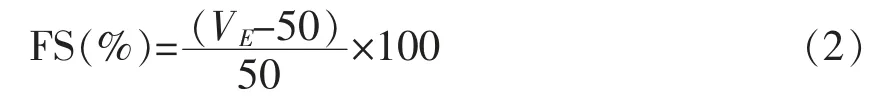
式中,VE——静置30 min 后泡沫与溶液的总体积,mL。
1.4 数据处理与统计分析
试验结果用平均数±标准误差表示,样本重复数n=3。显著性分析采用SPSS statisics 23.0 的Dukeny 检验,绘图采用Origin 8.5 软件。
2 结果与分析
2.1 蛋白质氧化对核桃蛋白羰基值的影响
作为目前应用最为广泛的蛋白质氧化生物标记,蛋白质羰基值用于表征蛋白质氧化的程度。由图1可知,未氧化核桃蛋白的羰基值为3.12 nmol/mg;随着丙二醛浓度的增加,核桃蛋白的羰基值显著增加(P<0.05);丙二醛含量为10 mmol/L时,核桃蛋白羰基值是未氧化蛋白羰基值的7 倍,表明核桃蛋白发生了显著氧化。Wu等[16]研究发现大豆分离蛋白随着丙二醛浓度增加而增大;Burcham等[22]用不同浓度的丙二醛处理牛血清蛋白时得到类似的结果。由于丙二醛分子含有2 个羰基,当其中1 个羰基与伯胺发生加成反应时会为蛋白质引入另1 个羰基[15];同时,丙二醛分子还能通过与蛋白质分子中的半胱氨酸、组氨酸和赖氨酸等亲和侧链基团反应生成西佛碱从而导致蛋白质羰基化[23]。
2.2 蛋白质氧化对核桃蛋白粒径分布的影响
分子大小与蛋白质高分子在溶液体系中的稳定性密切相关[24],蛋白质粒径的变化会影响其表面性质[25]。丙二醛氧化对核桃蛋白粒径分布的影响如图2所示。由图2可知,未经氧化处理的核桃蛋白粒径主要分布在0~1 000 nm 范围内,峰值出现在300 nm 左右;随着丙二醛浓度从0 mmol/L 增加至0.1 mmol/L,粒径分布向小粒径方向偏移,说明分子粒径减小;随着丙二醛浓度的进一步增加,粒径分布明显向大粒径方向偏移,粒径分布范围变宽,粒径较大的蛋白分子所占体积比持续增加;这与王丹丹等[26]的研究结果相一致。低浓度的氧化使蛋白质分子解离,小的可溶性聚集体断裂成更小的小分子多肽,导致粒径较小的蛋白质颗粒所占体积比增加;过度的氧化使核桃蛋白分子结构展开,暴露出分子内部巯基和疏水基团,并与核桃蛋白结合形成氧化聚集体,导致蛋白质粒径增加[27]。Liu等[28]认为游离巯基氧化形成氧化聚集体可使大豆分离蛋白粒径增加。本试验结果表明蛋白质氧化使核桃蛋白的分子结构发生改变,进而影响蛋白质的界面性质。
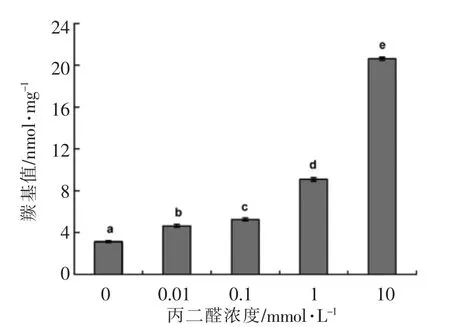
图1 氧化对核桃蛋白样品羰基值的影响Fig.1 Effects of carbonyl content of walnut protein oxidized by malondialdehyde
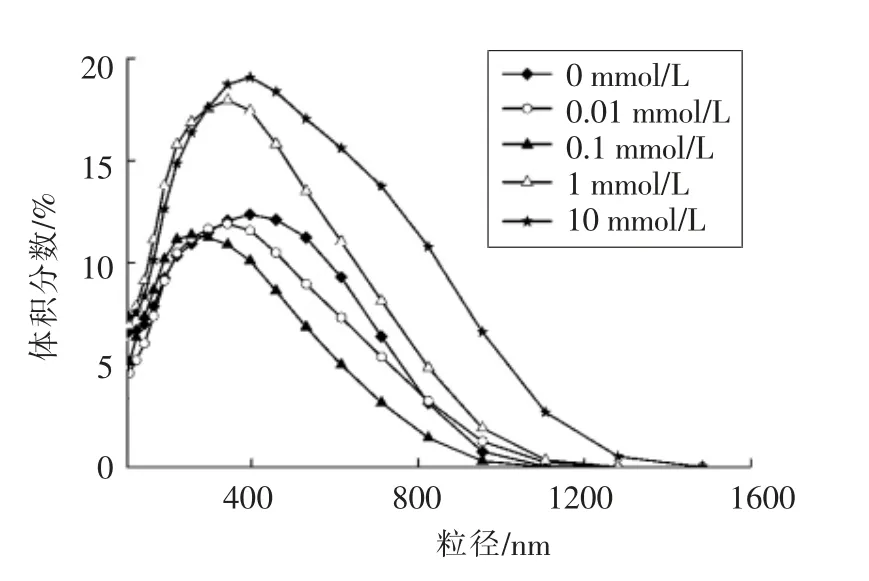
图2 核桃蛋白样品溶液粒径分布Fig.2 Droplet size distribution of walnut protein samples
2.3 蛋白质氧化对核桃蛋白相对分子质量分布的影响
高效液相分子排阻色谱(HPSEC)是一种反映分子分布和蛋白质聚集程度的重要方法。核桃蛋白样品的HPSEC 结果如图3 和表1所示。相同条件下测定的标准蛋白质校准曲线如图3a所示。由图3b可知,未氧化的核桃蛋白分子呈多元分散分布,3 个主要峰保留时间分别为6.0 mim(峰面积为1.89%,分子质量大于1 000 ku);9.82 min(峰面积为34.71% ,分子质量为282 ku)和11.77 min(峰面积为63.41%,分子量为69 ku)。相对分子质量的连续分布表明,核桃蛋白是由一系列分子质量不同的蛋白质组成的。当丙二醛浓度由0 mmol/L 增加至0.1 mmol/L 时,3 个主峰的峰面积百分比减小。当丙二醛浓度达到0.1 mmol/L 时,出现了新的分子质量为50 ku 的峰(峰面积64.18%),这可能是由于低浓度的丙二醛氧化诱导核桃蛋白产生了低分子质量的多肽。当丙二醛浓度由0.1 mmol/L 增加到10 mmol/L 时,分子质量高于1 000 ku、282 ku 和69 ku 的峰所占面积的百分比逐渐增加,分子量为50 ku 的峰消失(图3d~f。这一现象说明,随着丙二醛浓度增加,核桃蛋白分子逐渐聚集。上述结果表明较低(≤0.1 mmol/L)浓度的丙二醛能氧化诱导核桃蛋白质形成小的多肽链;而随着丙二醛浓度增加至10 mmol/L,断开的小多肽链重新聚合,并且蛋白质分子发生交联形成了更大的聚集体[16]。此结果与核桃蛋白粒径分布结果相一致。

表1 蛋白质氧化对核桃蛋白分子质量分布的影响Table 1 Effects of molecular weight distribution of walnut protein samples oxidized by malondialdehyde
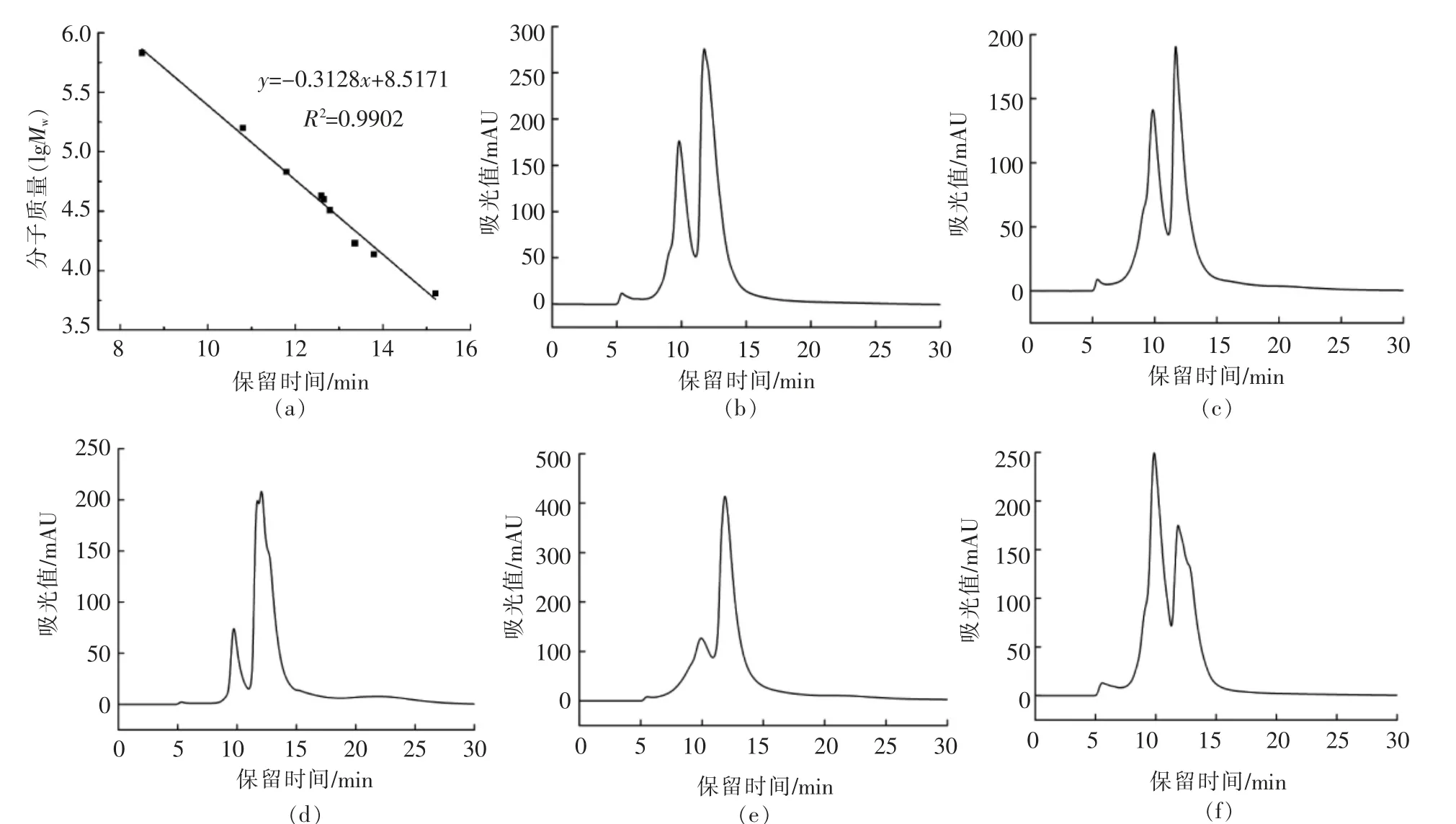
图3 蛋白质氧化对核桃蛋白分子质量分布的影响Fig.3 Effects of molecular weight distribution of walnut protein samples oxidized by malondialdehyde
2.4 蛋白质氧化对核桃蛋白溶液Zeta 电位的影响
一般用溶液Zeta 电位反映蛋白质表面的带电情况。蛋白质分子的界面的吸附行为与其表面电荷有很大关系,分子间存在适当斥力使它们呈现的分散状态有利于界面吸附从而获得良好的界面性质[29]。图4 为蛋白质氧化对核桃蛋白溶液Zeta电位的影响。由图4可知,随着氧化程度增加,核桃蛋白溶液的Zeta 电位绝对值呈先增加后减小的趋势。当丙二醛浓度为0.1 mmol/L 时,蛋白质溶液Zeta 电位的绝对值最大,为10.38 mV。氧化能够改变核桃蛋白的分子结构,较低浓度的氧化使得蛋白质分子构象发生解折叠,原本包埋在分子内部的氨基酸被暴露,蛋白质表面带电氨基酸增加,分子间的静电排斥力增加,导致Zeta 电位的绝对值增加;过度氧化能够改变蛋质白氨基酸残基或空间结构,导致核桃蛋白颗粒界面性质发生变化[29]。当丙二醛浓度由0.1 mmol/L 增加至10 mmol/L 时,Zeta 电位的绝对值逐渐减小,最终导致体系稳定性降低,这与粒径分布的变化一致。蛋白质溶液Zeta 电位越高,分子间的静电排斥力越大,蛋白分子越不易聚集,蛋白质分子粒径越小。当分子之间的排斥力小于吸附力时,会导致蛋白聚集成大分子,从而影响体系稳定性[30]。
2.5 蛋白质氧化对核桃蛋白表面张力的影响
表面张力指增加单位表面积时表面位能的增量。表面张力下降是泡沫产生和乳化的前提,下降的程度是起泡力和乳化力大小的决定因素[31]。利用表面张力仪测定核桃蛋白样品的表面张力,结果如图4所示,未氧化核桃蛋白的表面张力为60.47 mN/m。随着氧化程度增加,核桃蛋白的表面张力先下降后上升。当丙二醛浓度为0.1 mmol/L时,核桃蛋白的表面张力最小,为55.64 mN/m。这是由于低浓度的氧化使蛋白分子去折叠,蛋白质分子多肽链展开,更多疏水基团延伸至气相,亲水基团延伸至水相,更有利于蛋白质在界面处发生变性,导致蛋白质分子的表面张力降低;过度氧化导致粒径更大的分子聚集体形成,分子柔性降低,蛋白质表面积减小,不利于蛋白质在水-空气界面上的吸附,导致蛋白质表面张力增加[32]。阚建全等[33]的研究发现蛋白质起泡力和泡沫稳定性与表面张力减弱的速率有关,而低浓度蛋白质的乳化力和乳化稳定性与表面张力有关。
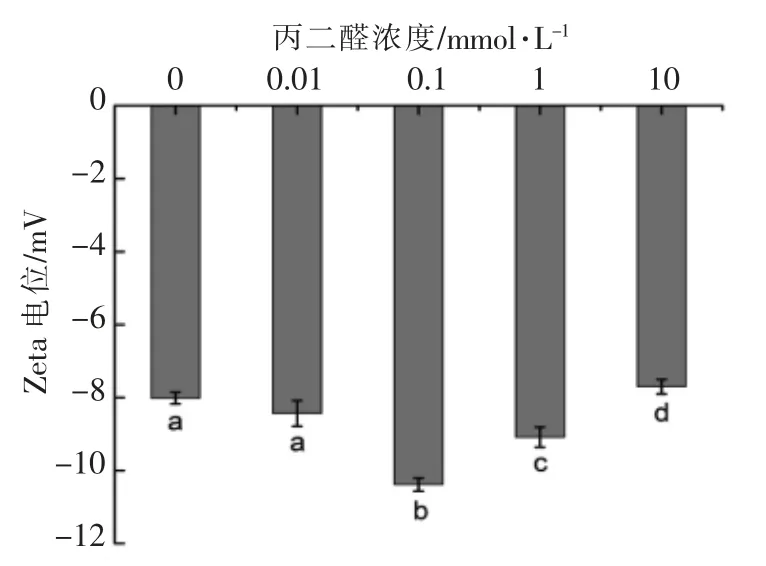
图4 蛋白质氧化对核桃蛋白溶液Zeta 电位的影响Fig.4 Effects of malondialdehyde oxidation on Zeta potential of walnut protein samples
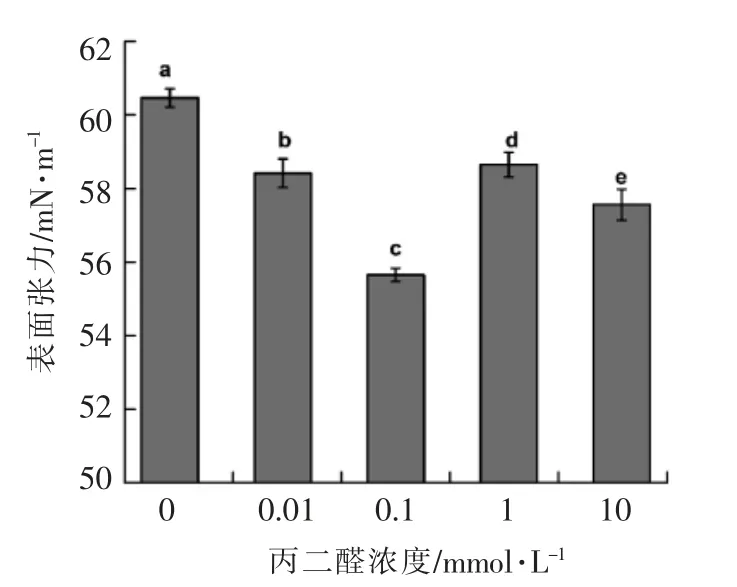
图5 蛋白质氧化对核桃蛋白样品表面张力的影响Fig.5 Effects of malondialdehyde oxidation on surface tension of walnut protein samples
2.6 蛋白质氧化对核桃蛋白表面疏水性的影响
蛋白质分子表面疏水氨基酸残基的分布情况,是影响蛋白质界面性质的主要因素。分子表面无疏水性氨基酸残基或未形成较连续的疏水区域,蛋白质在界面不吸附或者吸附能力较差[1]。蛋白质分子表面疏水性氨基酸残基的分布情况一般用表面疏水性表示。蛋白质氧化对核桃蛋白表面疏水性的影响如图6所示。未氧化核桃蛋白的表面疏水性为453,随着氧化程度增加,核桃蛋白表面疏水性呈先增加后降低的趋势。当丙二醛浓度为0.1 mmol/L 时,核桃蛋白的疏水性达到最大,为476;而随着丙二醛浓度的进一步增加,核桃蛋白的表面疏水性从476 下降至422(P<0.05)。叶林[19]的研究表明适度氧化可使大豆蛋白的表面疏水性增加。这是由于氧化导致蛋白质分子空间结构发生改变,三级结构被打开,更多的疏水区域暴露,导致蛋白质疏水性增加[19]。然而暴露出的疏水基团随着丙二醛浓度的增加进一步发生氧化修饰,通过疏水相互作用缔合形成的蛋白分子聚集体[34]和蛋白质分子羰基化形成的羰基衍生物[35]共同作用使得核桃蛋白的表面疏水性下降。
2.7 蛋白质氧化对核桃蛋白起泡性和泡沫稳定性的影响
作为主要的蛋白质界面性质,起泡性质一般用起泡性和泡沫稳定性评价。起泡性是指蛋白质能降低气液界面表面张力而帮助形成泡沫的能力[36];泡沫稳定性是指泡沫生成以后的持久性,即泡沫的寿命[1]。蛋白质氧化对核桃蛋白起泡性和泡沫稳定的影响如图7所示。未氧化核桃蛋白的起泡性和泡沫稳定性分别为8.73%和6.30%,随着氧化程度增加,起泡性和泡沫稳定性均呈先增加后降低的趋势。当丙二醛浓度为0.1 mmol/L 时,核桃蛋白的起泡性和泡沫稳定达到最大值,分别为21.43%和17.80%。这一结果与表面张力的变化一致。蛋白质巯基氧化破坏了蛋白质分子之间的非共价键相互作用力,导致核桃蛋白质分子部分展开,更多内部疏水性基团迁移至蛋白表面,有利于蛋白质在水-空气界面的快速吸附,降低表面张力,从而增强蛋白质的起泡性。并且伸入气相的疏水性基团通过相互作用形成了更为稳定的二维网络结构和界面膜[37],而伸入水相的极性基团通过水合作用减少液膜液体流失,从而增强蛋白质的泡沫稳定性[38]。当氧化程度进一步增加,被暴露出来的疏水基团和巯基通过疏水相互作用、二硫键、静电相互作用及氢键等重新形成更大的不溶性蛋白质分子聚集体,不利于水-空气界面的形成以及界面膜稳定性的维持[39],导致蛋白质的起泡性和起泡稳定性减弱。Wang等[40]人的研究也表明氧化会诱导大豆蛋白起泡性和起泡稳定性发生变化。
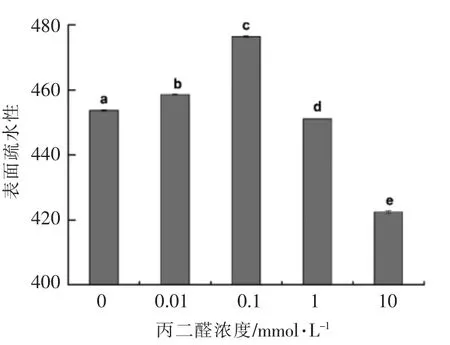
图6 丙二醛氧化修饰对核桃蛋白表面疏水性的影响Fig.6 Effects of malondialdehyde oxidation on hydrophobic surface of walnut protein
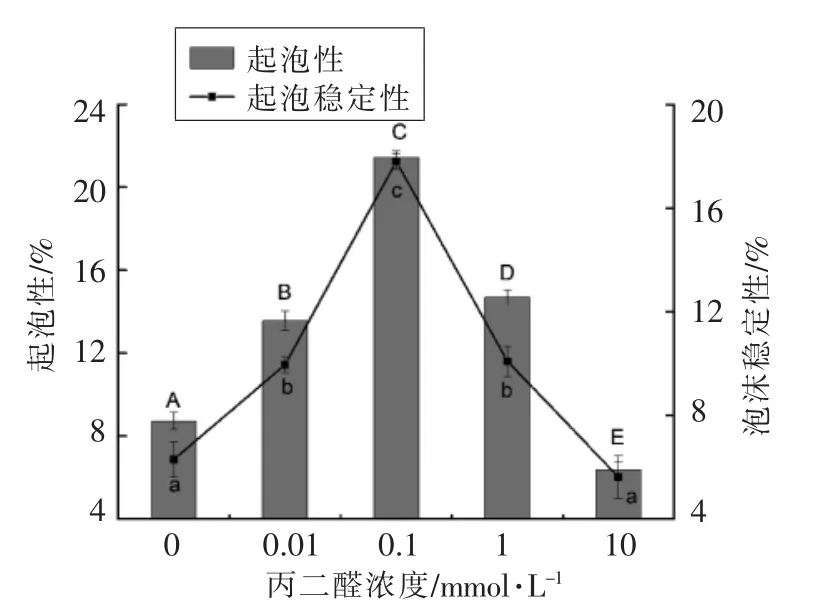
图7 氧化对核桃蛋白起泡性和泡沫稳定性的影响Fig.7 Effects of malondialdehyde oxidative on foam capacity and foam stability of walnut protein samples
3 结论
为探究蛋白质氧化对核桃蛋白界面性质的影响,本试验采用不同浓度(0~10 mmol/L)的丙二醛替代脂质过氧化产生的活性醛氧化处理核桃蛋白,结果表明,丙二醛氧化导致核桃蛋白羰基衍生物形成,羰基含量显著增加(P<0.05);低浓度(≤0.1 mmol/L)的丙二醛导致核桃蛋白粒径、相对分子质量和表面张力减小,溶液Zeta 电位和表面疏水性增加,并使得蛋白质起泡性和起泡稳定性增加;高浓度(>0.1 mmol/L)的丙二醛诱导蛋白聚集体形成和蛋白质交联,导致蛋白粒径、相对分子质量和表面张力增加,表面疏水性和溶液Zeta 电位减小,蛋白质起泡性和泡沫稳定性显著下降。试验结果说明蛋白质氧化会诱导核桃蛋白分子构象和表面活性发生改变,适当的氧化(丙二醛浓度≤0.1 mmol/L)可以改善核桃分离蛋白的界面性质;而过度氧化则会对核桃蛋白的泡沫性质等界面性质产生负面影响。因此通过控制核桃蛋白的氧化程度可以改善其乳液体系的界面特性。本研究结果为利用蛋白质起泡性等界面性质提高核桃蛋白产品质量品质以及进行工艺设计和改进提供了理论依据,但关于蛋白质氧化对油-水界面性质的影响还有待进一步研究。

