槲皮素对甲基乙二醛诱导的成骨细胞凋亡保护作用研究
金杯 戴盼盼 孙旺 顾卫燕 林海升 施更生
牙周炎是常见的口腔慢性疾病,与糖尿病相互影响且互为易感因素[1-2]。糖尿病患者牙周组织破坏更显著,疾病发展更迅速,是目前临床研究的难点。研究发现,细胞凋亡贯穿糖尿病性牙周炎的发生、发展[1],而成骨细胞凋亡在牙周炎牙槽骨吸收中起关键作用。甲基乙二醛作为牙周炎与糖尿病的共同致病因素,可由牙周炎致病菌福赛类杆菌产生[3],并且在糖尿病患者血清中高浓度存在,与糖尿病以及肾病、心血管病、白内障等多种糖尿病并发症密切相关。槲皮素是一种人类饮食中广泛存在的天然黄酮类化合物,具有强大的抗氧化和抗炎活性,并被认为在治疗和预防包括癌症、神经退行性疾病和心血管疾病在内的疾病中发挥作用,已被证实具有抗糖尿病潜力[4]。糖原合成酶激酶 3β(glycogen synthase kinase-3β,GSK-3β)负向调控转录因子E2相关因子2(nuclear factor-erythroid 2 related factor 2,Nrf2),与细胞抗氧化、抗炎和抗凋亡等能力有关[5]。Bcl-2家族蛋白,包括Bcl-2和Bax,在线粒体凋亡级联反应中发挥着重要作用。Bcl-2位于线粒体外膜上,起着抑制凋亡作用,而Bax移位到线粒体上,增加线粒体膜的通透性,促进细胞色素C的释放,进而启动凋亡。因此,目前认为细胞内Bcl-2、Bax这两种对立蛋白的比率关系是决定细胞凋亡的关键[6]。本研究通过体外培养成骨细胞,观察甲基乙二醛处理对细胞Bcl-2、Bax表达及GSK-3β/Nrf2信号通路的影响及槲皮素的干预作用,以期为槲皮素在糖尿病牙周炎的临床应用提供理论基础,现报道如下。
1 材料和方法
1.1 材料 (1)细胞株:小鼠成骨细胞MC3T3-E1细胞系购自美国ATCC细胞库。(2)药物与试剂:α-MEM细胞培养基、FBS、胰蛋白酶(美国Gibco公司),甲基乙二醛、槲皮素、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、二甲基亚砜(DMSO)、Annexin V-FITC/PI细胞凋亡检测试剂盒、β-actin一抗(美国Sigma公司),Bcl-2、Bax、p-GSK-3β(Ser9)、GSK-3β、Nrf2 一抗(美国Cell Signaling Technology公司),4,6-二脒基-2-苯基吲哚(DAPI)(美国 Invitrogen公司),TUNEL试剂盒(瑞士Roche公司),二抗(上海碧云天生物技术有限公司)。(3)主要仪器:酶标仪(美国Bio-TEK公司),流式细胞仪(美国Becton公司),正置荧光显微镜(德国Leica公司),电泳仪、曝光仪(美国BIO-RAD公司)。
1.2 方法
1.2.1 细胞培养 将MC3T3-E1细胞接种于含10% FBS和100 U/ml青霉素G和100 ng/ml链霉素的α-MEM培养基,置于37℃、5% CO2培养箱培养备用。
1.2.2 细胞分组与处理 将处于对数生长期的MC3T3-E1细胞随机分为4组。(1)对照组:MC3T3-E1细胞用α-MEM培养基(加入FBS)培养。(2)甲基乙二醛组:MC3T3-E1细胞用半数抑制浓度的甲基乙二醛培养24 h。(3)槲皮素组:MC3T3-E1细胞用6.25 μmol/L槲皮素培养25h。(4)槲皮素+甲基乙二醛组:MC3T3-E1细胞用6.25 μmol/L槲皮素预培养1 h,再加入半数抑制浓度的甲基乙二醛培养24 h。
1.2.3 细胞增殖活性检测 采用MTT法。将对数生长期的MC3T3-E1细胞接种于96孔板(104个/孔),培养24 h后按不同分组处理后换α-MEM培养基(无血清),每孔加入 20 μl 5 mg/ml的 MTT ,37 ℃、5% CO2培养箱避光培养4 h。小心吸弃孔内上清液,每孔加入150 μl DMSO,待结晶完全溶解后酶标仪490 nm处检测吸光度值。细胞存活率(%)=(各实验组吸光度值-调零孔吸光度值)/(对照组吸光度值-调零孔吸光度值)×l00%。
1.2.4 细胞凋亡检测 采用Annexin V-FITC/PI双标记结合流式细胞仪以及TUNEL染色法。Annexin V-FITC/PI法:将消化收集的细胞调整密度至106个/ml,室温避光加入Annexin V-FITC,再加入PI,孵育10 min后流式细胞仪检测细胞凋亡。TUNEL染色法:将各处理组细胞爬片用4%多聚甲醛室温固定1 h,2~8℃温度下通透液(体积分数0.1% Triton X-100和质量分数0.1%柠檬酸钠配成)处理2 min,再用50 μl反应液37℃避光孵育1 h,用含有DAPI的封片剂封片,室温避光24 h后正置荧光显微镜观察拍照,计数300个细胞计算凋亡率。
1.2.5 蛋白表达检测 采用Western blot法。用裂解液(RIPA裂解液与PMSF按100:1的比例配置)充分裂解细胞,超声后高速离心机4℃ 12 000 r/min离心,上清液-80℃分装保存。采用BCA法测定蛋白浓度,将各组蛋白浓度调至相同后与上样缓冲液混合,100℃煮沸10 min使蛋白充分变性。配制5%浓缩胶以及12%分离胶,每孔上样20 μg蛋白,SDS-PAGE电泳分离后湿转法将蛋白电转至PVDF膜,5%脱脂奶粉封闭,将膜分别转入含一抗的稀释液中(Bcl-2、Bax、p-GSK-3β、GSK-3β、Nrf2 1:2 000,β-actin 1:3 000),4 ℃孵育过夜,洗膜后二抗室温孵育1 h,化学发光成像仪曝光,扫描图像并用Image J软件分析灰度。
1.3 统计学处理 采用SPSS 19.0统计软件。计量资料以表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验。计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 甲基乙二醛对成骨细胞的半数抑制浓度 0、100、200、300、400、500、600、700 μmol/L 的甲基乙二醛处理成骨细胞24 h后,细胞存活率分别为100.00%、95.51%、86.21%、77.83%、78.13%、72.10%、48.15%、5.32%(P <0.05),说明甲基乙二醛能抑制成骨细胞增殖活性,并呈浓度依赖性,600 μmol/L是甲基乙二醛对成骨细胞的半数抑制浓度,见图1。

图1 不同浓度甲基乙二醛对成骨细胞增殖活性的影响(与对照组比较,*P< 0.05)
2.2 甲基乙二醛组与对照组成骨细胞凋亡情况比较 流式细胞术结果显示甲基乙二醛组细胞凋亡率为41.60%,明显高于对照组(P<0.05),说明甲基乙二醛诱导细胞死亡类型以凋亡为主。此外,TUNEL染色结果显示,甲基乙二醛组细胞染色阳性率为35.53%,高于对照组(P<0.05),进一步说明甲基乙二醛可以诱导成骨细胞凋亡,见图2。
2.3 甲基乙二醛组与对照组成骨细胞Bcl-2、Bax表达水平比较 Western blot结果示,与对照组相比,甲基乙二醛组成骨细胞Bcl-2表达水平下降(P<0.05),而Bax表达水平升高(P<0.05),Bcl-2/Bax比率下降,进一步验证甲基乙二醛可诱导成骨细胞凋亡,见图3。
2.4 甲基乙二醛组与对照组成骨细胞GSK-3β/Nrf2信号通路相关蛋白表达水平比较 Western blot结果示,与对照组相比,甲基乙二醛组p-GSK-3β、Nrf2表达水平均明显下降(均P<0.05),见图4。
2.5 槲皮素干预对成骨细胞增殖活性的影响 MTT结果所示,低浓度的槲皮素对成骨细胞增殖活性无明显影响,而25、50 μmol/L高浓度的槲皮素处理后细胞存活率分别为89.48%、84.58%,说明高浓度的槲皮素有细胞毒性。此外,与甲基乙二醛组比较,低浓度的槲皮素预处理后能明显恢复细胞增殖活性,6.25 μmol/L的槲皮素保护效果最好,故后续实验采取该浓度,见图5。
2.6 槲皮素+甲基乙二醛组、槲皮素组、甲基乙二醛组、对照组细胞凋亡情况和Bcl-2、Bax表达水平比较 与甲基乙二醛组相比,槲皮素+甲基乙二醛组TUNEL细胞染色阳性率降低(P<0.05),说明细胞凋亡减少。此外,与甲基乙二醛组相比,槲皮素+甲基乙二醛组Bcl-2蛋白表达水平升高,Bax蛋白表达水平下降,进一步说明槲皮素能缓解甲基乙二醛诱导的成骨细胞凋亡,见图6。

图2 甲基乙二醛组与对照组成骨细胞凋亡情况比较[与对照组比较,*P<0.05;a:流式细胞图;b:细胞凋亡率比较;c:TUNEL染色结果(×200);d:TUNEL 阳性细胞率比较]

图3 甲基乙二醛组与对照组成骨细胞Bcl-2、Bax表达水平比较(与对照组比较,*P<0.05;a:蛋白电泳图;b:Bcl-2表达水平比较;c:Bax表达水平比较)

图4 甲基乙二醛组与对照组成骨细胞糖原合成酶激酶3β(GSK-3β)/转录因子E2相关因子2(Nrf2)信号通路相关蛋白表达水平比较(与对照组比较,*P<0.05;a:蛋白电泳图;b:p-GSK-3β 表达水平比较;c:GSK-3β 表达水平比较;d:Nrf2表达水平比较)
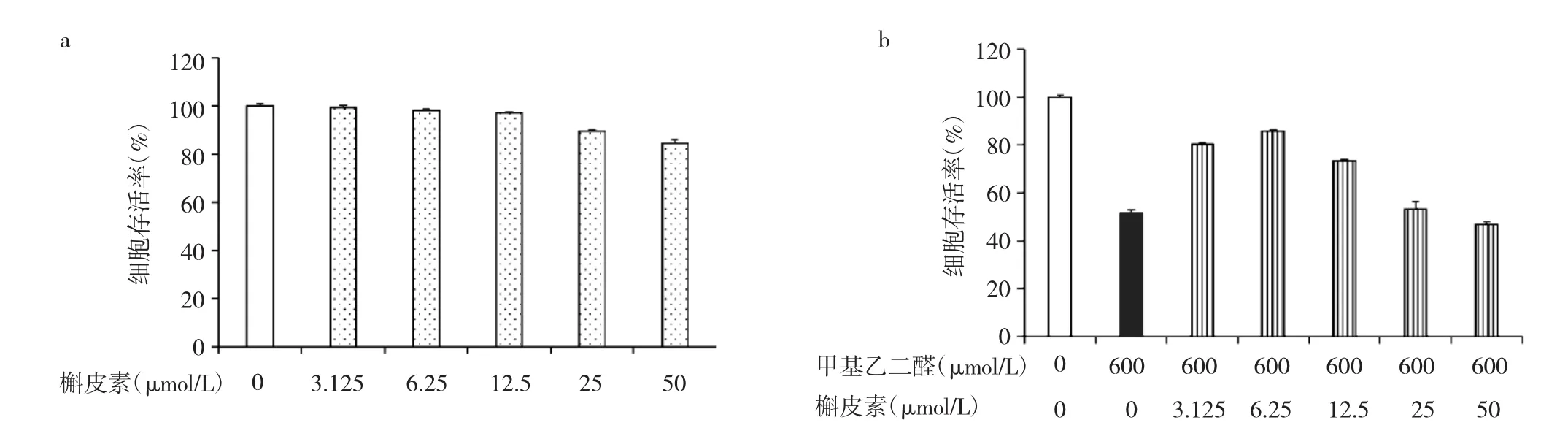
图5 槲皮素干预对成骨细胞增殖活性的影响(a:不同浓度槲皮素对细胞增殖活性的影响;b:槲皮素对甲基乙二醛细胞增殖活性干预的影响)
2.7 槲皮素+甲基乙二醛组、槲皮素组、甲基乙二醛组、对照组细胞GSK-3β/Nrf2信号通路相关蛋白表达水平比较 槲皮素组与对照组细胞p-GSK-3β、Nrf2蛋白表达水平比较差异均无统计学意义(均P>0.05)。与甲基乙二醛组相比,槲皮素+甲基乙二醛组p-GSK-3β、Nrf2蛋白表达水平升高(均P<0.05),见图7。
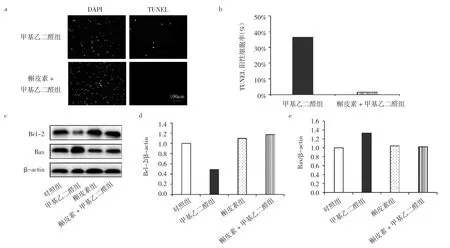
图6 槲皮素+甲基乙二醛组、槲皮素组、甲基乙二醛组、对照组细胞凋亡情况和Bcl-2、Bax表达水平比较[a:TUNEL染色结果(×200);b:TUNEL 阳性细胞率比较;c:Bcl-2、Bax蛋白电泳图;d:Bcl-2 表达水平比较;e:Bax表达水平比较]
3 讨论
牙周炎是最常见的口腔慢性疾病,是中国成人失牙的首位因素,其作为糖尿病的第六大并发症,两者之间息息相关:牙周感染会降低胰岛素功能,不利于血糖控制;而糖尿病患者抗感染能力降低是牙周病的重要危险因素[7]。因此,糖尿病性牙周炎已成为了牙周病预防及治疗中的难点和重点。牙槽骨破坏是牙周炎的重要病理特征,是造成牙齿松动和脱落的直接原因。有研究显示,糖尿病牙周炎的发生、发展与细胞凋亡密切相关,在糖尿病病理条件下,牙周支持组织中成骨细胞凋亡增加,进一步限制了骨组织的愈合[1,8]。
槲皮素是一种天然黄酮类化合物,广泛存在于饮食及中草药中,对人体无毒、无三致作用,国内外对其研究日益增多,已被证实具有抗感染、抗氧化等药理活性,并对癌症、神经退行性疾病和心血管疾病等多种疾病有潜在治疗效果[9]。近年来,槲皮素在糖尿病中的应用被愈发关注。Vieira-Frez等[10]发现槲皮素能缓解糖尿病大鼠神经元细胞、巨噬细胞的氧化应激损伤。Hu等[11]以小鼠为模型发现槲皮素能通过SIRT1/NLRP3通路预防糖尿病脑病。Daniel等[12]证实槲皮素能抑制线粒体膜通道,减少肝细胞凋亡缓解糖尿病大鼠肝损伤。类似的,Roslan等[13]发现槲皮素能缓解糖尿病大鼠心肌细胞凋亡。因此,本研究初步探讨槲皮素保护成骨细胞的效果及机制。
甲基乙二醛是一种有毒代谢产物,在糖尿病的高糖病理环境下,磷酸酶使磷酸二羟丙酮生成二羟丙酮,进而形成甲基乙二醛。研究发现甲基乙二醛是牙周炎重要致病菌福赛类杆菌的产物,其浓度在牙周炎患者龈沟液中比正常者可高出15~20倍[3]。此外,甲基乙二醛能诱发牙周组织的炎症反应[14],诱导牙龈成纤维细胞凋亡[15]。本研究发现甲基乙二醛能够抑制成骨细胞增殖活性,并且呈浓度依赖性。此外,流式细胞术结果显示甲基乙二醛能够诱导成骨细胞凋亡。TUNEL染色是对完整的单个凋亡细胞核或凋亡小体进行原位染色,能准确地反应细胞凋亡,本实验条件下,甲基乙二醛组TUNEL染色细胞阳性率明显高于对照组,说明细胞凋亡增加,与既往实验相符。Western blot结果示线粒体凋亡级联反应中的关键蛋白Bcl-2/Bax比率下降,一般认为抗凋亡蛋白Bcl-2和促凋亡蛋白Bax相互作用并抑制Bax的促凋亡作用,而Bcl-2/Bax比率下降说明Bax蛋白功能占优势,从而发挥促凋亡作用,进一步验证了凋亡结果。而槲皮素干预后显著恢复了甲基乙二醛抑制的成骨细胞增殖活性,同时减少了细胞凋亡,说明其对成骨细胞有很好的保护作用。
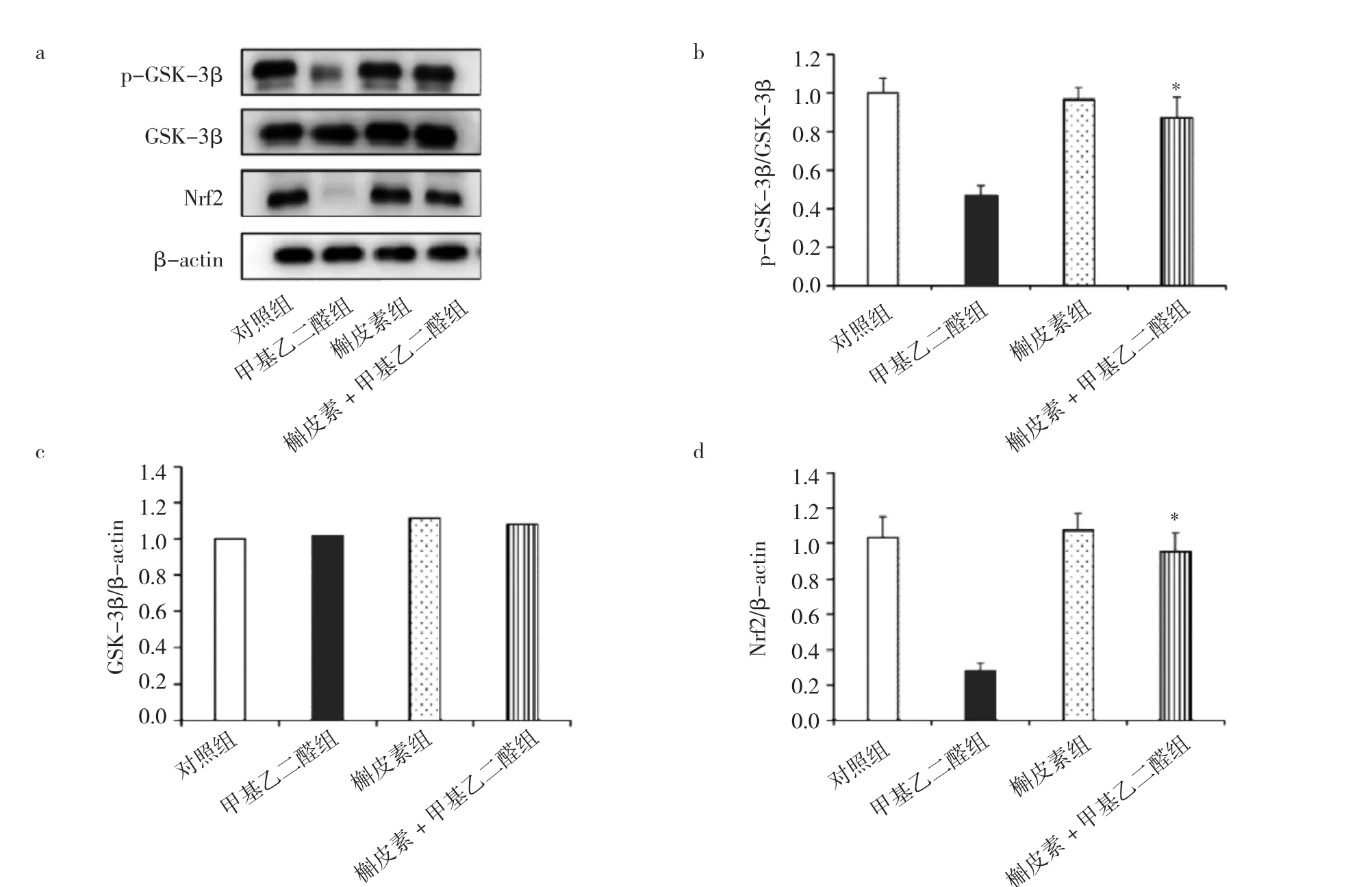
图7 槲皮素+甲基乙二醛组、槲皮素组、甲基乙二醛组、对照组细胞糖原合成酶激酶3β(GSK-3β)/转录因子E2相关因子2(Nrf2)信号通路相关蛋白表达水平比较(与甲基乙二醛组比较,*P<0.05;a:蛋白电泳图;b:p-GSK-3β表达水平比较;c:GSK-3β表达水平比较;d:Nrf2表达水平比较)
为了进一步揭示槲皮素的作用机制,本研究探讨了GSK-3β/Nrf2信号通路在其中的作用。GSK-3β是一种丝氨酸/苏氨酸激酶,能通过降解β连环蛋白从而阻断Wnt通路,影响成骨细胞增殖分化。此外,GSK-3β能调控线粒体膜通道的开放,当其Ser9位点磷酸化后线粒体膜通道开放抑制,减少了线粒体膜通透性,减少细胞色素C的释放,抑制Caspase-3/9活性,从而抑制线粒体凋亡途径,减少细胞凋亡[16]。Nrf2是重要的内源性抗氧化调节因子,当细胞受到氧化应激损伤时,细胞质中Nrf2转移入细胞核,调控大量有抗氧化作用基因表达。研究证实GSK-3β激活后负向调控Nrf2,影响细胞的氧化还原状态,抑制Nrf2的保护作用[17]。Zhang等[18]发现丹酚酸A能通过GSK-3β/Nrf2信号通路抗氧化应激保护肾脏。此外,激活GSK-3β/Nrf2信号通路被证实能缓解糖尿病病理状态下的心肌病[19]以及促进肢体缺血中的血管生成[20]。本研究中甲基乙二醛在诱导成骨细胞凋亡的过程中GSK-3β的Ser9位点磷酸化降低,Nrf2蛋白水平降低,GSK-3β/Nrf2信号通路被抑制。而槲皮素干预后GSK-3β磷酸化水平以及Nrf2蛋白表达水平上升,说明槲皮素对成骨细胞的保护作用可能是通过GSK-3β/Nrf2信号通路来介导的。
综上所述,本研究结果显示,GSK-3β/Nrf2信号通路参与了甲基乙二醛诱导的成骨细胞凋亡,而槲皮素对成骨细胞凋亡的保护作用可能依赖于该通路。但本研究为单纯体外实验,需进一步研究证实,从而为临床应用提供理论基础。

