茶树氮吸收效率的早期鉴定技术研究
苏静静,阮丽,王丽鸳,韦康,吴立赟,白培贤,成浩*
茶树氮吸收效率的早期鉴定技术研究
苏静静1,2,阮丽1,王丽鸳1,韦康1,吴立赟1,白培贤1,2,成浩1*
1. 中国农业科学院茶叶研究所/国家茶树改良中心/农业部茶树生物学与资源利用重点实验室,浙江 杭州 310008;2. 中国农业科学院研究生院,北京 100081
氮是植物生长的重要营养元素,在茶树栽培过程中常需施用大量氮肥,不仅消耗大量的资源,施用不当还会造成一系列环境问题。培育氮肥高效利用的茶树品种是解决这一问题的重要途径,而建立快速筛选高效株系的早期鉴定方法对于缩短育种茶树育种年限具有重要意义。本研究分析龙井43(LJ43)和中茶108(ZC108)两个茶树品种在不同氮素水平下对氨态氮和硝态氮的吸收与利用数据,通过与15N同位素标记技术的比对,验证非损伤微测技术(NMT)和实时荧光定量(qRT-PCR)技术在早期鉴定茶树株系氮素吸收利用能力方面的可行性与实用性,以期建立茶树氮吸收效率的室内早期鉴定技术。试验结果表明,15N同位素标记技术的稳定性和可重复性分别为89.51%、99.26%,而NMT的稳定性、可重复性分别为95.22%、96.76%;两种方法测定结果均显示茶树具有明显的喜铵特性;硝酸根转运蛋白基因和在两个品种中均表现出诱导上调表达效应,相比中茶108,龙井43中和具有更高的表达量,表明LJ43对外界氮源的响应高于ZC108。综上所述,认为NMT技术可在短时间内处理并测得茶树的瞬时吸收速率,且试验材料损耗少,可以用于茶树氮瞬时吸收速率的早期鉴定;和的表达量一定程度上反映了茶树对硝态氮吸收的能力。本研究可为氮高效茶树品种的早期鉴定技术建立提供依据。
茶树;氮吸收速率;非损伤微测技术;15N同位素示踪;实时荧光定量
氮素作为植物所需的重要营养元素之一,对植物的生长发育及其产量和品质等性状均有显著影响[1]。随着经济水平的发展和茶产业链的延伸,人们对于各类茶叶产品的需求量日益增多,但限于茶园种植面积已达饱和,增加单位面积产量是提高经济效益的有效途径[2]。茶树[(L.) O. Kuntze]是多年生叶用经济作物,在生产过程中对氮素的需求量较高。增施氮肥对茶树生长和产量具有积极作用,但随着氮肥施用量逐年增加,茶园氮素利用效率明显下降。盲目地增施氮肥还会导致产品品质降低,病虫害风险增加,以及环境污染等一系列问题[3-5]。因此,如何提高茶树氮吸收效率,减少无效施用,在保质保量的前提下,降低环境成本,成为茶学科研工作者的重大挑战[6],而培育高氮效率的茶树新品种是解决这些问题的最直接途径。但茶树作为多年生作物,育种年限长,因此,开发快速有效的氮吸收早期鉴定技术对于缩短育种年限具有重要意义。
不同植物之间广泛存在氮吸收效率的差异,同一植物的不同品种间也均存在氮效率的差异[7]。目前,氮吸收效率差异的相关研究已经在小麦[7-10]、玉米[11-13]、水稻[14-15]、橡胶[16]和烟草[17]等多种植物上广泛开展。已有研究表明,茶树不同品种之间也存在明显的氮吸收效率的差异。刘圆[18]对茶园中10个主栽茶树品种从吸收动力学角度进行研究,发现不同基因型茶树品种间NH4+-N吸收动力学参数存在明显差异。王新超等[19]试验证明不同品种茶树之间氮吸收效率存在着明显的差异,并对选育高氮素利用效率茶树品种的指标进行了初步筛选。但总体而言,茶树在氮吸收效率测定方面还未形成统一标准。
15N同位素示踪技术因其无辐射、物理性质稳定且准确性较高等优点而广泛应用于农业科学研究中,包括改良品种、生物固氮、氮肥效率及作物营养代谢等[20-21],是测定作物氮吸收效率较为常用的方法。近年来,对茶树NH4+和NO3-吸收和利用的相关研究主要是利用15N同位素示踪法[22-23]。但15N同位素示踪技术试剂购买和样品检测价格昂贵,且制样时需冷冻干燥以固定目标时间点样品内的同位素标记,因此仅可测定样本某一特定时间点的氮素积累量。茶树对氮素的吸收是一个动态过程,使用15N标记无法阐明NH4+和NO3-通量的动态过程[24]。近几年,非损伤微测技术(NMT)因其具有对待测离子或分子进行实时、动态测定的特点,成为测定氮吸收的重要工具。NMT技术保证了生物样品的完整性和生理活性,这对测定一些珍贵种质资源的样品具有重要意义,同时,该技术具有高分辨度和高灵敏度,保证了试验的准确性[25-26]。随着人们对茶树氮代谢生理生化和分子机制的不断研究,许多与茶树氮代谢相关的基因被鉴定和克隆出来,但从分子生物学途径筛选和评价茶树品种吸收机制差异的研究较少[27]。因此可通过研究氮素吸收过程中相关基因的表达,在分子水平上为植物氮吸收高效品种早期筛选提供理论依据。实时荧光定量PCR(Real time fluorescence quantitative PCR,qRT-PCR)是指在PCR扩增过程中,利用荧光信号积累实现实时监测,并通过外参或内参基因对待测样品种的特定DNA序列进行定量分析的方法[28]。qRT-PCR与传统PCR相比有诸多优点,不仅实现了从定性到定量的飞跃,还具有特异性好、灵敏度高、重现性好、速度快等特点,成为分析生物学中基因表达的重要工具[29-30]。
龙井43(LJ43)作为广泛种植茶树品种,具有对氮肥响应度高的特性,现有研究结果显示,LJ43在缺氮、中氮和高氮处理下,两年生盆栽苗每盆生物量分别为4.75、8.42、10.22 g,即施用氮肥就快速生长,不施氮肥则生长受抑制[31]。中茶108(ZC108)是LJ43通过人工辐照变异而来的品种,具有耐氮贫瘠的特性[32]。因此,本文选取LJ43和ZC108作为研究对象,通过与15N同位素标记技术的比对,验证NMT和qRT-PCR技术在鉴别不同茶树株系、品系和品种氮吸收效率高低和建立茶树株系氮吸收能力早期鉴定技术方面的可行性和适用性。
1 材料与方法
1.1 试验材料及预处理
以LJ43、ZC108、白毫早(BHZ)、乌牛早(WNZ)、1712、1417、中茗6号(ZM6)、中茗7号(ZM7)、2807等品种(系)的一年生扦插苗为供试材料;挑选长势一致的茶苗,转移至中国农业科学院茶叶研究所温室进行水培。
前期试验结果表明[34],茶苗在缺氮处理两周后即达到氮饥饿状态。根据本试验茶苗的生长状态,为增强氮饥饿效果,尽可能消除试验材料原始状态对试验的影响,在样品长出白色嫩根后进行了3周的氮饥饿预处理,即在上述完全营养液配方中去除氮元素,其他元素保持不变,进行通氧培养,营养液每周更换1次。
1.2 试验仪器及试剂
试验仪器:球型研磨机(TissueLyser Ⅱ,QIAGEN®),C/N元素分析仪(Thermo NE1112),同位素质谱分析仪(Thermo finnigen Delta Plus AD),NMT营养研究工作站(NMT-NRP-00A00),LightCycler®480 Ⅱ。
主要试验试剂:茶树植物营养液定制干粉(Coolaber),15NH4NO3和NH415NO3(阿拉丁生物科技有限公司,上海),RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司,北京),FastQuant RT Kit试剂盒(天根生化科技有限公司,北京)。
1.3 15N同位素示踪技术试验
采用丰度为99%的15NH4NO3和NH415NO3,针对氨态氮和硝态氮分别配置不同氮素浓度的氮标记培养基系列,结合杨亦扬[35]和王新超等[19]设置的试验参数,本研究选取0.05、0.2、0.5、2、5 mmol·L-1等5个氮素浓度梯度作为试验处理。培养基其他元素的配方同1.1章节。挑选长势一致,进行过氮素饥饿处理的供试茶苗,转移至含140 mL培养液的覆黑膜广口瓶中培养。每瓶放置1株茶苗,每个处理设置3个重复。培养24 h后[18],将茶苗取出,用纯净水涮洗3次。每株地上部和地下部分开收集,冷冻干燥后称重,并于球型研磨机(TissueLyser Ⅱ,QIAGEN®)中进行粉碎处理,待测。
15N样品和大气的千分差(δ15N)以及全氮含量(TN)测定使用C/N元素分析仪(Thermo NE1112),经连续流接口装置(Confio Ⅲ)与同位素质谱分析仪(Thermo Finnigen Delta Plus AD)连接,用IAEA-N-1标准物质对实验室钢瓶N2气进行标定,氮同位素以大气氮为参考标准。
1.4 NMT试验
分别配置不同氮素浓度的测试液系列,各处理的氮素终浓度分别为0.05、0.2、0.5、2、5 mmol·L-1,测试液其他成分参照文献[24]。挑选根系生长情况相近,氮饥饿处理后的供试茶苗,选择新生嫩根,从距离根尖3~4 cm处迅速剪下,用滤纸条和玻璃块将其固定在培养皿底部,置于测试液中平衡5 min,选择根系成熟区距离根尖15~25 mm处(根表面光滑完整且没有破损的点位)进行吸收速率的测定(图1),采样规格为X-30[24]。利用NMT营养研究工作站(NMT-NRP-00A00)的扫描离子选择微电极技术测定NH4+和NO3-离子的近根表面端和远根表面端两点间的电压差,利用校正得到的能斯特斜率和能斯特截距换算成两点之间的离子浓度差,得出吸收/外排速率。每个处理测定7条根系,每条根系测试10 min。
1.5 qRT-PCR试验
分别配置不同氮素浓度的氮培养基系列,各处理的氮素终浓度分别为0.05、0.2、0.5、2、5 mmol·L-1,培养液其他元素的配方同1.2章节。挑选长势一致,进行过氮素饥饿处理的供试茶苗,转移至含140 mL培养液的覆黑膜广口瓶中培养,每瓶放置1株茶苗,每个处理设置3个重复。培养24 h后,将茶苗取出,用纯净水涮洗3次。取茶树根系于液氮中保存。
1.打好“人才牌”,提升支持力。要发展就必须打好“人才牌”,增强竞争力。要全力提升培训水平,在传统培训方式之外,着力抓好“网络课堂、班组课堂、现场课堂”这三个载体,合理配置资源,提高培训质量和管理水平,努力开创“大培训”工作格局。加快现有人才队伍建设。树立“有能有为、人人是才”的人才理念和“培训就是企业最好的福利”的观念,培育激励机制,制定积极的激励措施,大力创造有利于优秀人才脱颖而出、施展抱负、发挥才干的环境,使每个人都能够为企业发展建功立业。
取液氮保存的试验材料,于研钵中加液氮迅速充分研磨至粉末状,用于RNA提取。用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司,北京)提取茶树根的RNA。之后使用FastQuant RT Kit(天根生化科技有限公司,北京)将获得的RNA反转录为cDNA,用于qRT-PCR试验,所用引物见表1[34]。基因表达水平标准化的参考为GAPDH,以LJ43和ZC108的根部组织cDNA作为模板,采用LightCycler®480 Ⅱ进行qRT-PCR扩增。扩增程序为:94℃ 10 s;58℃ 5 s,72℃ 12 s,45个循环。每个样品设置3个技术重复。

图1 非损伤微测技术测定LJ43根部NO3-流速的电镜图

表1 qRT-PCR荧光定量引物序列的信息
1.6 氮吸收效率计算公式及数据处理
根据15N在样品中和大气中的千分差(δ15N)计算样品中15N原子丰度,如公式(1)[35],再根据公式(2)计算出氮吸收效率,公式如下:
=(δN×0.366 3%)/100 0+0.366 3%································(1)
=××总重/(根××15)································(2)
其中,表示样品中15N的原子丰度0.366 3%为大气标准15N原子丰度。(%)指样品中全氮含量;总重(g)指样品的总干重;根(g)指样品中根的干重;(h)指吸收时间,表示氮吸收效率。
15N数据使用Origin 9进行数据分析,进行非线性米氏方程的拟合:=max×/(m+),其中,离子吸收速率用(μmol·g-1·d-1)表示,最大吸收速率为max(μmol·g-1·d-1),(mmol·L-1)指底物氮浓度,该方程中max、m和(maxm)可用来定量描述根系对养分离子的吸收特性。max表示茶树对氮离子吸收所能达到的最大吸收速率,max越大,则茶树对氮离子吸收的内在潜力越大;m为米氏常数;表征低浓度下离子的吸收亲和性[36]。15N试验技术方法学的评价指标如下:(1)可重复性是指在相同测量条件下,对同一被测量样品进行连续多次测量所得结果之间的一致性。本研究通过测定每个样品的3次技术重复获得可重复性;(2)稳定性是指测量仪器的计量特性随时间不变化的能力,可以进行定量的表征。可通过测定2批不同时间段的样品,评价其测量的稳定性。
离子流测定数据利用IBM SPSS Statistics 22软件对数据进行标准化,去除异常值。使用Origin 9软件进行数据分析。NMT技术的方法学评价指标定义如下:(1)本研究通过测定对1个位点测定3次所获得的流速值获得NMT技术的可重复性值;(2)通过测定3 min内所有流速值的变异系数获得NMT技术的稳定性值。

2 结果与分析
2.1 茶树根系对不同浓度氮素的吸收速率测定
采用15N同位素示踪技术,测定了9个茶树品种对NH4+和NO3-的吸收速率(图2)。在0.05~5 mmol·L-1的氮素梯度下,所有品种对NH4+的吸收速率均大于NO3-。低浓度(0.05~0.5 mmol·L-1)时,ZC108和WNZ对NH4+的吸收速率较快,ZM7的吸收速率最慢。高氮(2~5 mmol·L-1)处理时,LJ43和ZM6对NH4+的吸收速率较快,ZM7和1417吸收速率较慢。低氮(0.05~0.5 mmol·L-1)处理时,2807和ZM7对NO3-的亲和力较强;高浓度(2~5 mmol·L-1)时,1417对NO3-的吸收速率最低,ZM6对NO3-的吸收显著优于其他品种。各品种在低氮和高氮条件下的氮吸收能力排名是完全不同的。其中LJ43和ZC108对NH4+和NO3-的吸收速率与吸收动力学参数表如图2所示。样品对0.05~5 mmol·L-1梯度的氮素吸收,均表现出NH4+的吸收速率大于NO3-。低浓度(0.05~0.5 mmol·L-1)时,ZC108对NH4+吸收速率大于LJ43,且ZC108(3.535)的值高于LJ43(0.484),表明ZC108在低氮浓度培养液处理时对NH4+的亲和力较强;高浓度(2~5mmol·L-1)时,LJ43对NH4+吸收速率大于ZC108,同时LJ43(308.722)的max高于ZC108(191.278),且氮素浓度为5 mmol·L-1时仍未达到饱和,表明LJ43在高氮浓度培养液处理时对NH4+的吸收潜力较大;LJ43和ZC108对NO3-的吸收规律相近,总体表现为LJ43优于ZC108。LJ43(68.573)的max略高于ZC108(63.937),表明其在高氮浓度培养液下对NO3-的吸收潜力较大。两品种的值几乎没有差异。
利用15N同位素示踪的方法来测定植物对氮素的吸收与利用,在包括茶树等诸多植物上已有广泛的研究,方法相对成熟。因此,本研究仅随机选取0.5 mmol·L-115NH4NO4处理下的LJ43作为样本,进行了稳定性以及可重复性分析(图3)。15N同位素示踪技术的可重复性达到99.28%,稳定性为89.51%,均高于85%,表明本研究采用15N同位素示踪技术测定茶树根系氮吸收效率的方法切实有效。
2.2 茶树根系表面氮离子的流动和吸收速率测定
茶树氮离子流速指的是根系离子内外交换过程中氮离子的运动速度,可以直观的反映茶树根系表面氮离子的流动方向和流动速率。在本试验的浓度梯度下,LJ43和ZC108的根系表面氮离子的流动方向为内流,即样品均表现出吸收氮离子的状态。
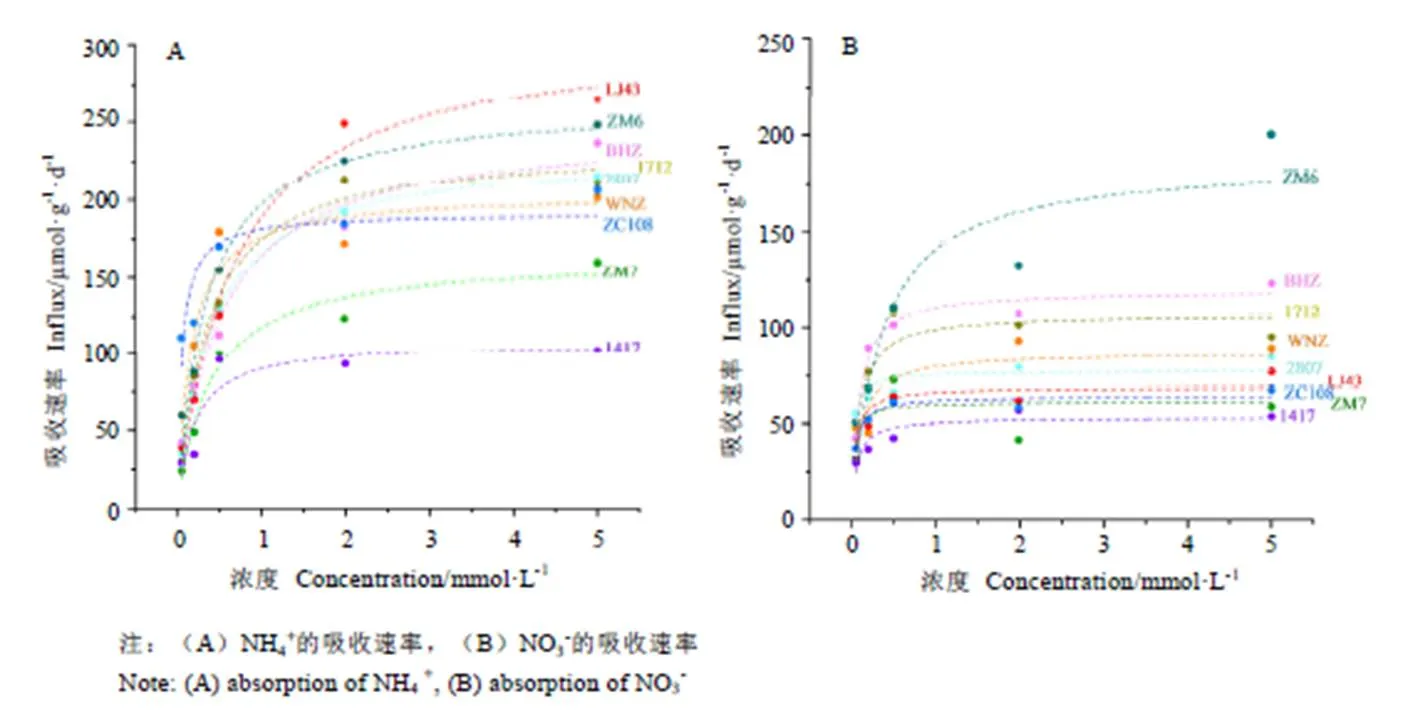
图2 15N同位素标记测定9个茶树品种的吸收速率差异
Fig. 215N isotopic labeling for detecting the absorption rates in 9 tea cultivars
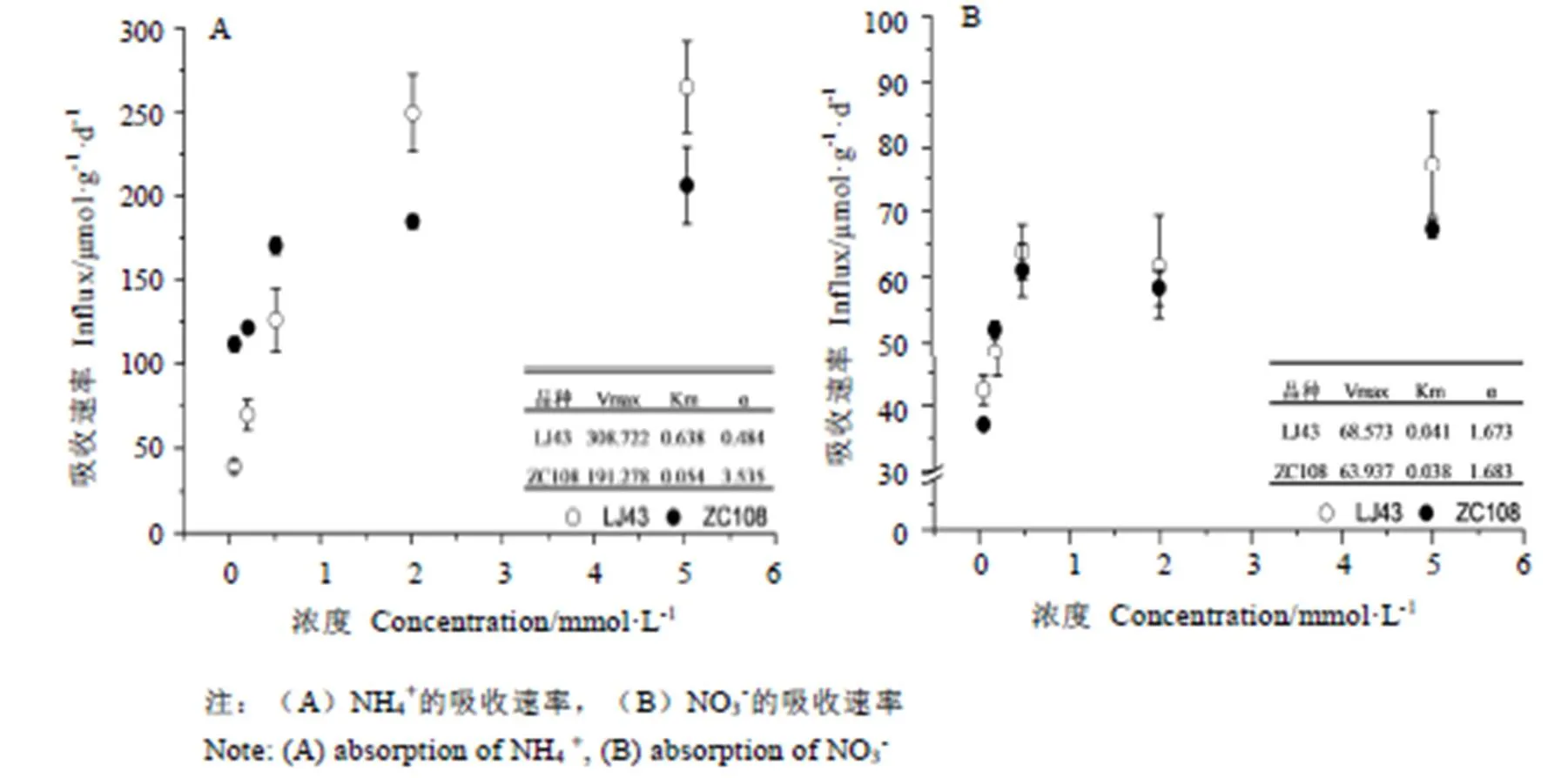
图3 基于15N同位素示踪法检测样品根系对不同浓度氮素的吸收速率差异
两茶树品种的根系氮离子流速存在明显差异(图4)。样品在0.05~5 mmol·L-1浓度内的氮素吸收,均表现出对NH4+的偏好性。NH4+的吸收速率与培养液中NH4+浓度呈极显著正相关(<0.01)。在0.05~5 mmol·L-1浓度下,随氮浓度增加,LJ43对NH4+的吸收速率(均值)从221.397 pmol·cm-2·s-1增加至4 695.899 pmol·cm-2·s-1。ZC108对NH4+的吸收速率(均值)从48.039 pmol·cm-2·s-1增加至2 958.835 pmol·cm-2·s-1。LJ43对NH4+的吸收速率始终高于ZC108;LJ43对NO3-的吸收速率(均值)从62.905 pmol·cm-2·s-1增加至1 598.946 pmol·cm-2·s-1,ZC108对NO3-的吸收速率(均值)从35.799 pmol·cm-2·s-1增加至2 341.659 pmol·cm-2·s-1。NO3-的吸收速率与培养液中NO3-浓度也呈显著正相关(<0.05)。在低浓度(0.05~0.5 mmol·L-1)氮处理下,LJ43对NO3-的吸收速率高于LJ43,在高浓度(2~5 mmol·L-1)下,ZC108和LJ43对NO3-的吸收速率出现与低浓度相反的趋势,ZC108对NO3-的吸收速率超过LJ43。
基于NMT技术对LJ43和ZC108的吸收速率结果,进一步进行方法学分析。可重复性和稳定性数值如表2所示。样品吸收NH4+所测的数据点稳定性和可重复性分别为87.12%~98.91%和94.19%~99.76%,均值分别为96.26%和96.72%。样品吸收NO3-所测的数据点的稳定性和可重复性分别在95.07%~99.36%和93.19%~99.17%,均值为分别为97.26%和96.59%。综上,NMT技术的稳定性与可重复性分别为95.22%和96.76%。可见,在不同氮形态、不同品种和不同浓度梯度的条件下,采用NMT技术测定茶树根系氮素吸收的方法可重复性和稳定性均较高。
2.3 茶树中氮素相关基因的表达
采用qRT-PCR技术,分析了在不同氮素浓度下,3个茶树氮素吸收相关基因(,和)在LJ43和ZC108根部的表达水平(图5)。结果表明,3个基因在不同氮浓度下均有表达。而同一品种不同氮浓度下和的表达量变化趋势相同,但品种间在不同氮浓度下和基因表达量的变化趋势存在差异。铵根转运蛋白基因在两个品种根部的表达量差异不显著,表达无明显规律,表明该基因对氨态氮吸收的响应不明显。
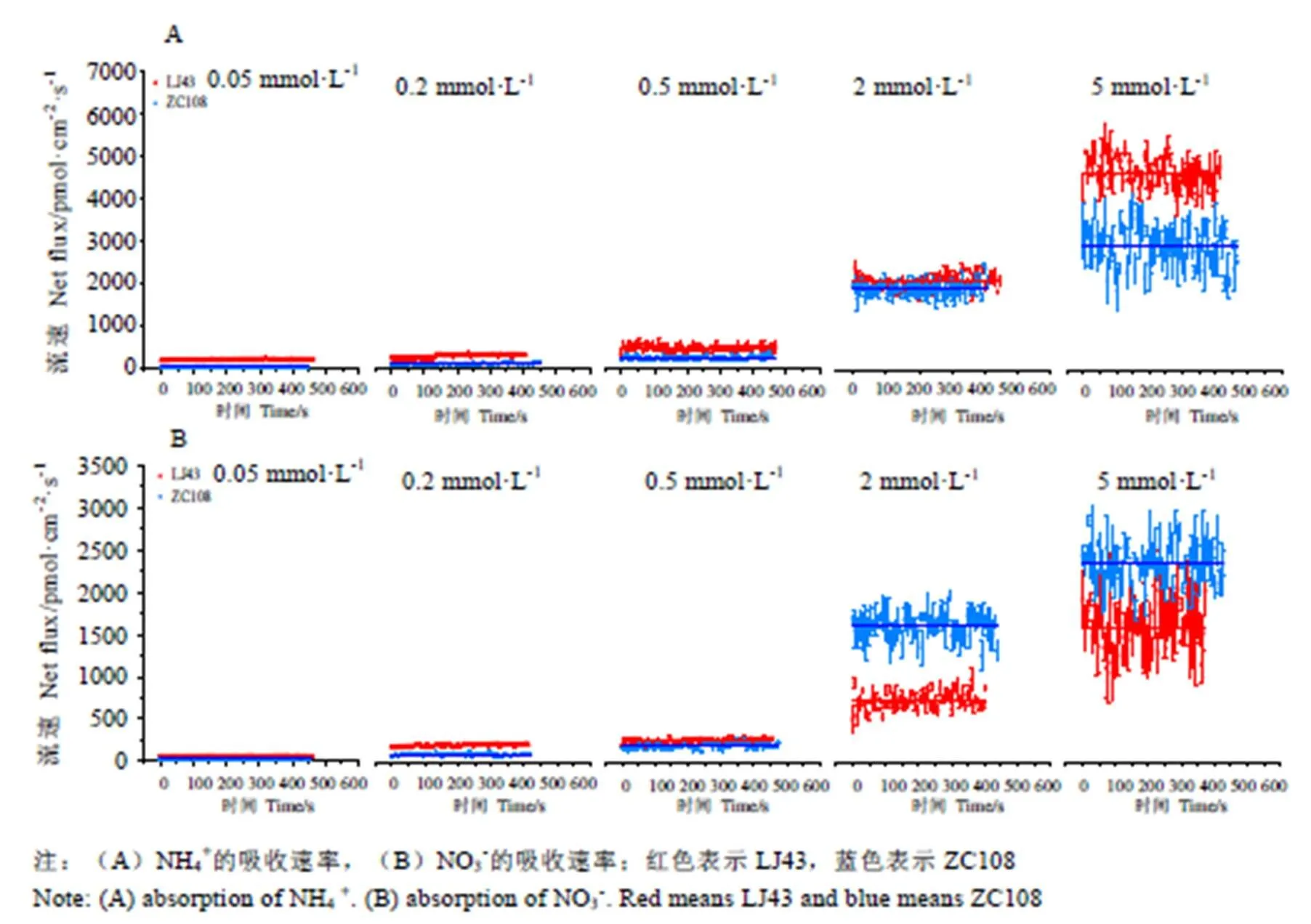
图4 NMT测定LJ43和ZC108在不同氮素梯度处理下的氮吸收速率差异
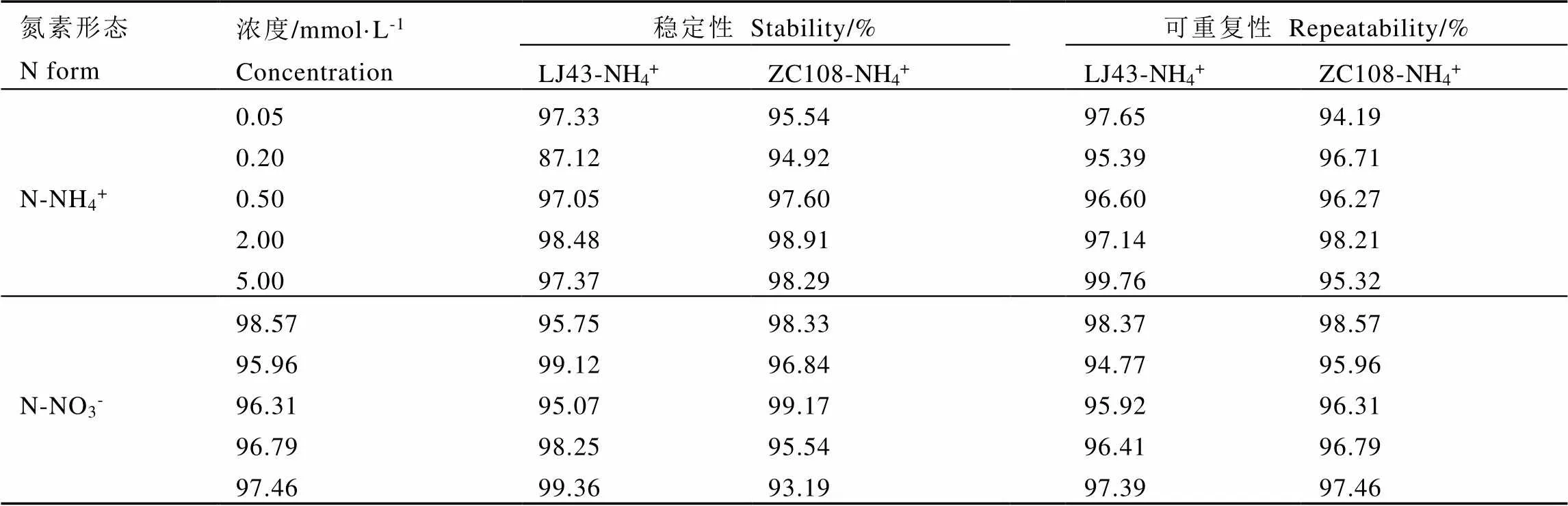
表2 NMT方法学参数比较

图5 LJ43和ZC108根中 CsNRT2.4、CsNRT3.2和CsAMT1.2在不同氮素浓度处理下的表达量
茶苗经过24 h氮素处理后,相比于基因,在两个品种中表现出更强的诱导上调表达效应。在2 mmol·L-1浓度下,在LJ43根中的表达量是0.05 mmol·L-1浓度下的252倍,而的表达量仅增加了3.4倍;当供应5 mmol·L-1的NO3-时,在ZC108根中的表达量是0.05 mmol·L-1浓度下的66倍,而的表达量仅增加了2.7倍。这可能暗示着在茶树对硝态氮的吸收过程中,起着主导作用。硝酸根转运蛋白基因和在LJ43中的表达量高于在ZC108中的表达量,表明LJ43在基因的转录水平对硝态氮吸收的响应更强。
3 讨论
本研究中15N和NMT技术测定的都是茶树根系对氮素的吸收。但15N测定的是24 h的吸收状态,而无机氮进入植物体内,要经过一系列生化反应转化为有机态氮,参与生命活动,在24 h的吸收中,氮素同化也在进行,对氮素代谢产生一定反馈作用,从而影响其氮素吸收效率[19]。在水稻、玉米、小麦等作物的研究中,均有证明在植株生长过程中存在氮的损失,且推测损失途径可能是有叶片释放气体氮化物造成[37-39]。因此15N测定更偏向的是植物24 h后氮素积累的结果。而NMT测定的仅是瞬时吸收的速率。这可能是两种方法测定的结果存在些许差异的原因。
在高氮处理下,LJ43对NH4+的瞬时吸收速率和24 h氮积累量均高于ZC108,而在低氮胁迫下,LJ43的瞬时吸收速率高于ZC108,但24 h氮积累量略低于ZC108。推测可能是LJ43对氮的响应度高于ZC108,对NH4+更为敏感,在氮饥饿处理后回补氮素,瞬时吸收速率较高,但在长期低氮条件下,对于氮素的利用效率低于ZC108,表现为氮素积累量略低于ZC108。刘圆[18]在分析茶树品种ZC108和LJ43的NH4+动力学吸收规律与本试验结果相同,但其并未对NO3-进行分析。
本研究中,茶树对于NH4+的瞬时吸收速率和24 h氮积累量均高于NO3-,验证了茶树具有较强的喜铵特性,同时也证明两种方法在测定植物的氮吸收效率方面是可行的。对高等植物而言,NH4+和NO3-均为可利用的良好氮源。根据植物本身对2种不同形态氮素的喜好程度以及利用原理,可将植物分为喜铵植物和喜硝植物[40]。高浓度的铵态氮对包括木本植物在内的大多数植物具有毒害作用,但高浓度的NH4+在本研究中并没有影响茶树的吸收,说明茶树具有较强的吸收NH4+的能力。邹春琴等[41]研究发现,与NO3-处理相比,NH4+处理下向日葵叶中K、Ca、Mg的浓度明显降低,而且向日葵生物量会受到严重抑制。但在Ruan等[33]的研究中,在NH4+处理下,茶树成熟叶和根中的GS酶活性及叶绿素含量均显著提高。茶树的喜铵特性可能是对栽培条件的长期适应所形成的;可能是由于茶树对铵态氮具有较高的吸收和同化能力,也可能和铵态氮同化的关键酶及基因有关[42-43]。
、和是课题组前期利用基因共表达网络筛选出的核心基因[44],主要参与茶树根系硝态氮和氨态氮的转运。本研究发现,LJ43的和表达量均高于ZC108,表明在分子层面上,LJ43对外界氮源的响应高于ZC108,进一步说明LJ43对氮的敏感性高于ZC108。和在两个品种中均表现为随氮浓度增加诱导上调表达效应,表明和的表达量一定程度上可以反应茶树硝态氮吸收的能力。基因的表达水平与植物表型虽有关联,但并非绝对的对应关系。植物吸收土壤中的NO3-主要是在各种特定的根部转运蛋白协同作用下完成的,只有不同的转运蛋白相互作用才能够使根有效的吸收利用氮源,单一基因的表达并不能全面的反映植物对氮素的吸收规律[45],CsNRT2.4和CsNRT3.2均为高亲和硝酸根转运蛋白[34],在低浓度下对NO3-的响应度更高,高浓度时推测是其他低亲和硝酸根转运蛋白在发挥主要作用,因此基因表达的规律与植物表型有可能存在一定偏差。在LJ43和ZC108根部的表达量均未呈现出特定规律,可能是取样时间会影响其表达[34],在茶树根部的表达量是否能够反映其对铵态氮吸收的能力还需要进一步验证。
在研究茶树氮素的吸收与利用方面,15N同位素示踪技术是常用且比较精确的方法[23, 46]。而NMT技术在茶树氮素上的应用相关文献较少,且未进行方法学验证。本试验尝试对应用该技术研究茶树氮素吸收的效果进行方法学验证,结果显示NMT技术的稳定性高于15N技术,但重复性略低。NMT技术测定的是根系短时间内对营养物质的吸收能力,而15N技术主要测定植株整体或部分器官对于营养物质一定时间内的积累,因此处理时间的长短可能是导致NMT技术稳定性较15N技术高的因素。NMT技术的可重复性稍低,推测是因为二者的测定对象不同导致的。15N测定选用的是冷冻干燥后的无活性粉末,所以同一处理的反复观测值间会更接近,而NMT是活体检测,在测试根系处于动态平衡的状态,因此15N的可重复性较NMT略高,但NMT技术测定数据点的可重复性也可达90%以上,且具有保留待测植株活性的优势。总体而言,两种方法的可重复性和稳定性均超过85%,表明两种方法均适用于茶树营养代谢相关的研究,且各有侧重,NMT可以测量短时间处理下的瞬时吸收速率,使用的试验材料少,更适合茶树氮吸收效率的早期鉴定。
茶树作为多年生作物,育种年限长,开发快速有效的早期鉴定技术对于缩短育种年限具有重要意义。本研究中,NMT技术的可重复性、稳定性均较高,且可保证供试茶苗的完整性和生理活性,初步认为其可以用于茶树氮瞬时吸收速率的早期鉴定;和的表达量一定程度上可以反应茶树对硝态氮吸收的能力。此外,NMT技术在茶树氮吸收速率测定方面的应用推广还需要后续更多品种鉴定数据支持。本研究可为氮高效茶树品种的室内早期鉴定技术建立提供了依据。
[1] Raven J A, Handley L L, Andrews M. Global aspects of C/N interactions determining plant-environment interactions [J]. Journal of Experimental Botany, 2004, 55(394): 11-26.
[2] 欧立军, 康林玉, 赵激, 等. 作物氮素吸收与利用研究进展[J]. 北方园艺, 2018, 7: 151-156. Ou L J, Kang L Y, Zhao J,et al.Research progress in nitrogen uptake and utilization of crops [J]. Northern Horticulture, 2018, 7: 151-156.
[3] Singh B, Singh Y, Sekhon G S. Fertilizer-N use efficiency and nitrate pollution of groundwater in developing countries [J]. Journal of Contaminant Hydrology, 1995, 20: 167-184.
[4] 马立锋, 陈红金, 单英杰, 等. 浙江省绿茶主产区茶园施肥现状及建议[J]. 茶叶科学, 2013, 33 (1): 74-84. Ma L F, Cheng H J, Shan Y J,et al. Status and suggestions of tea garden fertilization on main green tea-producing counties in Zhejiang Province [J].Journal of Tea Science, 2013, 33(1): 74-84.
[5] 韩文炎, 李鑫, 颜鹏, 等. 生态茶园的概念与关键建设技术[J]. 中国茶叶, 2018, 40(1): 10-14. Han W Y, Li X, Yan P, et al. Concept and key construction technology of ecological tea garden [J]. China Tea, 2018, 40 (1): 10-14.
[6] 阮建云. 中国茶树栽培40年[J]. 中国茶叶, 2019, 41(7): 1-11, 42. Ruan J Y. 40 years of tea cultivation in China [J]. China Tea, 2019, 47(7): 1-11, 42.
[7] 严小龙, 张福锁. 植物营养遗传学[M]. 北京: 中国农业出版社, 1997: 22-32. Yan X L, Zhang F S.Plant nutrition genetics [M]. Beijing:China Agricultural Press, 1997: 22-32.
[8] 李祥剑. 不同小麦品种氮素(肥)效率差异、评价及分类[D]. 郑州: 河南农业大学, 2010. Li X J. Difference, Evaluation and classification of nitrogen (fertilizer) efficiency in different wheat varieties [D]. Zhengzhou: Henan Agricultural University, 2010.
[9] 李淑文, 文宏达, 周彦珍, 等. 不同氮效率小麦品种氮素吸收和物质生产特性[J]. 中国农业科学, 2006, 39(10): 1992-2000. Li S W, Wen H D, Zhou Y Z. Characterization of nitrogen uptake and dry matter production in wheat varieties with different N efficiency [J].Scientia Agricultura Sinica, 2016, 39(10): 1992-2000.
[10] 韩胜芳, 李淑文, 吴立强, 等. 不同小麦品种氮效率与氮吸收对氮素供应的响应及生理机制[J]. 应用生态学报, 2007, 18(4): 807-812. Han S F, Li S W, Wu L Q,et al.Responses and corresponding physiological mechanisms of different wheat varieties in their nitrogen efficiency and nitrogen uptake to nitrogen supply [J]. Chinese Journal of Applied Ecology, 2017, 18(4): 807-812.
[11] Scharf P C, Kitchen N R, Sudduth K A, et al. Spatially variable corn yield is a weak predictor of optimal nitrogen rate [J]. Soil Science Society of America Journal, 2007, 70(6): 2154-2160.
[12] Li H C, Li L, Thilo W, et al. Effect of N supply on stalk quality in maize hybrids [J]. Field Crops Research, 2010, 118: 208-214.
[13] 申丽霞, 王璞. 不同基因型玉米氮素吸收利用效率研究进展[J]. 玉米科学, 2016, 24(1): 50-55. Shen L X, Wang P. Research progress of nitrogen absorption and utilization efficiency of different maize genotypes [J]. Journal of Maize Sciences, 2016, 24(1): 50-55.
[14] Jiang L G, Cao W X. Physiological mechanism and approaches for efficient nitrogen utilization in rice [J]. Chinese Journal of Rice Science, 2002, 16(3): 261-266.
[15] 张晓果, 王丹英,计成林, 等. 水稻氮素吸收利用研究进展[J]. 中国稻米, 2015, 21(5): 13-19. Zhang X G, Wang D Y, Ji C L, et al.Nitrogen absorption and utilization on rice [J]. China Rice, 2015, 21(5): 13-19.
[16] 杨丽萍, 陈永川, 许木果, 等. 不同供氮水平不同供氮水平橡胶树幼苗氮素利用及来源特征[J]. 广东农业科学, 2017, 44(11): 75-79. Yang L P, Chen Y C, Xu M G, et al. Characteristics of nitrogen utilization and source ofunder different nitrogen levels [J]. Guangdong Agricultural Sciences,2017, 44(11): 75-79.
[17] 梁景霞, 梁康迳, 祁建民, 等.烟草不同基因型耐低氮能力差异评价[J]. 植物遗传资源学报, 2007, 8(4): 451-455. Liang J X, Liang K J, Qi J M, et al. Evaluation of low nitrogen tolerance for different tobacco varieties [J]. Journal of Plant Genetic Resources,2007, 8(4): 451-455.
[18] 刘圆. 不同氮效率茶树品种氮素吸收利用相关基因表达模式探究[D]. 北京: 中国农业科学院, 2016. Liu Y. Study on the gene expression patterns of nitrogen uptake and utilization in tea plants with different nitrogen efficiency [D]. Beijing: Chinese Academy of Agricultural Sciences, 2016.
[19] 王新超, 杨亚军, 陈亮, 等. 茶树氮素利用效率相关生理生化指标初探[J]. 作物学报, 2005, 31(7): 926-931. Wang X C, Yang Y J, Chen L, et al. Preliminary study on physiological and biochemical indices related to nitrogen use efficiency in tea plant [J].Acta Agronomica Sinica, 2005, 31(7): 926-931.
[20] 李建辉. 施氮对寒地水稻15N吸收、利用及氮代谢的影响[D]. 大庆: 黑龙江八一农垦大学, 2015. Li J H. Effects of nitrogen application on15N absorption, utilization and nitrogen metabolism in cold rice [D]. Daqing: Heilongjiang August First Land Reclamation University, 2015.
[21] 刘炳寰. 质谱学方法与同位素分析[M]. 北京: 科学出版社, 1983: 179-183. Liu B H. Mass spectroscopy and isotope analysis [M]. Beijing: Science Press, 1983: 179-183.
[22] 周碧青, 陈成榕, 杨文浩, 等. 茶树对可溶性有机和无机态氮的吸收与运转特性[J]. 植物营养与肥料学报, 2017, 23(1): 189-195. Zhou B Q, Chen C R, Yang W H, et al.Uptake and transport characteristics of soluble organic and inorganic nitrogen by tea plant [J]. Plant Nutrition and Fertilizer Science, 2017, 23(1): 189-195.
[23] 王新超, 杨亚军, 陈亮, 等. 利用15N标记研究不同品种茶树氮肥利用率差异[J]. 福建茶叶, 2005(1): 4-5. Wang X C, Yang Y J, Chen L, et al.Studies on N fertilizer-utilizing efficiency of different tea varieties by using15N-tracing method [J].Tea in Fujian,2005(1): 4-5.
[24] Ruan L, Wei K, Wang L Y, et al. Characteristics of NH4+and NO3−fluxes in tea () roots measured by scanning ion-selective electrode technique [J].Scientific Reports, 2016, 6(1): 38370. doi: 10.1038/srep38370.
[25] Li P Y, Guan Y S, Yu X. Application of scanning ion-selective electrode technique in study of higher plant [J]. Progress in Natural Science, 2006, 16(3): 262-266.
[26] 丁亚男, 许越. 非损伤微测技术及其在生物医学研究中的应用[J]. 物理, 2007, 36(7): 548-558. Ding Y N, Xu Y. Non-invasive micro-test technology and its applications in biology and medicine [J]. Physics, 2007, 36(7): 548-558.
[27] Xu G H, Fan X, Miller A J. Plant nitrogen assimilation and use efficiency [J]. Annual Review of Plant Biology, 2012, 63(1): 152-182.
[28] 孙美莲. 茶儿茶素生物合成相关基因表达的实时荧光定量PCR分析[D]. 合肥: 安徽农业大学, 2010. Sun M L. Real-time quantitative PCR analysis of gene expression related to tea catechin biosynthesis [D]. Hefei: Anhui Agricultural University, 2010.
[29] Ransbotyn V, Reusch T B H. Housekeeping gene selection for quantitative real-time PCR assays in the seagrass Zostera marina subjected to heat stress [J]. Limnology and Oceanography, Methods, 2006, 4(10): 367-373.
[30] 张珣. 六种植物病毒Real Time PCR定量方法的建立及其应用[D]. 北京: 农业科学院, 2008. Zhang X.Development and application of Real Time PCR approach for quantification of six plant virus [D].Beijing: Chinese Academy of Agricultural Sciences, 2008.
[31] 王新超. 不同品种茶树氮素营养差异及其机制的研究[D]. 北京: 中国农业科学院, 2003. Wang X C. Study on the difference of nitrogen nutrition and its mechanism in different tea trees [D]. Beijing: Chinese Academy of Agricultural Sciences, 2003.
[32] 杨亚军, 杨素娟, 杨跃华, 等. 早生优质适制名优绿茶新品种-中茶108选育研究[J]. 中国茶叶, 2003, 25(2): 12-14. Yang Y J, Yang S J, Yang Y H, et al. Investigation on the breeding of new tea cultivar, Zhongcha 108, with early-sprouting, superior-quality and suitable for manufacturing high-quality green tea [J].China Tea, 2003, 25(2): 12-14.
[33] Ruan J Y, Gerendas J, Hardter R, et al. Effect of nitrogen form and root-zone pH on growth and nitrogen uptake of tea () plants [J]. Annals of Botany, 2006, 99(2): 301-310.
[34] Zhang F, Liu Y, Wang L Y, et al. Molecular cloning and expression analysis of ammonium transporters in tea plants ((L.) O. Kuntze) under different nitrogen treatments [J]. Gene, 2018, 658: 136-145.
[35] 杨亦扬. 氮素对茶树叶片品质成分影响机理研究[D]. 南京: 南京农业大学, 2011. Yang Y Y. Study on the effect mechanism of nitrogen on the quality components of tea leaves [D].Nanjing: Nanjing Agricultural University, 2011.
[36] Epstein E, Hagen C. A kinetic study of the absorption of alkali cations by barley roots [J]. Plant Physiology, 1952, 27(3): 457-474.
[37] Crawford N M, Glass A D M. Molecular and physiological aspects of nitrate uptake in plants [J]. Trends in Plant Science, 1998, 3(10): 389-395.
[38] Francis D D, Schepers J S, Vigil M F. Post-anthesis nitrogen loss from corn [J]. Agronomy Journal, 1993, 85(3): 659-663.
[39] Morgan J A, Parton W J. Characteristics of ammonia volatilization from spring wheat [J]. Crop Science, 1989, 29(3): 726-731.
[40] 张亚丽, 董园园, 沈其荣, 等. 不同水稻品种对铵态氮和硝态氮吸收特性的研究[J]. 土壤学报, 2004(6): 918-923. Zhang Y L, Dong Y Y, Shen Q R, et al.Characteristics of NH4+and NO3-uptake by rices of different genotypes [J].Acta Pedologica Sinica,2004(6): 918-923.
[41] 邹春琴, 王晓凤, 张福锁. 铵态氮抑制向日葵生长的作用机制初步探讨[J]. 植物营养与肥料学报, 2004(1): 82-85. Zhou C Q, Wang X F, Zhang F S.Preliminary study on the mechanism of ammonium nitrogen inhibiting the growth of sunflower [J].Plant Nutrition and Fertilizer Science,2004(1): 82-85.
[42] 杜旭华, 彭方仁. 无机氮素形态对茶树氮素吸收动力学特性及个体生长的影响[J]. 作物学报, 2010, 36(2): 327-334. Du X H, Peng F R.Effect of inorganic nitrogen forms on growth and kinetics of ammonium and nitrate uptake inL. [J].Acta Agronomica Sinica,2010, 36(2): 327-334.
[43] 汤丹丹,刘美雅, 张群峰, 等. 不同氮素形态、pH对茶树元素吸收及有机酸含量影响[J]. 茶叶科学, 2019, 39(2): 159-170.Tang D D, Liu M Y, Zhang Q F, et al.Effects of nitrogen form and root-zone pH on nutrient uptake and concentrations of organic anions in tea plants () [J].Journal of Tea Science,2019, 39(2): 159-170.
[44] Zhang F, Wang Y L, Bai P X, et al. Identification of regulatory networks and hub genes controlling nitrogen uptake in tea plants ((L.) O. Kuntze) [J].Journal of Agricultural and Food Chemistry, 2020, 68:2445-2456.
[45] 刘鹏, 焦晓燕, 丁玉川, 等. 作物氮素高效利用研究进展[J]. 山西农业科学, 2017, 45(5): 855-860. Liu P, Jiao X Y, Ding Y C, et al. Research advances on improving nitrogen use efficiency for crop production [J]. Journal of Shanxi Agricultural Sciences,2017, 45(5): 855-860.
[46] 尹浩冰, 马红媛, 梁正伟.15N稳定同位素标记技术在草地生态系统氮循环中的研究进展[J]. 土壤与作物, 2014, 3(1): 15-21.
Yi H B, Ma H Y, Liang Z W.Review of stable isotope technique in grassland nitrogen cycling study [J].Soil and Crop, 2014, 3(1): 15-21.
Early Identification of Nitrogen Absorption Efficiency in Tea Plants
SU Jingjing1,2, RUAN Li1, WANG Liyuan1, WEI Kang1, WU Liyun1, BAI Peixian1,2, CHENG Hao1*
1. Tea Research Institute, Chinese Academy of Agricultural Sciences, National Center for Tea Improvement, Key Laboratory of Tea Biology and Resource Utilization, Ministry of Agriculture, Hangzhou 310008, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China
Nitrogen is one of the most important elements for tea plants, and it has been over supplied in tea gardens, which not only results in the waste of resources, but also causes a series of environmental problems. Therefore, to breed tea cultivars with high nitrogen efficiency, it is necessary to establish an early detection of nitrogen usage rates which could be developed for screening the strains of tea plants. This study analyzed the absorption and utilization of ammonia nitrogen and nitrate nitrogen in two tea cultivars Longjing 43 (LJ43) and Zhongcha 108 (ZC108) under different nitrogen levels. The15N isotope labeling technology was applied to verify the feasibility and practicability of non-invasive micro-test technology (NMT) and real-time fluorescence quantitative (qRT-PCR) technology in early identification of nitrogen absorption and utilization abilities of tea lines. The purpose of this study was to establish an indoor early identification technology of nitrogen absorption efficiency for tea plants. The results show that the accuracy, stability and repeatability of15N were 85.16%, 89.51% and 99.26% respectively. While the accuracy, stability and repeatability of NMT were 91.35%, 95.22% and 96.76% respectively. The two methods showed that tea plants had obvious ammonium preference. Moreover, the expressions of nitrate transporter genesandwere up-regulated by nitrogen in both cultivars. Compared with ZC108, the expressions ofandin LJ43 were higher, indicating that the response of LJ43 to external nitrogen applications was higher than that of ZC108. Finally, it was preliminarily summarized that the NMT technology could measure the instantaneous absorption rate of tea plants in a short time with little loss of experimental materials. It might also be applied for the early detection of the instantaneous nitrogen absorption rates of tea plants. Meanwhile, the results also show that the expressions ofandcould partly reflect the nitrogen absorption ability of tea plants. This study provided a basis to develop techniques in early identification of high nitrogen-efficient cultivars in tea plants.
tea plants, nitrogen uptake rate, non-invasive micro-test technology (NMT),15N isotope-labeled, qRT-PCR
S571.1;S154.1
A
1000-369X(2020)05-576-12
2020-01-13
2020-03-17
中央级科研院所基本科研业务费专项(1610212018004)、浙江省农业(茶树)新品种选育重大科技专项(2016C02053-8)、现代农业产业技术体系建设专项资金资助(CARS-19)
苏静静,女,硕士研究生,主要从事茶树耐贫瘠育种研究。*通信作者:chenghao@tricaas.com

