组蛋白伴侣ASF1B在前列腺癌细胞的表达及其对体外细胞活力的影响*
蔡江怡, 朱乐乐
(1温州市中西医结合医院泌尿外科,2温州市中医院病理科,浙江温州25000)
前列腺癌(prostate cancer,PCa)是男性中常见的恶性肿瘤之一[1]。目前,PCa的治疗效果并不令人满意,PCa远处转移患者的5年生存率仅为20%[2]。因此,有必要开发一种安全有效的PCa治疗靶点[3]。抗沉默功能蛋白1(anti-silencing function 1,ASF1)最初在酵母中被鉴定,属于组蛋白H3-H4伴侣蛋白[4]。ASF1具有调节染色质功能,并已被证明有助于肿瘤发生。ASF1有2个主要的亚型,分别是ASF1A和ASF1B[5]。研究报道,ASF1B在人胸腺和睾丸中高表达[6]。此外,据报道ASF1B参与了宫颈癌和乳腺癌的发展[7]。然而,ASF1B在PCa中的作用仍不清楚。因此,本项工作应用细胞体外实验,探讨ASF1B在前列腺癌细胞中的表达情况及其对体外细胞增殖能力的影响。
材料和方法
1 细胞培养
人前列腺增生上皮细胞系(良性前列腺增生,benign prostatic hyperplasia,BPH)和前列腺癌PC-3细胞购自ATCC。BPH细胞在含10%胎牛血清(Thermo Fisher Scientifc)、1×105U/L青霉素和 100 mg/L链霉素(Sigma-Aldrich)的DMEM培养液(北京索莱宝科技有限公司)中培养。PC-3细胞在含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养液(北京索莱宝科技有限公司)中培养。将所有细胞保持在含有5%CO2的37℃加湿培养箱中。
2 方法
2.1 RNA干扰、转染与分组 用经过验证的特异性siRNA进行ASF1B的敲减,siRNA-ASF1B(购自Thermo Fisher Scientific)的正义链序列为5'-ACGCAACCCTGTCAGTCTG-3',反义链序列为5'-GGGCAGGTCCACCATTTCC-3'。使用非特异性杂乱siRNA载体作为对照,其正义链序列为5'-AGCAGCTAGAATCCCTGGG-3',反义链序列为5'-AGGCCGAAGGAGTTCCAGT-3'。将PC-3细胞以每孔1×104个细胞的密度接种到6孔板中,分为对照(control,Con)组、siRNA阴性对照载体(mock)组和 siRNAASF1B组。对照组不做任何处理;mock组使用Hieff TransTM脂质体转染试剂(Sigma-Aldrich)和siRNA阴性对照载体(1µg)转染细胞;siRNA-ASF1B组使用Hieff TransTM脂质体转染试剂和siRNAASF1B(1µg)转染细胞。将细胞在37℃下孵育12 h,随后收集细胞并进行Western blot、RT-qPCR和MTT实验。
2.2 细胞活力测定 通过MTT法测定细胞活力。将上述处理细胞(1×108/L)接种到96孔培养板中,孵育过夜后,然后向每个孔中加入10µL MTT溶液(在PBS中2.5 g/L),并将板在37℃下再温育4 h。离心(2 000×g,10 min)后,吸出含有MTT的培养液,然后加入100µL DMSO。用SynergyHT多功能酶标仪(Winooski)在570 nm下测量每个孔的吸光度(A)值。
2.3 Western blot分析 收集细胞在RIPA裂解物缓冲液中裂解,并在冰上进行温和超声处理。在BCA定量后,向每个泳道中加入20µg细胞裂解物,随后通过8%SDS-PAGE(30 mA,120 min)分离,转移到聚偏二氟乙烯膜上。将膜与I抗[兔抗AKT(1∶800稀释)、兔抗p-AKT(1∶500稀释)、兔抗pMAP2K4(1∶1 000稀释)、兔抗p-ERK(1∶1 000稀释)、兔抗ERK(1∶1 000稀释)、兔抗JNK(1∶1 000稀释)、兔抗p-JNK(1∶1 000稀释)和兔抗β-actin(1∶1 000稀释),均购自Cell Signaling Technology]在4℃温育过夜,然后与抗生物素蛋白-生物素化的辣根过氧化物酶复合物II抗在室温下温育2 h。使用Image Lab 5.0软件(Bio-Rad Laboratories)定量靶蛋白和β-actin的条带强度,并将每种靶蛋白的强度标准化为相应的β-actin水平。
2.4 RT-qPCR分析 使用RNA提取试剂盒(Promega)提取细胞的总RNA。使用TianScript cDNA Synthesis试剂盒(Tiangen Biotech Co.,Ltd.)将总共1µg的RNA转录成cDNA。反应条件如下:85℃5 min,4℃ 5 min。采用SYBR®Premix Ex Taq™ II试剂盒(TaKaRa)在ABI 7500 Fast系统(Applied Biosystems)上进行qPCR分析。热循环设置如下:在92℃下预变性5 min;在92℃变性15 s,在58℃退火30 s,在72˚C下延伸35 s,进行30个循环。β-actin用作加载对照。通过2-ΔΔCt计算每个基因的相对表达,并用β-actin进行归一化。用于qPCR扩增的引物序列如下:p53的正向引物序列为5'-AAGTAGAGAGGCATCGCAGAGA-3',反向引物序列为5'-TTCGTTGCTGATTTACTCAGTAGG-3';Bax的正向引物序列为5'-TCCTTCACCAATGTCAACTCC-3',反向引物序列为5'-TGATTTTTCAGCCCATCCAC-3';PARP-1的正向引物序列为5'-CTGTCGCTTCTCAATCAGACTC-3',反向引物序列为5'-CCCAGGTCATTTCCCATCACTT-3';caspase-3的正向引物序列为5'-CTGCTCTCCCTAACCCCTTGTC-3',反向引物序列为5'-CACATAGGTAACGAGTCAGAGC-3';β-actin的正向引物序列为5'-ATCGTGCGTGACATTAAGGAG-3',反向引物序列为5'-AGGAAGGAAGGCTGGAAGAG-3'。
2.5 细胞凋亡和细胞周期分析 使用膜联蛋白VFITC/PI细胞凋亡检测试剂盒(Sigma-Aldrich)检查细胞凋亡。将细胞接种在6孔板(每孔3×104细胞)中,置于培养箱培养24 h。然后加入5µL膜联蛋白VFITC和5 µL PI(50 mg/L)对细胞染色,在室温下避光孵育20 min。进行BD FACSAria I/II流式细胞术以测量细胞凋亡,并使用BD CellQuest Pro 3.3软件(均来自BD Biosciences)进行分析。使用PI染料试剂盒(Sigma-Aldrich)进行细胞周期测定。PC-3细胞在通过胰蛋白酶消化收获并用冷PBS洗涤后,将贴壁细胞在4%的70%乙醇中固定24 h。随后,将固定的细胞洗涤2次并用含有200µL PBS、1µL PI(1 g/L)和1µL RNase(10 g/L)的循环测试系统在37℃的黑暗中染色20 min。使用流式细胞术分析细胞周期。
3 统计学处理
使用SPSS 19.0和GraphPad Prism 5软件进行统计分析。数据表示为均数±标准差(mean±SD)。多组间均数比较采用单因素方差分析,然后进行Student-Newman-Keuls多重比较。以P<0.05为差异有统计学意义。
结 果
1 ASF1B在PC-3细胞中的表达
通过Western blot检测ASF1B在BPH和PC-3细胞中的表达。结果表明,正常细胞(BPH)中ASF1B的蛋白水平显著低于PC-3细胞(P<0.01),见图1。

Figure 1.Western blot was used to detect the ASF1B protein expression in BPH and PC-3 cells.Mean±SD.n=3.**P<0.01 vs BPH group.图1 Western blot分析BPH和PC-3细胞中ASF1B的蛋白水平
2 siRNA-ASF1B降低PC-3细胞的活力
通过Western blot检测siRNA-ASF1B质粒在PC-3细胞中的转染效率。结果显示,与对照组和mock组相比,用siRNA-ASF1B质粒转染PC-3细胞后的ASF1B蛋白表达水平显著降低(P<0.01),图2A。使用MTT法测定PC-3细胞的活力,结果显示,与对照组和mock组相比,转染siRNA-ASF1B质粒的PC-3细胞的活力显著降低(P<0.01),见图2B。转染12 h后,siRNA-ASF1B显著降低细胞活力,因此将siRNAASF1B转染持续时间设定为12 h。
3 流式细胞术分析结果
与对照组和mock组相比,转染siRNA-ASF1B质粒的PC-3细胞的凋亡率显著升高(P<0.01),且细胞周期被阻滞于G1期,而G2和S期细胞数量显著减少(P<0.01),见图3。
4 siRNA-ASF1B调节PC-3细胞中的凋亡相关因子
RT-qPCR结果表明,与对照组和mock组相比,用siRNA-ASF1B质粒转染PC-3细胞后,p53、caspase-3、Bax和PARP-1的mRNA水平上调(P<0.01),见图4。
5 siRNA-ASF1B对PC-3细胞中MAPK/JNK/ERK信号通路影响
采用Western blot检测MAPK/JNK/ERK信号通路的蛋白表达水平。结果显示,与对照组和mock组相比,siRNA-ASF1B组PC-3细胞中MAP2K4和p-JNK蛋白水平显著升高(P<0.01),而p-ERK蛋白水平显著降低(P<0.01),见图5。
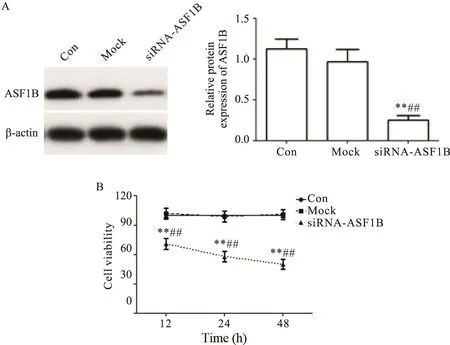
Figure 2.Western blot was used to detect the ASF1B protein expression in PC-3 cells after treatment for 12 h(A),and the viability of PC-3 cells was determined by MTT assay at 12,24,and 48 h after treatment(B).Mean±SD.n=3.**P<0.01 vs Con group;##P<0.01 vs mock group.图2 采用Western blot检测各组处理12 h后PC-3细胞中ASF1B蛋白表达,并采用MTT法测定各组细胞的活力

Figure 3.Flow cytometry was used to analyze the apoptosis(A)and cell cycle distribution(B)of PC-3 cells after treatment for 12 h.Mean±SD.n=3.**P<0.01 vs Con group;##P<0.01 vs mock group.图3 流式细胞术分析各组处理12 h后PC-3细胞的凋亡和细胞周期分布
讨 论
目前已证实ASF1B对包括乳腺癌细胞和骨肉瘤细胞在内的多种细胞系的增殖为关键[7]。ASF1B可能直接上调与DNA复制相关的基因,能够补偿复制缺陷;ASF1B耗尽的细胞显示出形态改变的细胞核数量以及微核和核间DNA桥的数量显著增加[6]。这些研究表明ASF1B在有丝分裂过程中可能起作用。本研究显示,正常细胞(BPH)中ASF1B的蛋白水平显著低于PC-3细胞,这一结果与乳腺癌和宫颈癌中ASF1B的高表达相似[7],提示ASF1B上调可能有助于PCa的生长、转移和分化。
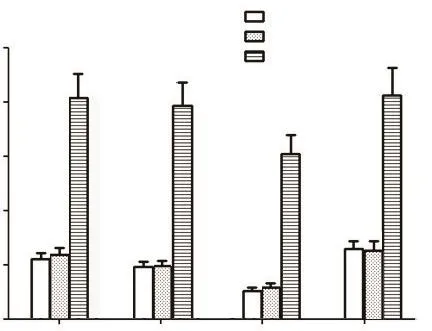
Figure 4.RT-qPCR was used to analyze the mRNA expression of p53,caspase-3,Bax and PARP-1 in PC-3 cells.Mean±SD.n=3.**P<0.01 vs Con group;##P<0.01 vs mock group.图4 RT-qPCR分析PC-3细胞中p53、caspase-3、Bax和PARP-1的mRNA水平
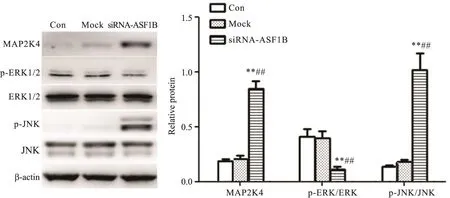
Figure 5.Western blot was used to detect the effect of siRNA-ASF1B on MAPK/JNK/ERK signaling pathway in PC-3 cells.Mean±SD.n=3.**P<0.01 vs Con group;##P<0.01 vs mock group.图5 Western blot检测siRNA-ASF1B对PC-3细胞中MAPK/JNK/ERK信号通路的影响
抗肿瘤药物和基因在促进肿细胞凋亡过程中发挥作用[8]。先前的一项研究表明,ASF1B的过度表达显著增强了乳腺癌的增殖[9]。本研究中,与对照细胞相比,siRNA-ASF1B显著下调了PC-3细胞的ASF1B表达,与此同时细胞凋亡率显著增加。细胞凋亡与细胞周期分布有关。凋亡的变化参与细胞周期阶段的调节,包括G1、G2和S期[10-12]。类似地,本研究数据显示,siRNA-ASF1B诱导PC-3细胞G1期阻滞,表明ASF1B沉默可促进PCa的细胞周期阻滞。为了进一步验证siRNA-ASF1B对细胞凋亡的抑制作用,我们检测了细胞凋亡相关因子的表达情况。结果显示,用siRNA-ASF1B质粒转染PC-3细胞后p53、caspase-3、Bax和PARP-1的mRNA水平上调[13-14]。这些结果表明,ASF1B的敲减通过提高p53、caspase-3、PARP和Bax的表达水平,加速了PC-3细胞的凋亡。
MAPK/JNK/ERK信号通路在细胞生长和增殖中起作用,并且已经观察到该通路在各种癌症类型中失调[15]。此外,抑制MAPK/JNK信号通路导致细胞活力降低,并可能增强 PCa的凋亡[16],表明 MAPK/JNK信号通路在肿瘤进展过程中的作用。本研究中,siRNA-ASF1B组中PC-3细胞的MAP2K4和p-JNK蛋白水平显著升高(P<0.01),表明ASF1B的敲减激活了MAPK/JNK途径,进而诱导细胞凋亡。另一方面,已知ERK1/2的激活能有效促进细胞存活[1]。本研究显示,p-ERK蛋白水平显著降低。这些结果强烈提示,ASF1B的沉默抑制了PCa的存活。因此,激活MAPK/JNK/ERK信号通路可能是siRNA-ASF1B在PCa中抗肿瘤作用的潜在机制之一。
总之,本研究结果表明ASF1B在PC-3细胞中高度上调;ASF1B沉默显著诱导PC-3细胞G1期阻滞,促进细胞凋亡;激活MAPK/JNK/ERK信号通路可能是siRNA-ASF1B抗肿瘤作用的机制之一。

