PDK4异常表达对前列腺癌细胞糖酵解和生长的影响*
李 骏, 张 倩, 马 赫, 陈楚杰, 杨祥伟, 庞 俊, 江东根△
(中山大学附属第七医院1泌尿外科,2康复医学科,广东深圳518107)
前列腺癌(prostate cancer,PCa)是危害老年男性健康的一个主要疾病,也是美国男性肿瘤相关死亡的第二大原因[1]。早期局限性前列腺癌可行根治性前列腺切除术,预后良好。晚期前列腺癌患者多采用雄激素剥夺治疗,然而最终失败逐渐进展为不可治愈致命性的去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)[2]。因此,进一步阐明前列腺癌进展的分子机制对于寻求有效的CRPC治疗方法具有重要意义。
恶性肿瘤细胞的主要代谢特征之一是高水平的糖酵解,如氧气充足,这种现象则被称为有氧糖酵解或Warburg效应[3]。糖酵解为肿瘤的快速生长提供了大量能量和底物。因此,抑制肿瘤有氧糖酵解阻断能量供应已被证实是克服肿瘤治疗困难的有效策略[4]。糖代谢途径由多种酶类进行催化调控,其中线粒体丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex,PDC)不可逆催化丙酮酸脱羧为乙酰辅酶A,是控制糖酵解走向氧化磷酸化的关键调控点[5]。PDC的活性取决于它的磷酸化状态,丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinases,PDKs)与丙酮酸脱氢酶磷酸酶(pyruvate dehydrogenase phosphatases,PDPs)在调节PDC的磷酸化水平及活性过程中起着重要作用[6]。人类有4种不同的PDK同工酶(PDK1~4),其中PDK4已被证实是PDC调控物质代谢的中心[7-8]。PDK4通过抑制PDC活性,将丙酮酸代谢从线粒体氧化磷酸化转移到细胞质进行糖酵解,为细胞生长提供能量来源。因此,PDK4的调控可直接影响糖酵解的效率。目前国内外研究显示PDK4在膀胱癌、结肠癌、乳腺癌、卵巢癌等多种恶性肿瘤中呈高表达,并与其恶性程度及不良预后有关[9-12]。但暂无文献报道PDK4在前列腺癌中发挥的作用,故本研究重点探讨糖代谢过程中的关键酶PDK4在前列腺癌组织中的表达及其对前列腺癌细胞糖酵解和增殖的影响,以期从能量代谢方面为前列腺癌的诊疗提供新的分子靶点。
材料和方法
1 材料和试剂
1.1 细胞和质粒 前列腺癌细胞PC3、LNCaP、DU145和C4-2由中科院典型培养物保藏中心细胞库提供;正常前列腺上皮细胞RWPE-1由ATCC提供。PDK4-shRNA质粒由上海吉玛公司设计并构建。
1.2 主要试剂 细胞培养液RPMI-1640和胎牛血清(Gibco);Defined KSFM、RNA提取试剂盒、CCK-8试剂盒、蛋白提取试剂盒和细胞周期试剂盒均由凯基生物公司提供;兔抗人PDK4单克隆抗体及Ⅱ抗购自Abcam;Lipofectamine 3000购自Life Technology。
1.3 标本 良性前列腺增生(benign prostatic hyperplasia,BPH)组织和前列腺癌标本蜡块由我院病理科提供,其中15例良性前列腺增生电切组织和32例前列腺癌组织(包含Gleason≤6的前列腺癌组织11例、Gleason=7的前列腺癌组织13例和Gleason≥8的前列腺癌组织8例)。本研究已通过中山大学附属第七医院伦理委员会批准。
2 主要方法
2.1 细胞培养和转染 用含10%胎牛血清和青/链霉素的RPMI-1640培养液培养前列腺癌细胞株(PC3、LNCaP、DU145及C4-2);前列腺正常上皮细胞RWPE-1采用含有5µg/L表皮生长因子、50 g/L牛脑垂体萃取液和1×抗菌素的Defined KSFM细胞培养液,于5%CO2、37℃培养箱中传代培养。取处于对数生长期、细胞密度约70%~80%的PC3细胞进行转染,参考Lipofectamine 3000方法进行转染,实验组转染PDK4-shRNA质粒,对照组转染空白质粒。
2.2 RT-qPCR实验 细胞总RNA采用Trizol法抽提,通过紫外分光光度计检测RNA纯度与浓度,参照试剂盒说明书行RNA逆转录,再以逆转录合成的cDNA为模板继续行荧光定量PCR。内参照为β-actin,mRNA相对表达量计算采用2-ΔΔCt法。PDK4的正向引物序列为5'-GGAGCATTTCTCGCGCTACA-3',反向引物序列为5'-ACAGGCAATTCTTGTCGCAA-3';β-actin的正向引物序列为5'-AAGACCTGTACGCCAACACAGT-3',反向引物序列为5'-AGAAGCATTTGCGGTGGACGAT-3'。
2.3 免疫组化观察 标本石蜡切片常规脱蜡水化,3%H2O2溶液中浸泡,修复抗原,滴加按1∶500稀释的抗PDK4抗体,4℃孵育过夜,PBS漂洗后,滴加辣根过氧化物酶标记的Ⅱ抗工作液,37℃孵育20 min,PBS漂洗,滴加链霉亲和素-过氧化物酶,孵育漂洗,DAB显色,显微镜下观察统计染色结果,PDK4蛋白主要在细胞浆中表达。按显色强度,无阳性染色记0分,较弱棕色记1分,中度棕色记2分,较强棕色记3分。按阳性细胞百分比,阳性细胞数<5%记0分,6%~25%记1分,26%~50%记2分,>50%记3分。将两项结果相乘得到总分。每张玻片染色评分按双盲原则,由2名高年资病理科医生进行阅片判断,取平均值汇总结果。
2.4 Western blot实验 常规提取细胞总蛋白,检测其浓度,加样后行SDS-PAGE,转PVDF膜,封闭液室温孵育2 h,加Ⅰ抗(1∶1 500)于4℃孵育过夜,相应Ⅱ抗室温孵育2 h后进行显色成像。
2.5 糖摄取和乳酸分泌实验 参考已发表文献中所述方法[13],细胞转染后收集培养液,离心弃去细胞碎片,采用试剂盒分别检测培养液中葡萄糖和乳酸的水平,配合细胞计数,将得到的葡萄糖及乳酸含量减去培养液本底值后除以相应细胞数,得到每个细胞的糖消耗量及乳酸生成量,结果以相对倍数表示,以对照组细胞为标准。
2.6 CCK-8法检测细胞活力 取对数生长期预处理的细胞,置于96孔板中培养,分别于转染后1、2、3和4 d检测细胞活力。按说明书加入CCK-8试剂后孵育3 h,酶标仪测定各孔在450 nm波长处的吸光度(A)值。
2.7 流式细胞术分析细胞周期分布 参考已发表文献所述方法[14],转染质粒48 h后,取预处理的对数生长期细胞,置于70%乙醇中4℃过夜固定。次日重悬细胞并用PBS漂洗,加入PI溶液,冰上放置30 min。上流式细胞仪行细胞周期检测分析。
3 统计学处理
用SPSS 19.0软件进行统计分析,数据用平均数±标准差(mean±SD)表示。两独立样本间比较采用Student's t检验,多组间计量资料比较应用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 PDK4在前列腺癌组织中的表达
通过免疫组化检测临床15例良性前列腺增生组织和32例前列腺癌组织标本的PDK4表达水平,其中在前列腺癌组织中,Gleason≤6的前列腺癌组织11例,Gleason=7的前列腺癌组织13例,Gleason≥8的前列腺癌组织8例,典型染色图片如图1A所示。良性前列腺增生和前列腺癌组织的PDK4免疫组化IHC评分分别为3.33±0.19和5.96±0.26,其差异有统计学意义(P<0.05),见图1B。进一步分析前列腺癌组织PDK4表达与病理Gleason评分的关系,结果显示Gleason≤6的前列腺癌组织IHC评分为4.73±0.26,Gleason=7的前列腺癌IHC评分为5.22±0.21,Gleason≥8的前列腺癌IHC评分为7.33±0.28,差异有统计学意义(P<0.05),见图1C。
2 PDK4在前列腺癌细胞株中的表达
通过RT-qPCR和Western blot方法检测正常前列腺上皮细胞(RWPE-1)和4种前列腺癌细胞株(PC3、LNCaP、DU145和C4-2)中PDK4的mRNA和蛋白表达水平。结果表明PDK4在前列腺癌细胞株中的mRNA和蛋白表达水平均显著高于正常前列腺上皮细胞(P<0.05),其中PC3细胞中PDK4的表达丰度最高,故后续体外实验均采用PC3细胞株,见图2。
3 PC3细胞转染PDK4-shRNA后PDK4表达水平的变化
PC3细胞转染PDK4-shRNA重组质粒后,通过RT-qPCR检测到PDK4的mRNA表达量明显减低,同时Western blot结果也呈现一致性改变,转染后的PDK4蛋白表达水平显著下降,从而证实了基因沉默的有效性(P<0.05),见图3。
4 敲减PDK4的表达对PC3细胞糖酵解的影响
PC3细胞转染PDK4-shRNA重组质粒抑制PDK4基因表达后,通过试剂盒检测细胞的葡萄糖摄取和乳酸分泌量来反应糖酵解水平。结果表明,相对于对照NC组,PDK4-shRNA组的葡萄糖消耗量显著减少,同时乳酸生成量亦显著减少(P<0.05),见图4。
5 敲减PDK4对PC3细胞活力和周期分布的影响
PC3细胞转染PDK4-shRNA重组质粒敲减PDK4的表达后,通过CCK-8法和流式细胞术分析细胞活力和周期分布的改变。结果显示,PDK4-shRNA转染组的PC3细胞自转染后2 d开始细胞活力下降,并随着时间推移差异趋势逐渐增大(P<0.05),见图5A。流式细胞术证实,与对照组相比,PDK4-shRNA组停留在G0/G1期的细胞数量显著增加,出现G0/G1期阻滞(P<0.05),见图5B。
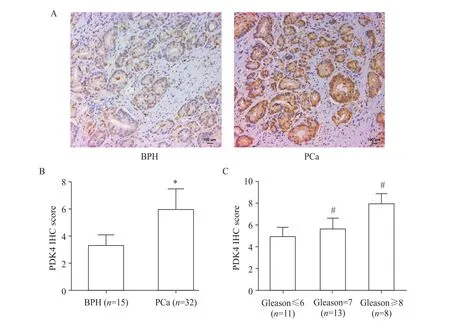
Figure 1.The expression of PDK4 in prostate cancer(PCa)tissues.A:representative images of immunohistochemical(IHC)staining of PDK4 protein in benign prostatic hyperplasia(BPH)tissues and PCa tissues;B:IHC scores of PDK4 protein in BPH tissues and PCa tissues;C:IHC scores of PDK4 protein in PCa tissues with different Gleason scores.Mean±SD.*P<0.05 vs BPH group;#P<0.05 vs Gleason≤6 group.图1 PDK4蛋白在前列腺癌组织中的表达及其与病理Gleason评分的关系
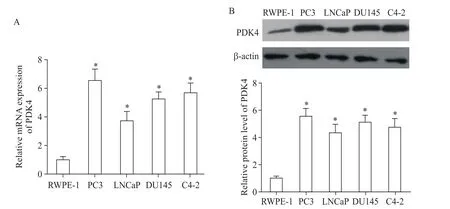
Figure 2.The mRNA(A)and protein(B)levels of PDK4 in prostate cancer cell lines(PC3,LNCaP,DU145 and C4-2)and normal prostate epithelial cells(RWPE-1)were determined by RT-qPCR and Western blot,respectively.Mean±SD.n=6.*P<0.05 vs RWPE-1 group.图2 PDK4 mRNA和蛋白在前列腺癌细胞株中的表达
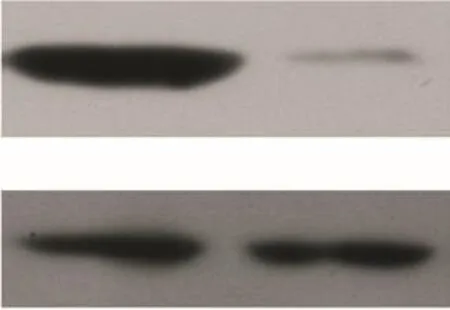
Figure 3.After PDK4-shRNA transfection,RT-qPCR and Western blot were used to confirm the down-regulation of PDK4 mRNA(A)and protein(B)in the PC3 cells.Mean±SD.n=6.*P<0.05 vs NC group.图3 PC3细胞转染PDK4-shRNA后PDK4表达水平的变化
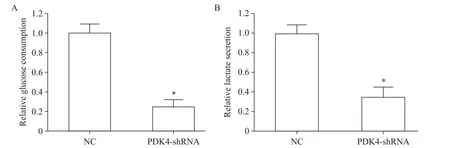
Figure 4.After PDK4-shRNA transfection,glucose consumption(A)and lactate release(B)in the PC3 cells were measured by glycolysis kit.Mean±SD.n=6.*P<0.05 vs NC group.图4 敲减PDK4对PC3细胞糖酵解的影响
讨 论
Warburg效应代表着肿瘤细胞对葡萄糖的利用方式由氧化磷酸化到糖酵解的转变,被认为是恶性肿瘤的一大特征,这种能量代谢改变受很多复杂因素调控,包括肿瘤微环境的压力和基因的改变等[15]。肿瘤细胞糖酵解增强主要是由于糖酵解关键酶的表达或活性增强。近年来,国内外学者不断探索通过抑制肿瘤细胞糖酵解通路关键酶的活性来靶向治疗恶性肿瘤。一些研究显示,抑制肿瘤糖酵解途径能够有效抑制肿瘤细胞的增殖甚至可以起到杀伤肿瘤细胞的作用,比如己糖激酶2、磷酸果糖酶和M2型丙酮酸激酶等糖酵解关键酶已经成为肿瘤标志物,它们的表达与活性可以影响肿瘤的糖酵解,进而影响肿瘤的增殖[16]。
PDK4作为4种丙酮酸脱氢酶激酶亚型之一,在葡萄糖三羧酸循环/氧化磷酸化调控中起重要作用。PDK4使PDC亚基磷酸化,从而抑制丙酮酸生成乙酰辅酶A,使代谢通量流向糖酵解。PDK4作为PDC活性抑制剂的关键作用使其基因成为许多肿瘤和代谢疾病的重要靶基因[5]。目前的观点普遍认为PDK4在恶性肿瘤发生进展过程中发挥促癌作用,例如:在某些病理条件下,PDK4持续激活,可引起机体内细胞代谢途径的变化,诱导细胞恶变[17];PDK4在肺癌中可以通过活化mTOR信号通路和增强有氧糖酵解加速肿瘤生长[18];PDK4在高级别膀胱癌中表达上调,并与膀胱癌细胞顺铂耐药有关[9];高水平PDK4与乳腺癌不良预后有关[11];利用小分子抑制剂下调PDK4的活性,可以显著抑制糖酵解通量及肿瘤生长[19]。

Figure 5.After PDK4-shRNA transfection,the viability of PC3 cells was measured by CCK-8 assay(A),and the cell cycle distribution was analyzed by flow cytometry(B).Mean±SD.n=6.*P<0.05 vs NC group.图5 抑制PDK4对PC3细胞活力和细胞周期分布的影响
但是也有少部分文献报道PDK4同样可以扮演抑癌基因的角色,其中一项研究表明,在肝癌细胞中,下调PDK4可通过抑制PDC活性促进脂肪从头合成,进而加速细胞增殖和肿瘤生长。这可能是因为PDK4减少乙酰辅酶A的生成,而乙酰辅酶A是脂肪酸合成和能量生产的前体物质[20]。鉴于以上观点存在的争议性,我们提出合理解释:一方面组织或细胞特异性可能影响PDK4在不同肿瘤类型中的独特功能;另一方面,由于不同器官的代谢微环境和癌细胞的代谢需求不同,可能导致PDK4功能的多样性。但PDK4在不同肿瘤和疾病中发挥何种作用,具体作用机制如何,仍有待于进一步研究去探索证实。
迄今为止,尚未见文献报道PDK4在前列腺癌中的表达情况及其作用机制。本次研究通过检测临床标本显示,PDK4在前列腺癌中的表达水平显著高于前列腺增生组织,且Gleason评分越高,PDK4的表达水平也显著增高,提示PDK4与前列腺癌的恶性程度有关。进一步,本实验在细胞株中也证实了在前列腺癌细胞中PDK4的表达量显著高于前列腺正常上皮细胞。细胞实验证实,敲减PDK4的表达可显著抑制前列腺癌细胞的有氧糖酵解和细胞生长。本研究表明,PDK4在前列腺癌的发生进展过程中发挥不可忽视的促癌作用,这与国内外主流观点一致。但是PDK4调控前列腺癌生长的具体分子机制及其临床应用,需要更加深入的基础和临床研究来阐明。

