RXRα激动剂贝萨罗汀通过调控TGF-β1/Smad2通路抑制ApoE-/-小鼠动脉粥样硬化的形成*
许昌声, 张美金, 练桂丽, 彭 峰, 王华军, 林金秀, 柴大军
(福建医科大学附属第一医院心血管内科,福建高血压研究所,福建福州350005)
动脉粥样硬化(atherosclerosis,AS)已成为危及人类健康的全球性疾病之一,血管中膜平滑肌细胞增殖在其形成和发展过程中扮演重要角色[1-3]。前期研究结果证实,血脂代谢异常、血管内膜脂质沉积和血管中膜平滑肌细胞增生是载脂蛋白E缺陷(apolipoprotein E knockout,ApoE-/-)小鼠AS斑块形成与发展的病理基础,且转化生长因子β1(transforming growth factor-β1,TGF-β1)/Smad2信号通路参与 AS斑块内血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的增生过程[4-6],抑制TGF-β1/Smad2通路可减轻血管中膜肥厚,减少平滑肌层细胞增生,抑制动脉硬化斑块发展[7]。
类 视 黄 醇 X 受 体 α(retinoid X receptor α,RXRα)是核受体超家族的成员,可与其他核受体形成异二聚体,参与抗炎、抗氧化等多种细胞生物学效应[8]。我们前期观察发现RXRα在逆转病理性心肌肥厚、抑制内皮细胞氧化损伤及糖尿病心肌纤维化等方面具有重要的作用[9-10],也证实了RXRα激动剂可通过改善糖脂代谢抑制动脉硬化的形成,但其分子机制尚不清楚。
本项工作应用小鼠模型,观察RXRα受体激动剂贝萨罗汀(bexarotene,Bex)对ApoE-/-小鼠AS斑块形成和VSMCs增生的作用,探讨RXRα受体对TGF-β1/Smad2通路的调控作用。
材料和方法
1 实验动物和主要试剂
SPF级ApoE-/-小鼠和C57BL/6小鼠,体重18~20 g,许可证号为SCXK(京)2011-0012,购于北京大学医学部。Bex(Eisai);A83-01(Smad2磷酸化抑制剂)和TGF-β1(Sigma);5-溴脱氧尿嘧啶核苷(5-bromodeoxyuridine,BrdU)细胞增殖试剂盒(Roche);核蛋白提取试剂盒(上海碧云天公司);Smad2和p-Smad2抗体(CST);辣根过氧化物酶标记的Ⅱ抗(北京中杉公司);丙烯酰胺和Tris-base(Ameresco);PVDF膜(Millipore);β-actin单克隆抗体和免疫印迹化学发光试剂(Santa Cruz)。
2 方法
2.1 实验动物和分组 根据文献[11]我们选用10只8周龄雄性C57BL/6小鼠为正常对照,30只8周龄雄性ApoE-/-小鼠为AS动物模型并随机分为3组:ApoE-/-组 、ApoE-/-+Bex5 (5 mg·kg-1·d-1Bex)组 、ApoE-/-+Bex10(10 mg·kg-1·d-1Bex)组。给药剂量参照祝江等[7]在糖尿病ApoE-/-小鼠AS研究的基础上进行改良。饲养条件:室温(22±2)℃,湿度(55±5)%,人工光照明暗各12 h/d,自由取食饮水,饲料由上海斯莱克公司提供。将Bex溶于生理盐水中,灌胃法给药,每天1次,连续8周,C57BL/6和ApoE-/-组小鼠均予等体积生理盐水灌胃。
2.2 HE染色 取小鼠胸主动脉弓下0.5 cm血管段,PBS洗涤1~2次,4%甲醛固定,常规脱水、透明、石蜡包埋、切片、HE染色,中性树脂封片,显微镜下拍照,采用自动成像分析软件系统(Image 5.0)计算胸主动脉内膜斑块面积。
2.3 组织块贴壁法培养VSMCs 取ApoE-/-小鼠(8周龄)胸主动脉,置于盛有M199液的培养皿中,去除血管外膜后剪碎(1 mm×1 mm×1 mm),M199液冲洗2~3次,将组织块转移至培养瓶,平铺,吸弃培养液,于组织块对侧加入4~5 mL含10%FBS的M199培养液,倾斜45°于培养箱静置2~3 h,翻转培养瓶平放,3~4 d更换2/3培养液,待细胞铺满70%~80%瓶底,采用0.25%胰酶消化传代,传3~6代细胞进行干预实验。
2.4 蛋白提取和Western blot实验 取ApoE-/-小鼠胸主动脉(隔肌上)长约1 cm,剥去血管外膜组织,PBS漂洗1~2次,加0.5 mL RIPA裂解缓冲液匀浆,加入等体积2×SDS上样缓冲液,震荡15 s,100℃水浴煮10 min,12 000×g、4℃离心10 min,取上清-80℃保存备用。依据产品说明书,采用核蛋白提取试剂盒提取VSMCs总蛋白、胞浆及胞核蛋白。蛋白经凝胶电泳、转膜、封闭后加Smad2和p-Smad2抗体(1∶1 000),Ⅱ抗(1∶5 000)孵育、显影,以β-actin(1∶2 000)为内参照,以目的蛋白/β-actin比值作为蛋白表达水平。
2.5 BrdU掺入法检测VSMCs增殖水平 选取3~6代VSMCs接种于96孔培养板(每孔2×103个细胞),待细胞生长至60%~70%汇合时弃培养基,用无血清M199培养液洗涤2次,加入0.9 mL含0.5%FBS的M199培养液培养24 h,在干预的同时加每孔10µL 10×BrdU原液孵育24 h。弃上清,PBS漂洗1次,4%甲醛固定30 min,弃固定液,PBS漂洗3次,加HRP标记的BrdU抗体(1∶100)于37℃孵育1 h,PBS漂洗3次,每孔加反应液100 µL,37℃孵育10~20 min,加终止液,酶标仪检测吸光度(A)值(波长450 nm),以A值表示细胞增殖水平。
3 统计学处理
采用SPSS 19.0软件进行实验数据分析处理,结果以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析(one-way ANOVA),两两比较使用最小显著性差异(least significant difference,LSD)法。以P<0.05为差异有统计学意义。
结 果
1 Bex对ApoE-/-小鼠生化指标的影响
与C57BL/6组相比,ApoE-/-组小鼠空腹血清甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平均显著增加(P<0.01),但ApoE-/-组、ApoE-/-+Bex5组和ApoE-/-+Bex10组之间TG、TC和LDL-C水平均无显著差异(P<0.05);各组间高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、天门冬氨酸转氨酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)、肌酸激酶(creatine kinase,CK)、血尿素氮(blood urea nitrogen,BUN)及血清肌酐(serum creatin,SCr)水平均无显著差异(P>0.05),见表1。
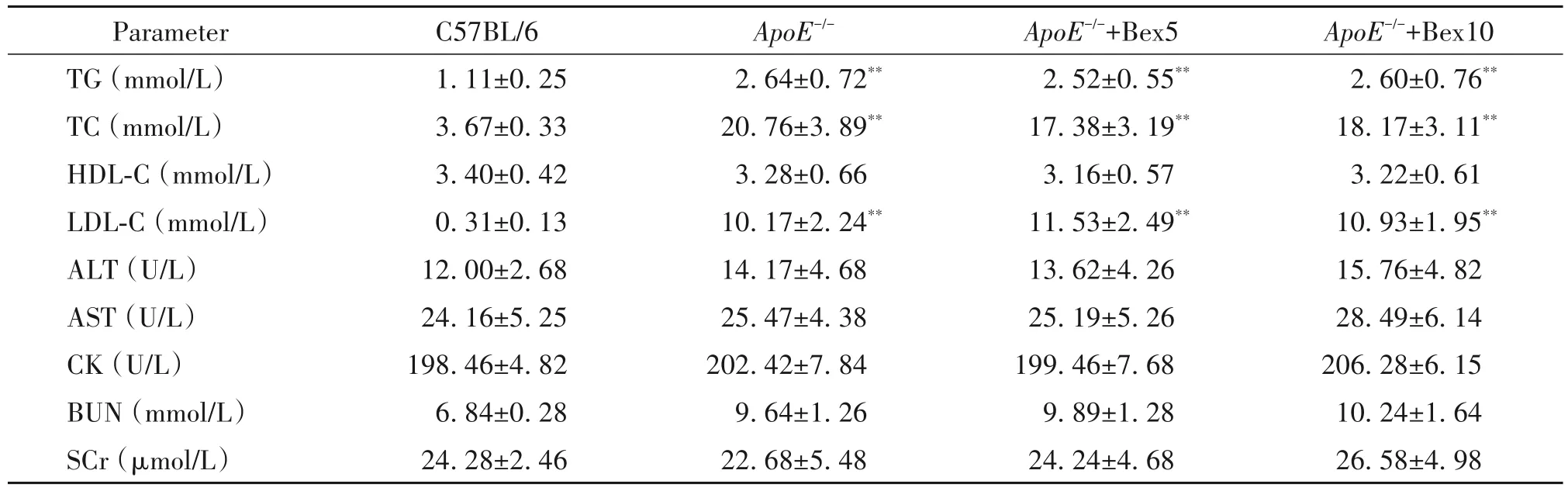
表1 Bex对ApoE-/-小鼠生化指标的影响Table 1.Effects of Bex on blood biochemical parameters of ApoE-/-mice(Mean±SD.n=10)
2 Bex抑制ApoE-/-小鼠胸主动脉内膜粥样斑块的形成
C57BL/6组小鼠的血管内膜光滑,未见脂质斑块形成;ApoE-/-小鼠血管内膜可见巨大硬化斑块突起,中膜厚薄不均,斑块内及底部可见大量组织增生;ApoE-/-+Bex5组和ApoE-/-+Bex10组小鼠血管壁中膜较为规则,内膜斑块较小,斑块周围及底部只见少量组织增生。斑块面积分析:与C57BL/6组相比,ApoE-/-组血管内膜斑块面积显著增大(P<0.01);与ApoE-/-组相比,ApoE-/-+Bex5组及ApoE-/-+Bex10组斑块面积显著减小(P<0.01);ApoE-/-+Bex10组与ApoE-/-+Bex5组相比斑块面积显著减小(P<0.05)。见图1。
3 Bex对 ApoE-/-小鼠胸主动脉 TGF-β1、p-Smad2及Smad2蛋白水平的影响
与C57BL/6组相比,ApoE-/-组小鼠胸主动脉的TGF-β1和p-Smad2水平均显著增加(P<0.01);Bex可增加胸主动脉p-Smad2水平,表现为ApoE-/-+Bex5和ApoE-/-+Bex10组小鼠胸主动脉的p-Smad2水平较ApoE-/-组显著增加(P<0.01),且ApoE-/-+Bex10组p-Smad2水平显著高于ApoE-/-+Bex5组(P<0.01);但ApoE-/-组、ApoE-/-+Bex5组和ApoE-/-+Bex10组之间TGF-β1和Smad2的表达均无显著差异(P>0.05),见图2。
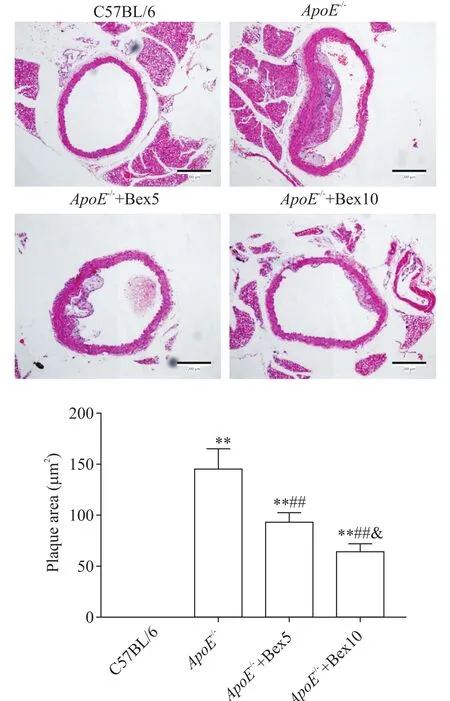
Figure 1.Bex treatment decreased plaque size in the thoracic aorta of ApoE-/-mice(HE staining,scale bar=200µm).Mean±SD.n=10.**P<0.01 vs C57BL/6 group;##P<0.01 vs ApoE-/-group;&P<0.05 vs ApoE-/-+Bex5 group.图1 Bex抑制ApoE-/-小鼠胸主动脉内膜粥样斑块的形成
4 Bex和Smad2磷酸化抑制剂A83-01均可抑制TGF-β1诱导的VSMCs增殖
BrdU掺入率检测结果显示,TGF-β1(0.1~10µg/L)呈浓度依赖性促进VSMCs增殖,当TGF-β1干预浓度达到5µg/L时,BrdU掺入率达到高峰,见图3A。Bex则呈浓度依赖性抑制TGF-β1(5µg/L)诱导的VSMCs增殖,与TGF-β1组相比,Bex(10-7mol/L)+TGF-β1组VSMCs的BrdU掺入率显著降低(P<0.01);当用Smad2磷酸化抑制剂A83-01(20 nmol/L)预处理VSMCs后,TGF-β1诱导的VSMCs增殖效应亦被显著抑制(P<0.01),见图3B。
5 Bex促进VSMCs中TGF-β1诱导的Smad2磷酸化
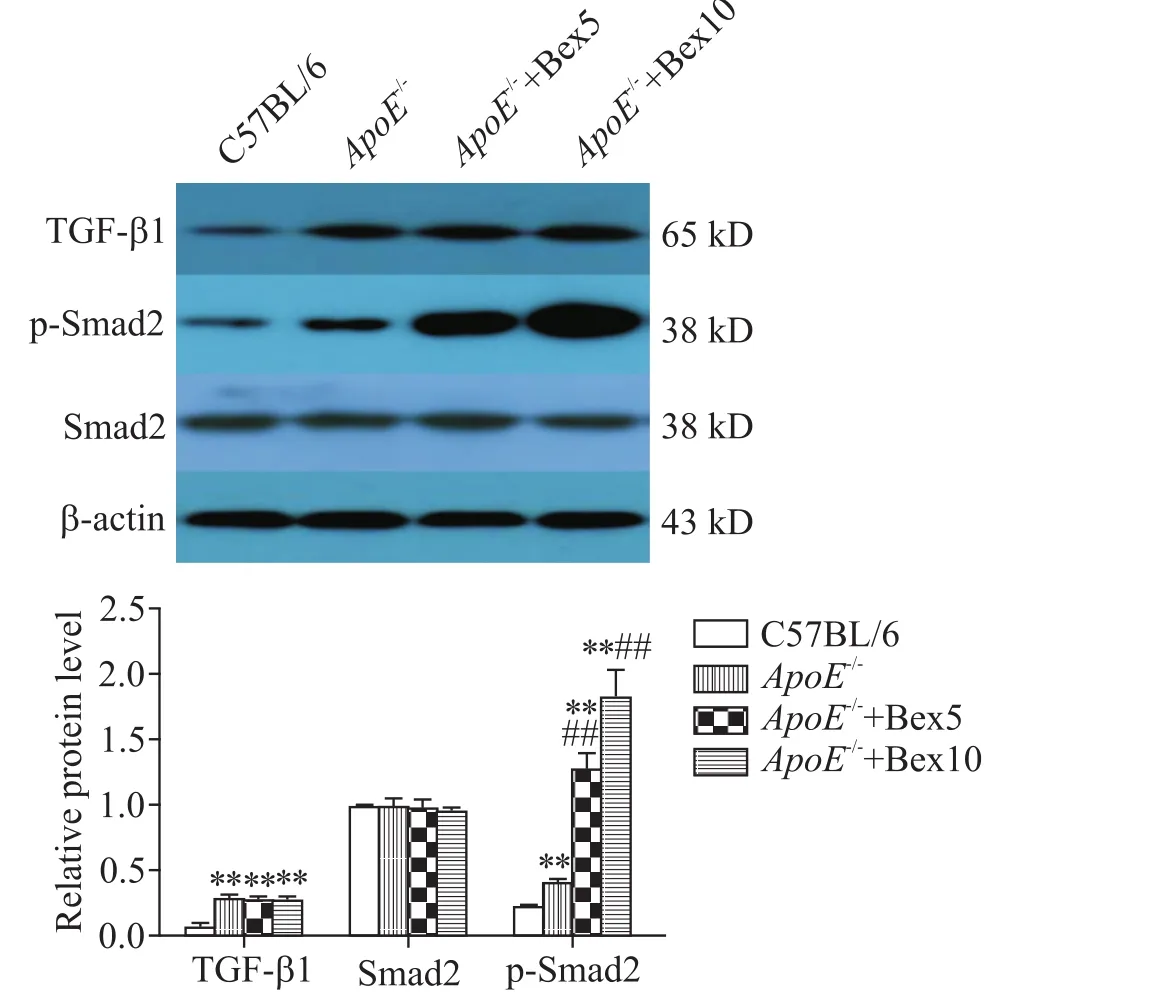
Figure 2.Effects of Bex on the protein levels of TGF-β1,p-Smad2 and Smad2 in thoracic aorta tissues of ApoE-/-mice.Mean±SD.n=10.**P<0.01 vs C57BL/6 group;##P<0.01 vs ApoE-/-group.图2 Bex对 ApoE-/-小鼠胸主动脉 TGF-β1、p-Smad2及Smad2表达的影响
当用 TGF-β1(5 µg/L)干预 VSMCs 60~90 min时,细胞内p-Smad2蛋白水平显著增加(P<0.01),但未对Smad2总蛋白水平产生影响,见图4A。当用Bex(10-7mol/L)预处理VSMCs后,再予TGF-β1诱导VSMCs 60 min,p-Smad2蛋白水平则显著增加(P<0.01),但各组间Smad2总蛋白水平无显著差异(P>0.05),见图4B。
6 Bex抑制VSMCs中TGF-β1诱导的p-Smad2核转位
提取各组细胞总蛋白并分离和纯化胞质和胞核蛋白,Western blot结果显示,与对照组相比,TGF-β1(5µg/L)组VSMCs胞质及胞核的p-Smad2水平均显著升高(P<0.01);但与 TGF-β1(5 µg/L)组相比,TGF-β1(5 µg/L)+Bex(10-7mmol/L)组 VSMCs胞质的p-Smad2水平显著升高(P<0.01),胞核的p-Smad2水平却显著降低(P<0.01);各组细胞的胞质或胞核Smad2水平均无显著差异(P>0.05),见图5。
讨 论
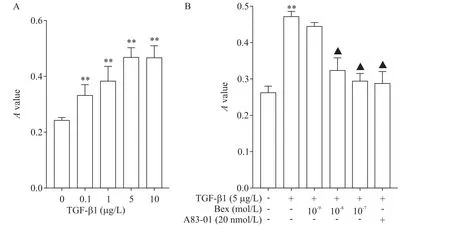
Figure 3.Bex and Smad2 phosphorylation inhibitor A83-01 inhibited TGF-β1-induced proliferation of VSMCs.A:the VSMCs were incubated with TGF-β1(0~10 µg/L)and BrdU(1 mg/L)for 24 h,and the proliferation activity was determined;B:the VSMCs were pretreated with the indicated concentration of Bex for 30 minutes and then exposed to TGF-β1(5 µg/L)and Brdu(1 mg/L)for 24 h.Mean±SD.n=8.**P<0.01 vs control(0 µg/L TGF-β1)group;▲P<0.05 vs TGF-β1(5 µg/L)group.图3 Bex及Smad2磷酸化抑制剂A83-01抑制TGF-β1诱导的VSMCs增殖
ApoE-/-小鼠已被广泛应用于高脂血症和AS及其并发症的研究。本研究结果显示,与C57BL/6组相比,ApoE-/-小鼠的血清TG、TC和LDL-C水平均显著增高,胸主动脉内膜有巨大的粥样斑块形成及中膜平滑肌层大量增生。ApoE-/-小鼠AS的发生除与血脂异常有关外,血管中膜平滑肌层细胞增生在其形成和发展过程中也起重要作用[1-3]。血脂异常升高,血管内膜脂质沉积,血管中膜平滑肌层细胞增生是AS发生和发展共同的病理基础[13]。在本研究中,当ApoE-/-小鼠给予RXRα激动剂Bex治疗时,Bex可呈剂量依赖性的抑制ApoE-/-胸主动脉内膜脂质斑块的形成,减少动脉硬化斑块面积,抑制斑块周围及底部中膜平滑肌层增生。由于Bex治疗未对ApoE-/-小鼠血脂产生显著影响,我们推测RXRa激动剂Bex改善ApoE-/-小鼠AS机制可能与降脂效应无关。
我们前期观察到阿托伐他汀可通过RXRα抑制内皮细胞氧化应激,减少ApoE-/-小鼠胸主动脉AS斑块面积,这一结果表明RXRα参与该过程并发挥介导作用,且可能是机体AS形成的内源性保护因素[10]。已有研究显示,动脉内膜损伤可触发组织炎症和氧化应激反应,通过激活TGF-β1/Smad2信号通路促进VSMCs增殖与基质合成,抑制TGF-β1/Smad2活性可削弱上述效应,改善血管重构,减少动脉硬化的发生,因此,TGF-β1/Smad2是VSMCs增殖和基质合成的重要调控通路[2,14-15]。我们也观察到 ApoE-/-小鼠胸主动脉的TGF-β1和p-Smad2蛋白水平均显著增加,同时也观察到胸主动脉平滑肌层不规则增厚,斑块周围及底部有大量细胞增生,再次证明了VSMCs增殖是ApoE-/-小鼠动脉粥样斑块形成的重要机制之一,且VSMCs增生与TGF-β1/Smad2信号通路活化有关。既往研究已证实TGF-β1增加p-Smad2水平促进VSMCs细胞增生。在实验中,Bex治疗未改变ApoE-/-小鼠胸主动脉的TGF-β1含量,但p-Smad2磷酸化水平显著增高,同时动脉中膜变薄,斑块内增生组织减少,斑块面积缩小,我们在体外细胞实验也观察到Bex可增加VSMCs中TGF-β1诱导的p-Smad2水平,却使其增殖水平降低,这结果与既往认为的p-Smad2水平增加促进细胞增殖不一致,我们推测Bex发挥上述细胞学效应还可能存在其他重要机制。有研究者在TGF-β1/Smad2信号通路与细胞增殖研究中发现细胞增殖不仅与Smad2磷酸化水平有关,还与p-Smad2细胞核转位有关[15-16]。我们推测核受体RXRα可能通过抑制p-Smad核转位从而抑制TGF-β1信号传导。也有研究RXRα受体激动后能增加TGF-β1上调p-Smad2的水平,但抑制p-Smad2向细胞核转位,抑制TGF-β1/Smad2通路的促细胞增殖活性[17-18]。我们在RXRα调控大鼠心肌成纤维细胞胶原合成的相关研究中也检测到RXRα活化显著增加TGF-β1诱导的成纤维细胞胞浆p-Smad2水平,但抑制p-Smad2核转位进而抑制成纤维细胞胶原合成[19]。因此,我们推测Bex增加ApoE-/-小鼠胸动脉p-Smad2水平却抑制动脉中膜VSMCs增生可能与RXRα抑制p-Smad2核转位有关。

Figure 4.Effects of Bex on TGF-β1-induced Smad2 phosphorylation in VSMCs.A:TGF-β1(5 µg/L)induced Smad2 phosphorylation in the VSMCs;B:the VSMCs were treated with Bex(10-7mmol/L)for 30 min and then exposed to TGF-β1(5 µg/L)for 60 min.Mean±SD.n=4.**P<0.01 vs control group;△△P<0.01 vs TGF-β1(5 µg/L)group.图4 Bex对TGF-β1诱导的VSMCs中Smad2磷酸化的影响
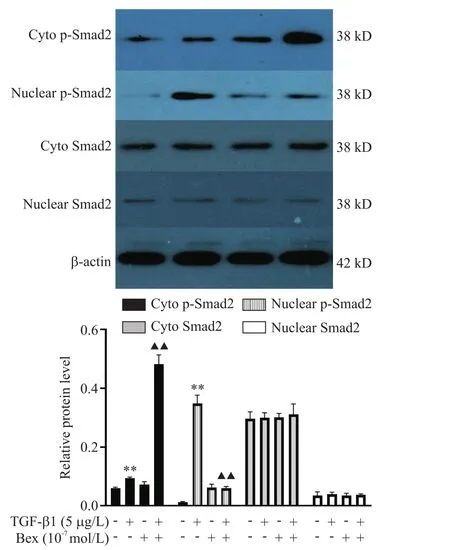
Figure 5.Bex inhibited nuclear translocation of p-Smad2 induced by TGF-β1 in VSMCs.The VSMCs were treated with Bex(10-7mmol/L)or TGF-β1(5 µg/L)for 60 min,or pretreated with Bex(10-7mmol/L)followed by exposure to TGF-β1(5 µg/L)for 60 min.Nuclear,cytosolic(Cyto)and total extracts were prepared and analyzed by Western blot.Mean±SD.n=5.**P<0.01 vscontrolgroup;▲▲P<0.01vsTGF-β1(5µg/L)group.图5 Bex抑制VSMCs中TGF-β1诱导的p-Smad2核转位
体外细胞实验结果显示,RXRa激动剂Bex可抑制 TGF-β1诱导 VSMCs增殖,并协同 TGF-β1增加VSMCs胞浆p-Smad2水平,而VSMCs胞核内p-Smad2水平显著降低;另外p-Smad2抑制剂A83-01也能显著降低TGF-β1诱导的VSMCs细胞增殖水平,这一结果也证实了TGF-β1诱导VSMCs细胞增殖水平与VSMCs的p-Smad2总水平有关,也说明p-Smad2只有在细胞核内才能发挥调节细胞增殖的作用。既往研究已显示,细胞在静息状态下,Smad2蛋白主要位于细胞胞浆中,但当Smad2被外来信号刺激后,Smad2蛋白迅速磷酸化并向胞核内聚集从而介导细胞转录活性[18-20]。Cao等[18]在体外培养的NIH-3T2细胞中发现RXRa受体激动后可与Smad2结合形成二聚体,可协同TGF-β1诱导增加p-Smad2水平,但p-Smad2未能与RXRa分离,限制p-Smad2从胞质向胞核内聚集,导致p-Smad2介导的转录作用失活,这进一步说明Smad2活性不但与其磷酸化水平有关,而且与p-Smad2是否在胞核内集聚有关。因而Bex虽增加TGF-β1诱导的VSMCs胞浆p-Smad2水平,但可抑制p-Smad2核转位,从而消除TGF-β1诱导VSMCs增殖的作用。
综上所述,本研究结果显示RXRα受体激动剂Bex具有抗AS作用,且通过调控TGF-β1/Smad2通路p-Smad2核转位抑制胸主动脉VSMCs增生可能是其重要机制。

