猪蓝耳病蛋白表达实验
任晓晔
(苏州市动物卫生监督所,江苏苏州 215000)
1 切胶回收PCR产物
1.1 试剂组成
凝胶溶化剂、结合液、洗涤液、去盐液、洗脱液
1.2 注意事项
尽量切去含有DNA片段的凝胶,切胶动作要迅速;凝胶块必须完全溶化;
在洗脱时,洗脱液加热至65℃,提高洗脱率。
1.3 操作步骤
(1)取大约150ul的PCR产物。
(2)在紫外灯下切下含有DNA片段的凝胶并切碎,装入1.5ml的离心管中。
(3)加入3个体积的溶化剂,混合均匀水浴锅加热至凝胶完全融化。
(4)加入0.5个熔化剂体积的结合液,混合均匀。蓝耳病片段大小为372bp因此要加入要加入1个凝胶体积的异丙醇。
(5)放入制备管12000r/m,离心1min,弃滤液。
(6)加入500µl 洗涤液,12000r/m,离心30s,弃滤液
(7)加入700µl 去盐液,12000r/m,离心30s,弃滤液。
(8)将制备管放入新的1.5ml离心管中,加入25µl的洗脱液,室温静至1min,12000r/m,离心1min洗脱DNA。
2 插入表达载体pEASY-E1
吸取胶回收到的PCR产物4µl,加入pEASY-E1 1ul,轻轻混匀,为增加阳性克隆的机率室温30℃反应10min,反应结束后置于冰上。
3 转化
3.1 实验准备
(1)LB:酵母膏5g、蛋白胨10g、氯化钠10g定容至1L 。
(2)LB培养基:酵母膏5g、蛋白胨10g、氯化钠10g、琼脂15g定容至 1L 。
(3)浓度100mgml的 氨苄青霉素。
(4)耗材:冰盒、培养皿、接种棒、酒精灯等。
(5)仪器:干式恒温器、微型振荡培养箱、水浴锅。
(6)试剂:Transl-T1感受态细胞。
3.2 注意事项
(1)LB及LB培养基、超纯水、枪头、脂形管和培养皿高压灭菌30min。
(2)实验前双手消毒,操行台灭菌。
(3)实验中使用的耗材要在酒精灯火焰上灭菌。
(4)细菌涂板要均匀,并倒放。
3.3 操作步骤
(1)在培养基凝固前倒入培养皿中。4℃保存备用,倒放。
(2)加上一步骤中的产物50µl在感受态细胞中,轻弹混匀,冰浴 20~30min。
(3)42℃准确热激30s,立即置于冰上。
(4)加入250µl平衡至室温的LB,置于摇床上200转,37℃孵育1h。
(5)在铺好的培养皿上先涂25µl AMP。
(6)取菌液涂板,铺2块,25µl一块,37℃过夜培养。
(7)用接种棒挑取单个菌落进行扩大培养,两块板共取16个单个菌落,放入1ml LB中,37℃、200转培养1h。
(8)鉴定菌落是否是阳性,吸取再培养的菌液2µl跑PCR,16个菌落中2、8、9、13号出现条带,并吸取每个250µl菌液送去测序。PCR法可行,但不一定成功,因为Tm的退火温度不一定,最终要以测序结果为准。
(9)取上述阳性菌种再培养,涂板,37℃过夜培养。
(10)挑取再培养的菌落,放入10ml的LB中,37℃200转4h培养,提质粒时使用。
4 提取质粒插入表达载体
4.1 试剂组成
溶液P1、P2、P3、平衡液、去蛋白液、漂洗液、洗脱液。
4.2 操作步骤
(1)在吸附柱中加入500µl的平衡液,12000转离心1min。
(2)取5ml菌液,12000转离心1min,弃上清。
(3)加250µl的P1,混匀。
(4)加 250µl的P2,温和地上下翻转6~8次。
(5)加350µl的P3,温和地上下翻转6~8次,充分混匀,出现白色絮状物,再12000转离心10min,取上清。
(6)将上清放入吸附柱中,12000转离心30s,弃废液。
(7)加500µl去蛋白液,12000转离心30s,弃废液。
(8)加600µl漂洗液,12000转离心30s,弃废液,重复一次。
(9)吸附柱直接12000转离心2min,开盖静至5min。
(10)将吸附柱放入新的离心管中,加50µl洗脱液,室温静置2min,12000转离心2min。
5 插入BL21感受态细胞步骤同上。
6 IPTG的诱导表达——通过不同的诱导时间决定最佳的表达条件
6.1 实验步骤
(1)取一支冻存的阳性菌种加入1ml LB复苏。
(2)取4支15ml脂形管(编号为1、2、3、4号)分别放入10ml LB(每支加10µl Amp),每支加入复苏菌液50ml,37℃200转培养直到OD600时的读数为0.6~1.0时,从1号中吸取2ml做对照。
(3)将 2、3、4号加入IPTG(浓度为50mg/ml,每8ml中加16µl IPTG),37℃培养。2h后取出2号菌液1ml备用。
(4)1h后取出3号菌液1ml备用,1h再后取出4号菌液。
(5)将上述吸出的菌液12000转离心2min,吸出上清,沉淀用20mM PB溶解,上清和沉淀 -20℃保存。
(6)反复冻融上清和细菌沉淀3次以上。
7 SDS-page电泳
7.1 电泳液
成品SDS-page电泳液直接加入1L超纯水。
7.2 制胶
12%的分离胶+5%的浓缩胶(表1)。
7.3 实验步骤
(1)先配置分离胶,按顺序加入溶液,每加完一个摇晃一下。
(2)TEMED在通风橱中加,加入后混匀30s后再注胶,不要有气泡,分离胶注好后用水封顶,聚合40min。
(3)加入浓缩胶后插梳子,斜着插入,避免气泡,聚合40min。
(4)分离胶和浓缩胶界面做好标记,分离胶加8.5ml,浓缩胶加1.5ml。
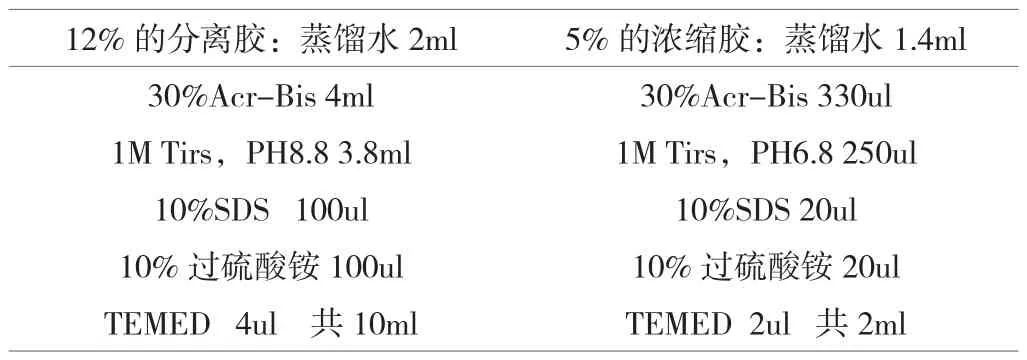
表1
7.4 上样
(1)把之前反复冻融的菌液和上清取出,解冻后各取10µl,加入2µl的上样缓冲液。
(2)将样品和蛋白Marker100℃水浴5min,冷却到室温后上样缓慢加入。
7.5 跑电泳
(1)电泳槽里面加电泳液加到上样孔,外面加1/3的电泳液。
(2)电压80V,等蓝色条带进入分离胶后调到120V。
(3)待条带距离分离胶底部1cm处停止电泳。
7.6 切胶
将浓缩胶全部切除,为了分辨正反在将分离胶的右下角切去。
7.7 染色和脱色
(1)将胶体放入染色液中,染色液要充分覆盖胶体,置于摇床上缓慢摇晃1h。
(2)倒出染色液,倒入脱色液,置于摇床上缓慢摇晃,室温脱色4~24h,期间更换脱色液2~4次,直到看清条带。(图1)
8 讨论
(1)1号样品到4号样品为上清,5号样品到8号样品为细菌 沉淀,5号样品未加IPTG,6号样品为加IPTG后2h,7号样品为加入后3h,8号样品为加入后4h
(2)根据条带可看出,1号样品至4号样品上清是没有条带的,5号样品只至8号样品细菌沉淀出现条带,7号和8号样品的目的条带较明显,因此暂定加入IPTG后3h为最佳诱导时间,并进行第二次实验。(图2)
9 实验结果
五个样本均出现了较为清晰目的条带,实验成功,可进行下一步工作,优化蛋白表达,纯化目的蛋白。
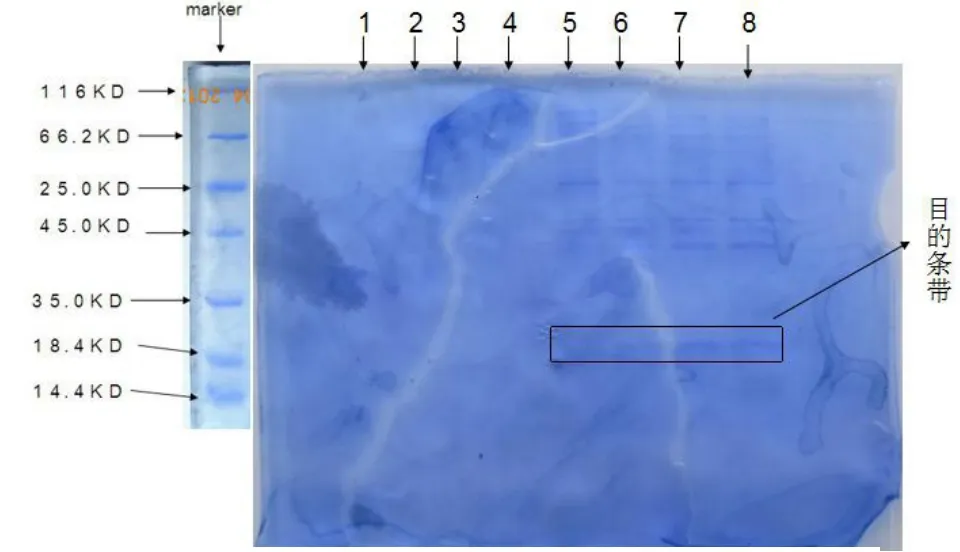
图1
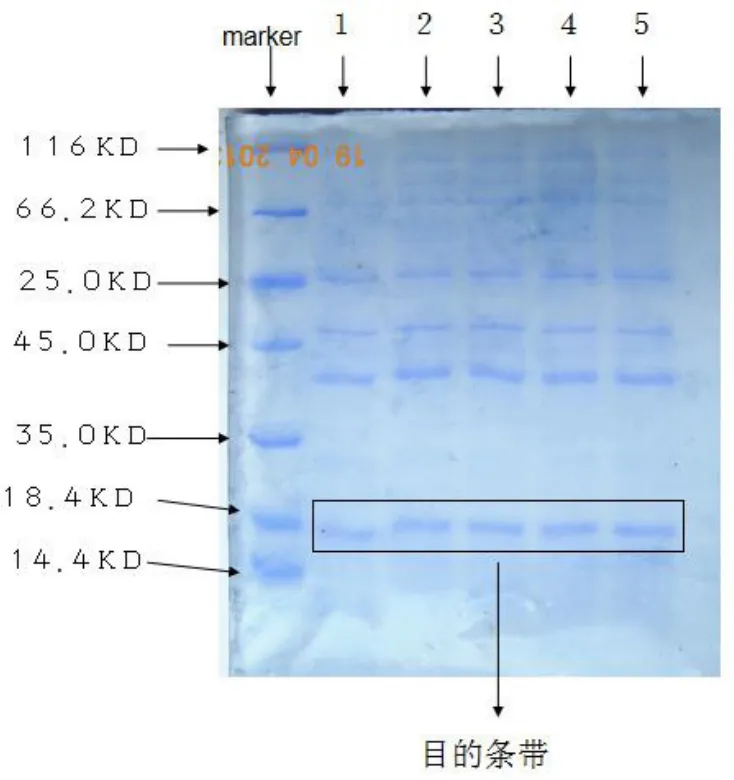
图2

