基于高分辨质谱和代谢组学技术评估和优化蜂王浆代谢物提取方法
张丽翠,马川,冯毛,李建科
(中国农业科学院蜜蜂研究所,北京 100093)
0 引言
【研究意义】蜂王浆是由工蜂上颚腺和咽下腺等腺体共同分泌的乳白色或淡黄色的浆状物质[1],是工蜂用来饲喂 1—3日龄蜜蜂幼虫和饲喂蜂王终生的食物。蜂王浆是一种对人类健康具有重要作用的天然功能食品,具有调节血压、增强免疫力、抗菌消炎、抗肿瘤等药理功效[2-3],其营养价值越来越受到人们的关注。蜂王浆成分复杂,主要包括水分、蛋白质、脂类、氨基酸、糖类、维生素等[2,4],其丰富的生物活性成分是蜂王浆具有医疗保健功效的物质基础。代谢组学是对生物体、器官、组织或细胞中的代谢物进行全面系统鉴定和分析的技术[5],该技术在食品领域的应用,可对食品中的小分子组分进行整体定性和定量分析,为食品质量安全提供技术支撑[6]。代谢物的提取是代谢组学研究中至关重要的步骤[7-8],直接影响了可检测的代谢物范围[9]以及代谢物提取的数量[10]。因此,建立简单易行且高效的蜂王浆代谢物的提取方法,获得更加全面的代谢物种类和数量,对蜂王浆质量评价和功能开发利用具有重要意义。【前人研究进展】目前对蜂王浆小分子化合物的鉴定分析已有大量报道,ISIDOROV等[11]检测了蜂王浆中的挥发性成分和有机溶剂萃取成分,PINA、VIRGILIOU 等[12-13]靶向测定了蜂王浆中的亲水性化合物,但大多数研究只针对蜂王浆中的某一类化合物,如氨基酸[14-16]、糖[16-17]、有机酸[18]、维生素[19-20]及核酸[21-22]。从分析方法来看,以上研究主要基于气相色谱-质谱联用技术(GC-MS)、气相色谱火焰-离子化检测器(GC-FID)、高效液相色谱-荧光检测技术(HPLC-FLD)等。气相色谱相关技术检测范围小,只能检测挥发性化合物和衍生化后形成的挥发性化合物[23]。超高效液相色谱-高分辨质谱技术(UPLC-HRMS)具有更高的分辨率和灵敏度,通过选择不同的分离色谱柱可以实现从非极性到极性代谢物的全面检测,其中反相液相色谱(reverse phase liquid chromatography,RPLC)能够很好地分离非极性和中低极性化合物,但对强极性化合物的保留和分离能力较弱,而亲水相互作用色谱(hydrophilic interaction liquid chromatography,HILIC)对强极性化合物有较好的分离和保留,具有与 RPLC互补的选择性[24-27]。因此,RPLC和 HILIC相结合可以扩大代谢物的分离检测范围,与质谱联用后可获得更全面的代谢物种类及含量的信息。但 UPLC-HRMS技术在蜂王浆代谢物研究中的应用非常有限,而且只进行了靶向分析[12-13],非靶向的 RPLC-HRMS和HILIC-HRMS以及二者同时应用到蜂王浆中的研究还未有报道。代谢组学研究中,溶剂提取法是广泛使用的代谢物提取方法,目前常用的样品提取溶剂有甲醇、乙醇、乙腈以及与水组成的混合溶剂提取体系,不同溶剂对代谢物的提取会产生不同的影响[28-30]。蜂王浆代谢成分复杂,化学性质和丰度差异大,提取溶剂的选择至关重要,目前常用的提取溶剂有90%乙醇[14]、50%甲醇[12-13]、100%甲醇[16]及 50%乙腈[31]等,但缺乏系统的比较研究。【本研究切入点】分别基于RPLC和HILIC联合Q-Exactive Orbitrap HRMS以及代谢组学分析技术对蜂王浆中的小分子化合物进行全面分析,通过多元统计分析比较不同浓度(50%和 80%)的甲醇、乙醇和乙腈对蜂王浆代谢物的提取效果,优化蜂王浆代谢物的提取方法。【拟解决的关键问题】建立并优化蜂王浆小分子化合物成分的高效提取方法,对蜂王浆中的小分子化合物进行全面解析,为后续蜂王浆代谢组学研究提供技术支持。
1 材料与方法
试验于 2019年在中国农业科学院蜜蜂研究所完成。
1.1 化学试剂
质谱级乙腈(A955-4)、质谱级甲醇(A456-4)、质谱级乙醇(24102)、色谱级甲酸(50144)和甲酸铵(A115-50)购自Fisher Scientific,超纯水由Milli-Q纯水机制备,化合物标准品购自Sigma。
1.2 仪器设备
质谱仪(Q-Exactive),美国 Thermo Fisher Scientific公司;超高效液相色谱系统(Ultimate 3000),美国Thermo Fisher Scientific公司;台式低温离心机(Microfuge 22R Centrifuge),美国BeckMAN CoulTER公司;电子分析天平(PL203,0.1 mg),德国 METTLER TOLEDO公司;超低温冰箱(MDF-U3286S),日本SANYO公司;非接触超声波细胞粉碎机(Scientz08-III),宁波 SCIENTZ公司;快速低温冷却循环机(DLK-2007),宁波SCIENTZ公司。
1.3 样品采集
以饲养于中国农业科学院蜜蜂研究所养蜂基地的蜂王浆高产蜜蜂作为试验蜂群,蜂王购买于浙江省。参考常用的蜂王浆生产方法[32-34]获得蜂王浆样品:准备并清理含有63个塑料王台的产浆条,移取1日龄小幼虫至王台中,将该产浆条固定在产浆框后放至所选取的蜂群继箱中,72 h后取出产浆框,割除蜡盖并移走王台中的幼虫后,收集蜂王浆于1.5 mL离心管,保存于-80℃冰箱中备用。
1.4 代谢物提取
利用6种不同有机溶剂(50%和80%甲醇、50%和80%乙醇、50%和80%乙腈)分别提取蜂王浆中的代谢物,每种提取方法6个平行样。将冻存的蜂王浆样品置于冰上充分解冻,均质化后,准确称取0.1 g至4 mL棕色进样瓶中,加入4 mL溶剂,超声40 min,使样品充分溶解,取1.4 mL样品混合液转移到1.5 mL离心管中,4℃条件下12 000 r/min离心20 min,取上清液用0.22 μm有机相滤膜过滤,收集到2 mL棕色进样瓶中供UPLC-MS分析。每个样品分别取30 μL,混合到2 mL棕色进样瓶中,作为质量控制(QC)样品。空白对照只加入 6种有机溶剂的混合液,其他操作流程与样品处理完全一致。
1.5 UPLC-MS分析
RPLC方法:ZORBAX SB-Aq C18反相色谱柱(Agilent,100 mm×2.1 mm,1.8 μm);进样量3 μL;柱温40℃;流动相A为0.1%甲酸-水溶液,流动相B为0.1%甲酸-乙腈;流速0.3 mL·min-1。梯度洗脱:0—2 min,95%—70% A;2—8 min,70%—15% A;8—9 min,15%—15% A;9—9.5 min,15%—95% A;9.5—13 min,95%—95% A。
HILIC方法:ACQUITY BEH Amide色谱柱(Waters,150 mm×2.1 mm,1.7 μm);进样量3 μL;柱温50℃;流动相A为30%乙腈溶液(含0.1%甲酸和10 mmol甲酸铵),流动相B为95%乙腈溶液(含0.1%甲酸和10 mmol甲酸铵);流速0.3 mL·min-1。梯度洗脱:0—2 min,0—0 A;2—8 min,0—80% A;8—9 min,80%—80% A;9—9.5 min,80%—0 A;9.5—13.5 min,0—0 A。
质谱条件:采用 HESI离子源,在正、负离子切换模式下采集,参数设置如下:离子源温度 320℃,喷雾电压3.5 kV(ESI+)和3.0 kV(ESI-),鞘气流速40 arb,辅助气流速5 arb,S-lens射频电压60%,母离子扫描分辨率70 000,扫描范围70—1 000 m/z,自动增益控制目标离子数1×106,最大离子注入时间50 ms,扫描速率1 scan/s。为了鉴定化合物,需要进行数据依赖型二级扫描,参数设置如下:扫描分辨率17 500,自动增益控制目标离子数1×105,最大离子注入时间50 ms,TopN为10,信号强度阈值2×106,动态排除8 s,顶点激发2—7 s,归一化碰撞能量(NCE)为15%、40%和60%。先进10针QC样品,以平衡系统,此数据不用于后续分析。所有的蜂王浆样品顺序随机打乱,以减小系统误差。为了检测系统的稳定性及校正数据,每9个样品之间进1针QC样品。通过Xcalibur软件(Thermo Fisher Scientific)收集MS和MS/MS数据并保存为Raw格式文件。
1.6 数据处理与分析
将Raw文件导入Compound Discoverer 2.1软件(Thermo Fisher Scientific)进行离子峰识别、峰对齐、峰面积归一化处理及数据库搜索。参数设置如下:最大允许偏移时间0.2 min,质量允许偏差5 ppm,信噪比阈值3,峰响应强度最小值1×106,样品与空白比值5,基于QC峰面积进行校正,QC覆盖范围>50%且QC峰面积相对标准偏差<30%。根据精准质量数及 MS/MS质谱图的离子碎片信息,使用HMDB(http://www.hmdb.ca/)、mzCloud(https://www.mzcloud.org/)、ChemSpider(http://www.chemspider.com/)、LIPID MAPS(http://lipidmaps.org/)和 KEGG(http://www.genome.jp/kegg/)数据库进行化合物鉴定,确定可能的化合物,购买相应的标准品并进行二级质谱分析,进一步验证。采用SIMCA 14.0软件,进行多变量统计分析:经Pareto-scaling处理和log转换后进行PCA分析,可直观上反应各组样本的空间分布,从总体上反映样本之间的代谢谱差异;经Paretoscaling处理后,采用正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),在建模过程中对模型数据进行置换检验并计算变量投影重要度(variable importance in the projection,VIP)。VIP>1.0且单变量统计分析(Student’st-test)中P<0.05 和倍数变化(fold change,FC)>1.2的代谢物作为具有显著差异的代谢物。使用Cluster和Treeview软件进行已定性化合物的聚类热图分析。计算代谢特征离子和已定性化合物在同一溶剂6个技术重复的峰面积的RSD,以检测不同溶剂提取过程的稳定性。
2 结果
2.1 分析系统的稳定性
将RPLC和HILIC条件下QC样品的总离子流图分别进行叠加,结果显示色谱峰的保留时间及信号响应强度高度重叠(图1)。在RPLC和HILIC条件下检测到的代谢特征离子的数量分别是955和1 113个,基于这些代谢特征离子的PCA分析表明,所有QC样品聚集紧密(图2)。
2.2 化合物鉴定
通过数据库代谢物谱图信息比对及标准品验证,在RPLC和HILIC条件下分别鉴定到50和51种高丰度化合物,两者共有的化合物有31种。脂类等中低极性化合物,包括两组同分异构体(3-羟基癸酸与 10-羟基癸酸,11-羟基十二烷酸与12-羟基十二烷酸),在RPLC条件下得到较好的分离;而氨基酸、糖类等强极性化合物,包括葡萄糖与果糖等同分异构体,在HILIC条件下分离良好。在蜂王浆样品中共鉴定到70种化合物(53种经过标准品验证),涵盖了糖类、氨基酸、脂类、维生素等,其丰度差异高达8 340倍,其中有17种化合物为本研究首次报道(表1)。
2.3 不同溶剂的提取效果
首先,比较了不同溶剂提取蜂王浆得到的代谢特征离子的数量和RSD值。使用50%和80%乙腈、50%和80%乙醇、50%和80%甲醇,在RPLC条件下分别鉴定到817、808、878、889、879和932个代谢特征离子,在HILIC条件下分别鉴定到799、752、857、869、805和865个代谢特征离子。可以看出,利用乙腈溶剂得到的代谢特征离子数量最少,与50%乙腈相比,80%乙腈提取效果更差。对甲醇和乙醇而言,高浓度时的代谢特征离子数量更多,浓度变化对甲醇的影响更大。所有溶剂组的特征离子RSD值具有相似的分布模式,集中分布在20%范围内,但80%乙腈组在10%内的占比最低(图3)。
其次,通过计算70种代谢物峰面积的RSD值,进一步检测溶剂提取过程的稳定性(图 4)。80%乙腈组的RSD值主要集中在5%—10%范围内,其次为0—5%,有11种代谢物的RSD值>15%。其他5种溶剂组的 RSD值分布模式相似,主要集中在 0—5%和5%—10%范围内。
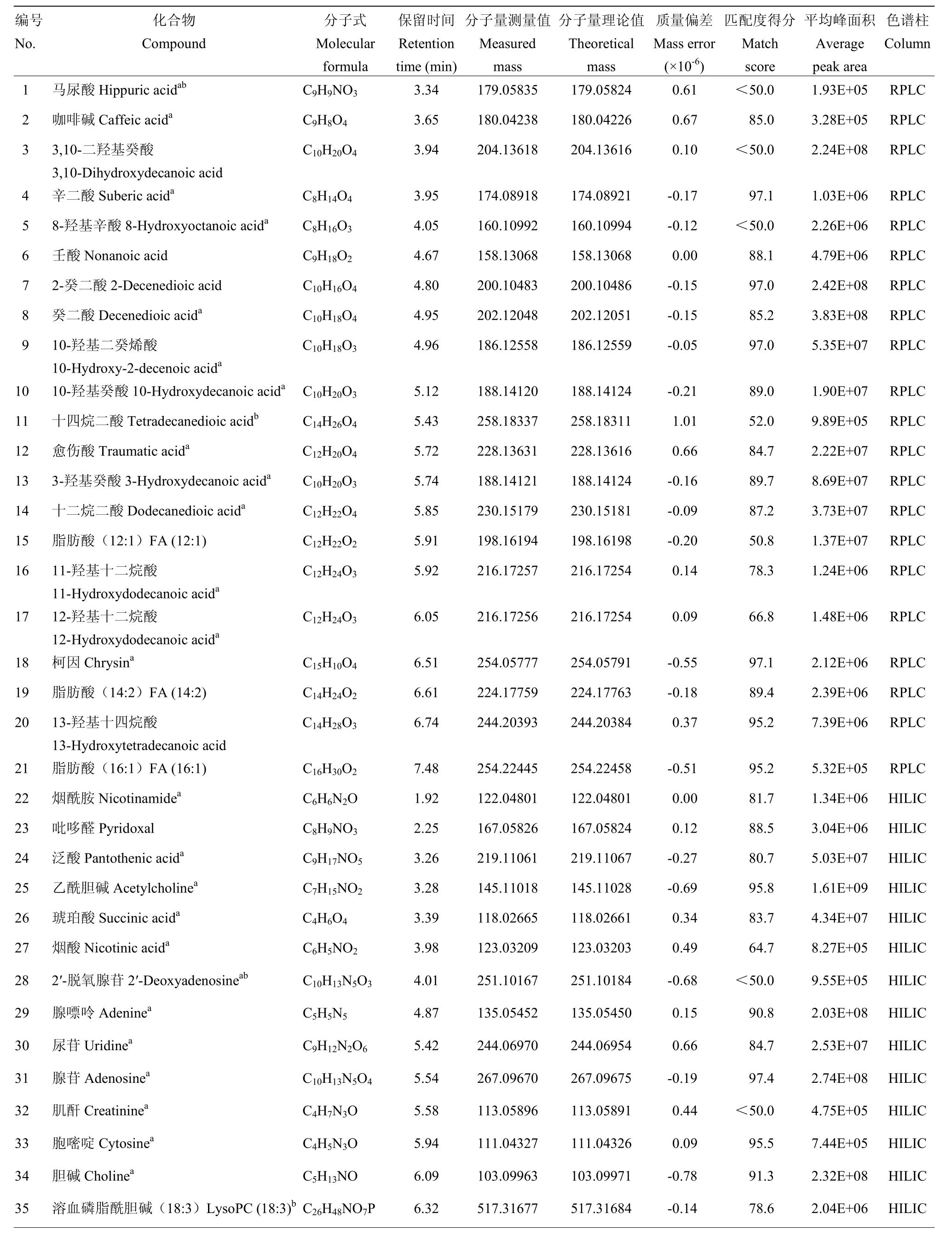
表1 在蜂王浆中鉴定到的化合物Table 1 Tentatively identified compounds in royal jelly
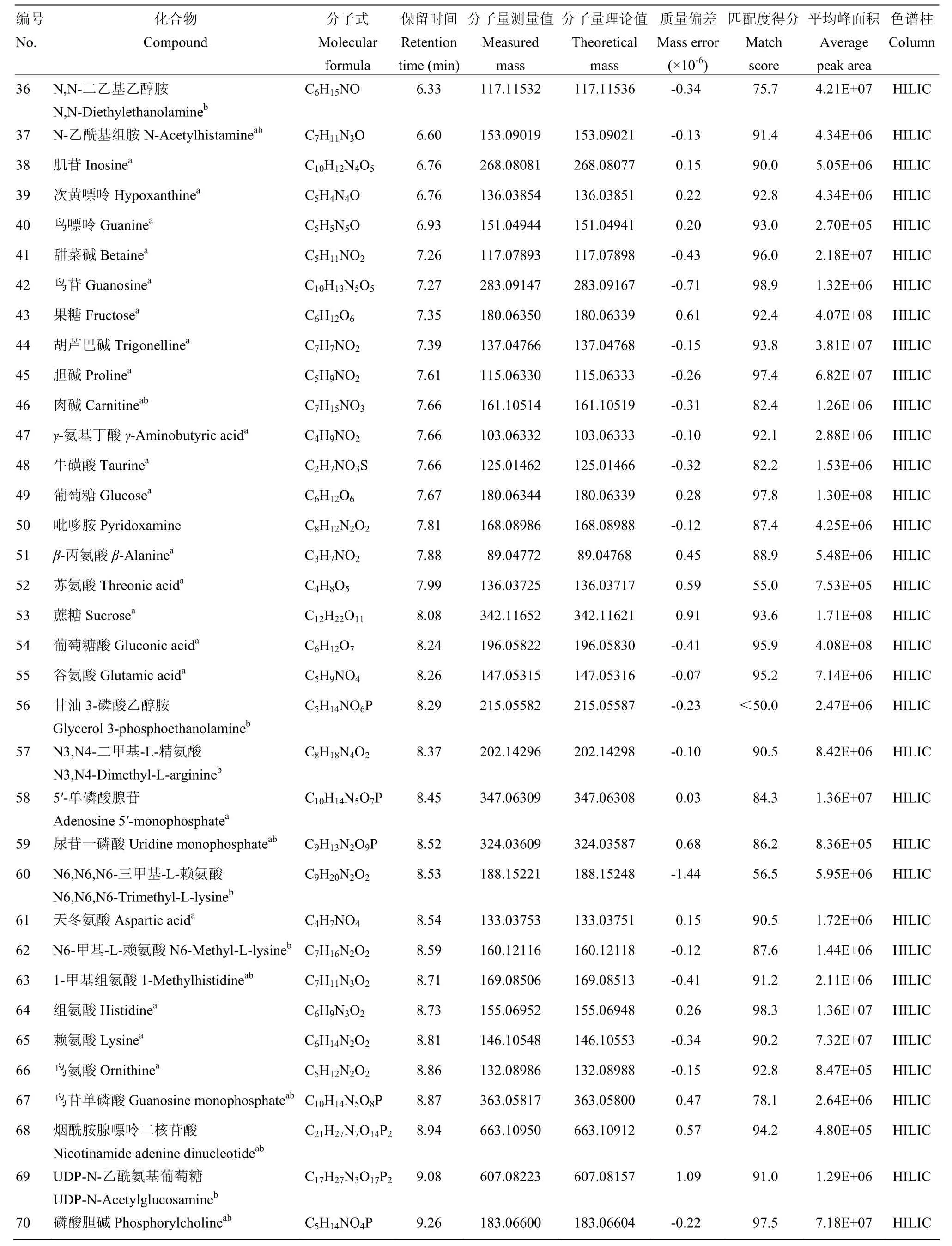
续表1 Continued table 1

图1 QC样品的总离子流叠加图Fig. 1 Overlapping of total ion chromatography (TIC) of QCs

图2 基于代谢特征离子的主成分分析得分图Fig. 2 The PCA score plots based on metabolite features
2.4 主成分分析
基于代谢特征离子进行 PCA分析,分别考察在RPLC和HILIC条件下不同溶剂对蜂王浆代谢物的提取效果。在RPLC条件下第1和第2主成分分别解释了总变异的49.9%和13.8%,在HILIC条件下第1和第2主成分分别为37.0%和20.9%。根据每个样本在PCA得分图上的分布规律可以发现,来自同一提取溶剂的样品分布比较集中,不同溶剂提取的样品间存在差异,其中,80%乙腈组与其他5组差异最大,甲醇和乙醇的浓度变化对蜂王浆代谢物提取的影响较小(图2)。
2.5 差异代谢物的筛选
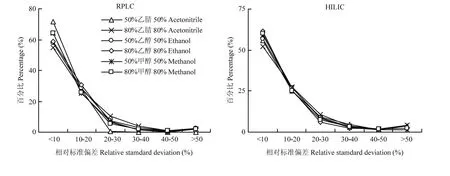
图3 代谢特征离子的相对标准偏差Fig. 3 The relative standard deviation of metabolite features
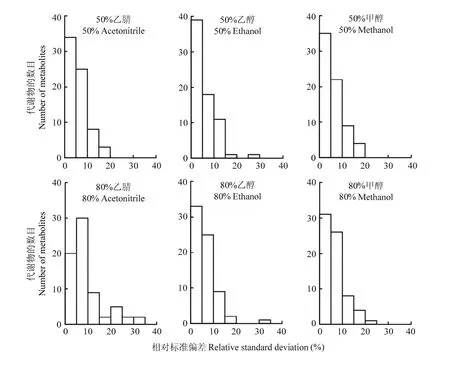
图4 已鉴定化合物的相对标准偏差Fig. 4 The relative standard deviation of identified compounds
为了筛查在 PCA分析中将 80%乙腈组和其他 5组明显区分开的主要化合物,对鉴定到的70种化合物进行OPLS-DA分析。OPLS-DA分析能够过滤掉无关组分,凸显组间差异。该模型包含3个主成分,其拟合参数为R2X=0.913,R2Y=0.983,Q2=0.977,即用91.3%的变量解释了 98.3%的组间差异,预测能力为97.7%,表明该模型的可靠性和预测率较高。为了避免有监督模型在建模过程中发生拟合,采用置换检验对模型进行检验,参数为R2=0.194,Q2=-0.447,说明此模型未发生过拟合,结果可靠(图 5-A)。得到相应的S-plot图(图5-B),一个点代表一个变量,越是在图的两端代表该化合物在该组的含量越高。VIP用来衡量各代谢物的表达模式对各组样本分类判别的影响强度和解释能力,以及辅助标志代谢物的筛选,VIP值>1.0的变量被认为是对分类具有重要意义的变量。将VIP>1.0且单变量统计分析P<0.05和FC>1.2的代谢物作为具有显著差异的代谢物,共筛选出8种差异化合物(赖氨酸、磷酸胆碱、葡萄糖、蔗糖、果糖、腺苷、葡萄糖酸和胆碱),其含量在80%乙腈组显著低于其他5组(图5-B)。
2.6 代谢物热图分析
聚类热图分析结果表明,已鉴定的70种化合物总体上分为两个分支。分支1包括22种化合物,主要为中低极性物质,在50%溶剂组丰度较低。分支2主要为强极性物质,在80%乙腈组丰度最低,在其他5组的差异不明显(图6)。

图5 80%乙腈组与其他5组间差异代谢物Fig. 5 Differential metabolites between the 80% acetonitrile and the five other solvents
3 讨论
本研究分别基于RPLC和HILIC联合高分辨质谱技术对蜂王浆小分子化合物进行代谢轮廓分析,基于代谢组学方法评估和优化蜂王浆代谢物的提取方法。在蜂王浆样品中共鉴定了 70种高丰度化合物,发现80%甲醇和 80%乙醇具有更高的提取效率,80%乙腈提取蜂王浆代谢物的重复性差且强极性物质的丰度最低。
3.1 数据质量评估
仪器分析系统的稳定性是获得稳定重现的代谢组学数据的前提,是代谢组学研究成功的关键,QC样品在实验分析中的重复性是评价系统稳定性的常用指标之一[35]。本研究将蜂王浆提取物等体积混合后作为QC样品,采用与实际样品同样的进样方法,每分析9个样品穿插1个QC样品。由总离子流图的叠加图(图1)可知,QC样品的峰形重现性良好,表明仪器带来的偏差很小。在PCA得分图(图2)中,QC样品紧密聚集,进一步表明分析系统具有较好的稳定性和重复性。
3.2 蜂王浆小分子化合物鉴定
代谢组学的研究对象是生物样品中的代谢物,如氨基酸、糖、核苷酸、脂类等极性及非极性化合物[36]。UPLC-HRMS是代谢组学分析的有力平台,高效的色谱分离能有效区分同分异构体,减少共流出化合物导致的离子抑制效应,从而有助于增加质谱检测化合物的种类和数量,并提高测定结果的准确度[23,37]。目前常用的分离色谱柱主要有RPLC和HILIC色谱柱,前者对于非极性和中低极性化合物的分离发挥重要作用,对强极性化合物的分离和保留能力较弱[38],而HILIC色谱柱在分离强极性化合物方面表现出更大的优势[24]。
本研究比较了RPLC和HILIC两种色谱柱在分析蜂王浆代谢物种类上的互补性。在RPLC和HILIC条件下分别鉴定了50和51种高丰度代谢物,共有代谢物有31种。脂类等中低极性化合物,包括两组同分异构体(3-羟基癸酸与 10-羟基癸酸,11-羟基十二烷酸与 12-羟基十二烷酸),在 RPLC条件下得到较好的分离;而氨基酸、糖类等强极性化合物,包括葡萄糖与果糖等同分异构体,在HILIC条件下分离良好。以上结果证明了两种色谱柱的互补性,以及在蜂王浆代谢组学研究中的必要性。在蜂王浆样品中共鉴定了70种化合物(表 1),其中大部分化合物已在蜂王浆中报道[11-12],17种化合物为本研究首次发现。受二级质谱数据库谱图数量的限制,本研究中还有大量代谢特征离子未能定性。此外,蜂王浆成分受蜂种、地理环境、气候条件、天气因素、蜜粉源状况、蜂群饲养管理以及生产方式等多种因素的影响[39-40]。因此,完善二级质谱数据库,增加蜂王浆的种类,使用以上代谢组学方法,将鉴定出更多的蜂王浆小分子化合物。
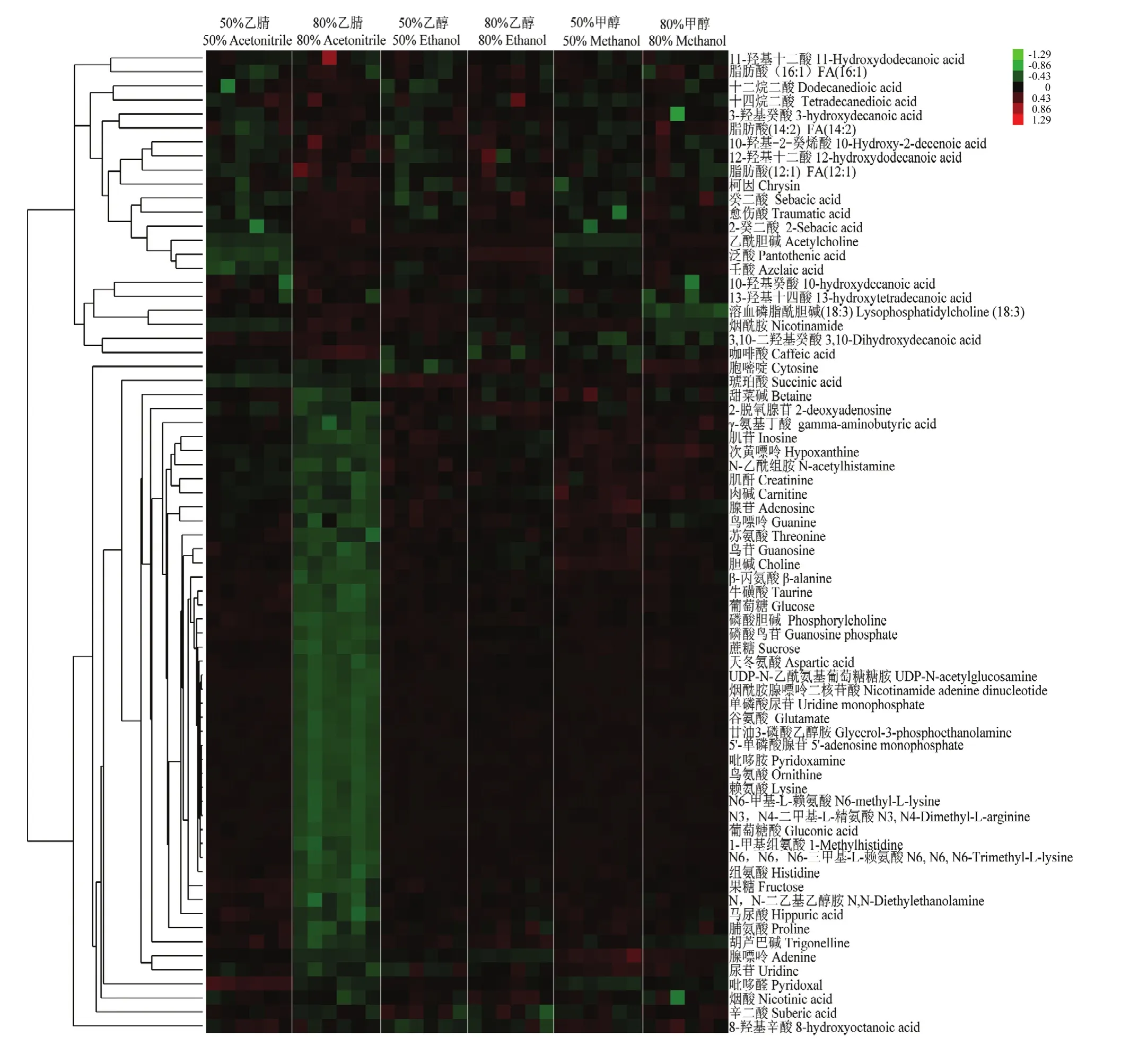
图6 已鉴定化合物的聚类热图Fig. 6 The clustering heatmap of identified compounds
3.3 不同溶剂对代谢物提取的影响
代谢物的提取是代谢组学的核心组成部分,合适的提取方法是获得较高提取效率的保证,不同的提取溶剂适用于不同的代谢产物,因此提取溶剂的选择至关重要。蜂王浆中所含代谢物种类繁多,化学性质差异较大。本研究以两种不同浓度的乙腈、乙醇和甲醇为研究对象,在基于UPLC-HRMS代谢组学分析中表明,80%乙腈对蜂王浆强极性化合物(特别是赖氨酸等8种化合物)的提取效率最低(图5、图6),且重复性较差(图3、图4)。PINA等[12]在提取蜂王浆极性代谢物时发现,与50%甲醇相比,80%乙腈的提取效率低,与本研究结果一致。在其他生物样品的代谢组学研究中,也有类似报道。例如,通过比较不同溶剂(甲醇、乙醇、乙腈及其水溶液)对白芦笋代谢物的提取效果,发现随着乙腈比例的增加,代谢特征离子数目及峰面积明显减少[41];在血清代谢组学研究中,利用乙腈提取检测到的代谢特征离子数目最少,而且RSD值最大[42]。本研究发现,与50%甲醇和50%乙醇相比,80%甲醇和80%乙醇提取的蜂王浆代谢特征离子数量更多,中低极性物质的丰度更高(图6)。因此,80%甲醇和80%乙醇是蜂王浆代谢组学研究的最佳提取溶剂。以往研究表明,80%乙醇能有效沉淀蜂王浆中的蛋白,并用于提取蜂王浆中的腺苷[43]。80%甲醇和80%乙醇也广泛用于其他生物样品的非靶向代谢组学研究[44-49]。
4 结论
建立了基于RPLC和HILIC四级杆-静电场轨道阱高分辨串联质谱技术的蜂王浆代谢轮廓分析方法,共鉴定了70种高丰度化合物,实现了糖、脂类、维生素和氨基酸等小分子化合物的检测,发现 80%甲醇或80%乙醇是提取蜂王浆代谢物的最佳溶剂,为后续蜂王浆代谢组学研究提供了技术支持。

