外源6-BA对不同生育时期淹水花生根系生长和荚果产量的影响
李颖,赵继浩,李金融,钱必长,刘兆新,高芳,杨东清,李向东
(山东农业大学农学院/作物生物学国家重点实验室,山东泰安 271018)
0 引言
【研究意义】黄淮海地区是我国重要的花生生产区,该区域属温带大陆性季风气候,夏季降水量多且集中,易导致农田土壤积水[1-2],对花生生产造成很大的影响。因此,研究不同生育时期淹水对花生生长发育的影响和栽培调控的作用机制,对花生品种选育、栽培管理等具有重要理论参考意义。【前人研究进展】根系是植物吸收养分的主要器官,也是植物激素等物质合成的器官[3],其生长分布与功能对地上部植株发育和产量形成有重要调节作用[4-5]。淹水条件下,根系缺氧,其细胞呼吸代谢方式发生转变,表现为有氧呼吸锐降,无氧呼吸增强[6-7]。前人研究发现植物淹水后根系乳酸脱氢酶(LDH)、乙醇脱氢酶(ADH)活性增加,苹果酸脱氢酶(MDH)活性降低[8-9]。植物内源激素脱落酸、细胞分裂素等作为植物体内的痕量信号分子,对于调节植物的生长发育过程和环境的应答具有十分重要的意义[10]。淹水环境下叶片 ABA含量会明显升高,致使气孔开度减小或关闭[11],影响作物的光合作用,进而影响干物质积累,最终降低产量[12]。玉米素核苷(ZR)在逆境中起到从地下到地上的信息介质作用[13]。通过对河竹的研究发现,淹水显著降低了根系ZR含量,提高了ABA含量[14]。6-苄基腺嘌呤(6-BA)是一种人工合成的细胞分裂素。REN等[15]研究发现外源 6-BA增加了淹水胁迫下的夏玉米叶片叶绿素含量,提高了光合性能,延缓了叶片衰老,有效地缓解了涝渍对夏玉米的不利影响。【本研究切入点】淹水胁迫对作物发育影响的研究已有报道,但淹水对不同生育期花生根系生长及 6-BA对淹水的缓解作用尚缺乏深入研究。【拟解决的关键问题】本研究选用山花108为材料,研究外源细胞分裂素对不同生育时期淹水胁迫下花生根系干重、根长密度、根系呼吸酶活性及根系内源激素的影响,探讨淹水逆境下外源 6-BA对不同生育时期根系生长的调控作用,深入认识激素在淹水逆境下调控根系发育及产量形成的作用机制,为花生生长的化学调控提供理论依据。
1 材料与方法
1.1 试验设计
试验于 2018—2019年在山东农业大学农学试验农场和作物生物学国家重点实验室进行。试验采用土柱栽培,供试土壤基本养分状况见表1。
花生品种选用山花 108,种植于直径 32 cm,高100 cm的PVC管中。每土柱施6.04 g复合肥(N、P2O5、K2O含量均为15%)。播种前进行灌水沉实,使土柱与大田状况尽可能一致。2年试验均于4月27日播种,每柱播3粒种子,出苗后留生长一致的花生2株,9月8日收获。其他如除草、除虫等田间管理同一般高产大田。在花生V3、R3、R5、R7[16]4个时期进行淹水处理(水面高于土面3 cm),淹水持续10 d。淹水结束后,每天18:00后叶片喷施15 mg·L-16-BA,用量为250 mL·m-2,连续喷5 d。为使激素能更好地附着于叶片,激素溶液中加入 0.5% Tween-20。试验设 9个处理组合,分别为正常水分管理(生育期内保持田间持水量60%—70%)(CK)、苗期淹水处理(V3-W)、苗期淹水后喷施6-BA处理(V3-S)、花针期淹水处理(R3-W)、花针期淹水后喷施6-BA处理(R3-S)、结荚期淹水处理(R5-W)、结荚期淹水后喷施6-BA处理(R5-S)、饱果期淹水处理(R7-W)、饱果期淹水后喷施6-BA处理(R7-S),每次取样3次重复。
1.2 测定项目与方法
1.2.1 取样方法 分别在V3时期淹水处理后0、5、10、15、20、60、80、100 d;R3时期淹水处理后0、5、10、15、20、40、60、80 d;R5时期淹水处理后0、5、10、15、20、40 d;R7时期淹水处理后0、5、10、15 d取样,每次取6柱,分为两部分,一部分用于测定植株干物质积累和根系形态分析;另一部分用去离子水冲洗,吸水纸吸干后保存于-80℃冰箱中,用于测定根系呼吸酶活性和内源激素含量。
1.2.2 根系形态测定分析和干物质积累测定 采用扫描系统(Epson Perfection V800 Photo)对根系进行扫描。扫描时将根系放入特制的透明托盘内,加入3—5 ml水以避免根系分支的互相缠绕。扫描后采用分析程序(Win Rhizo Pro Vision 5.0 a)对图像进行分析,得到根系长度,计算根长密度。扫描后的根系在105℃中杀青0.5 h, 65℃烘箱中烘干48 h至恒重后测定植株根系干物质量。
1.2.3 根系无氧呼吸酶活性的测定 选取长 3—5 cm、直径1.5 mm左右的生长根,称取0.5 g左右,放入预冷研钵中,加入2 mL pH 6.8的50 mmol·L-1Tris-HCl提取液(含 5 mmol·L-1MgCl2、5 mmol·L-1 β-巯基乙醇、体积分数为15%甘油、l mmol·L-1EDTA、1 mmol·L-1EGTA 和 0.1 mmol·L-1苯甲基磺酰氟),冰浴研磨,于4℃12 000×g离心20 min,上清液即为酶液。
参考WATER等[17]方法测定乙醇脱氢酶(ADH)活性。取 2.85 mL pH 8.0 的 150 mmol·L-1Tris-HCl反应液(含0.3 mmol·L-1NADH)和50 μL酶液混匀,然后加入30 μL 95%乙醇启动反应,于340 nm处测定吸光度值的变化。
依据 BERGMEGER[18]方法测定乳酸脱氢酶(LDH)活性。取3 mL pH 7.0的0.1 mol·L-1磷酸缓冲液(含 4 μmol·L-1NADH、0.2 mol·L-1丙酮酸),用0.15 mL酶提取液启动反应,于340 nm处测定吸光度值的变化。
1.2.4 根系有氧呼吸酶活性的测定 选取长 3—5 cm、直径1.5 mm左右的生长根,称取0.5 g左右,放入预冷研钵中,加入 2 mL pH 8.0的 50 mmol·L-1Tris-HCl提取液(含 5 mmol·L-1MgCl2、25 mmol·L-1β-巯基乙醇、5 mmol·L-1EDTA),冰浴研磨后,于4℃12 000×g离心20 min,上清液即为酶液。
参照薛应龙[19]的方法测定苹果酸脱氢酶(MDH)活性。取 880 μL pH 8.0 的 25 mmol·L-1Tris-HCl(含1 mmol·L-1EDTA、0.2 mmol·L-1NADH、20 μL 酶液),用 100 μL的 0.5 mmol·L-1草酰乙酸启动反应,于340 nm处测定吸光度的变化。
1.2.5 根系内源激素含量测定 采用酶联免疫法测定根系内源ZR和ABA的含量[20]。液氮研磨样品成粉末状,称取0.2 g,加2 mL样品提取液(80%甲醇,内含1 mmol·L-1二叔丁基对甲苯酚),并在4℃下保存过夜,10 000×g离心20 min,取上清液。沉淀继续用1 mL提取液,提取2次,合并上清液。上清液过Sep-Pak C-18固相萃取柱(Waters,USA)。具体步骤是:100%甲醇活化→纯水洗柱→上样→纯水冲洗→80%甲醇洗脱。将洗脱液转入5 mL离心管,氮气吹干,用 1 mL PBS(0.01 mol·L-1,pH7.4)复溶,然后用ZR和ABA酶联免疫试剂盒(南京草本源提供)测定ZR和ABA含量。

表1 试验土壤基本养分状况Table 1 Soil basic properties in the experimental site
1.2.6 净光合速率测定 采用Li-6400便携式光合仪(Li-Cor Inc,USA)测定主茎倒三叶的净光合速率(Pn,μmol CO2·m-2·s-1),各处理选取 5 株长势一致的植株。
1.2.7 SPAD值测定 采用 MultiSpeQ多功能植物测量仪(Photosynp,USA)测定主茎倒三叶SPAD值,测定时每处理选取10个有代表性的叶片。
1.2.8 花生产量测定 收获时测定单株产量。每处理取10株考察单株结果数,待花生荚果晒干至恒重后测定单株产量。
1.3 数据统计分析
采用Microsoft Excel 2007与SigmaPlot 12.0进行数据处理与作图,用DPS10.0统计分析软件对试验数据进行分析,差异显著性检验采用LSD法。由于2年趋势相近,文中数据为2018与2019年数据平均值。
2 结果
2.1 外源6-BA对淹水胁迫下根系生长发育的影响
2.1.1 外源6-BA对淹水胁迫下不同土层根长密度的影响 图1是不同生育时期淹水结束后5 d的根长密度。可以看出,与CK相比,各生育时期淹水均降低了根长密度,V3时期淹水对根系生长影响最大,表现为20—40 cm土层无根系。与淹水处理相比,淹水后喷施6-BA显著增加了V3、R3和R5时期的根长密度。2018与2019生长季,V3-S处理0—20 cm土层平均增加了21.75%;R3-S处理20—40 cm土层平均增加了11.35%;R5-S处理40—60 cm土层增加了22.56%。但饱果期淹水后喷施6-BA对根长密度无显著影响。

图1 外源6-BA对不同生育时期淹水胁迫下花生根长密度的影响Fig. 1 Effects of exogenous 6-BA on root length density in peanut under water-logging stress at different growth stages

图2 外源6-BA对不同生育时期淹水胁迫下花生根系干重的影响Fig. 2 Effects of exogenous 6-BA on dry root weight in peanut under water-logging stress at different growth stages
2.1.2 外源6-BA对淹水胁迫下不同土层根系干重的影响 图2是不同生育时期淹水结束后5 d的根系干重。可以看出,各生育时期淹水均抑制了根系的生长,降低了根系的干重。2018与2019生长季,V3-W处理 20—40 cm土层根系干重为零;而 R3-W 处理40—60 cm土层的根系干重平均降低了39.33%;R5-W处理40—60 cm土层的根系干重平均降低了15.93%。淹水后喷施6-BA后增加了V3-S、R3-S、R5-S处理的根系干重,其中V3-S处理0—20 cm土层根系干重较V3-W处理增加了4.72%,R3-S处理20—40 cm土层根系干重较R3-W处理增加了8.42%。饱果期淹水及喷施6-BA对根系干重无显著影响。
2.2 外源6-BA对淹水胁迫下根系呼吸酶活性的影响
2.2.1 外源 6-BA对淹水胁迫下根系乙醇脱氢酶(ADH)活性变化的影响 由图3可以看出,不同生育时期淹水均提高了根系ADH活性。淹水结束后0 d,V3-W、R3-W、R5-W与R7-W 2年较CK平均增加了12.50倍、8.41倍、6.74倍与6.16倍。其中V3-W于淹水结束后0—20 d内逐渐恢复到CK水平;R3-W处理于淹水结束后20—40 d恢复到CK水平;而R5-W处理于淹水结束后40 d逐渐恢复到与CK差异较小。淹水后喷施6-BA增加了根系ADH活性,且以花针期喷施效果最为明显。
2.2.2 外源 6-BA对淹水胁迫下根系乳酸脱氢酶(LDH)活性变化的影响 由图4可知,不同生育时期淹水显著增加了根系 LDH活性。且随着淹水时期的延后,增加幅度逐渐降低。淹水结束后,V3-W处理2年较CK平均增加了18.99倍,而R7-W处理增加了6.66倍。且V3-W处理于淹水结束后0—20 d内逐渐恢复到CK水平;R5-W处理淹水结束后20—40 d恢复到与CK差异较小。淹水后喷施6-BA缓解了LDH活性的升高,尤其降低了R3-S处理LDH的活性,喷施10 d后,LDH活性比R3-W处理下降了7.40%。

图3 外源6-BA对不同生育时期淹水胁迫下花生根系乙醇脱氢酶活性变化的影响Fig. 3 Effects of exogenous 6-BA on ADH activity changes in peanut root under water-logging stress at different growth stages

图4 外源6-BA对不同生育时期淹水胁迫下花生根系乳酸脱氢酶活性变化的影响Fig. 4 Effects of exogenous 6-BA on LDH activity changes in peanut root under water-logging stress at different growth stages
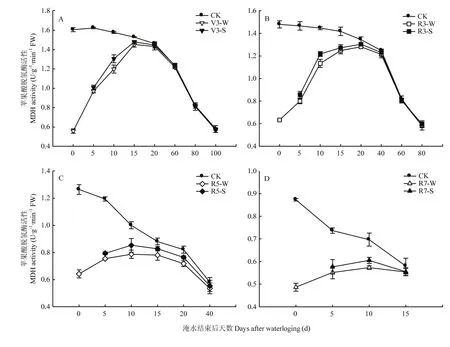
图5 外源6-BA对不同生育时期淹水胁迫下花生根系苹果酸脱氢酶活性变化的影响Fig. 5 Effects of exogenous 6-BA on MDH activity changes in peanut root under water-logging stress at different growth stages
2.2.3 外源 6-BA对淹水胁迫下根系苹果酸脱氢酶(MDH)活性变化的影响 由图5可知,不同生育时期淹水均降低了根系苹果酸脱氢酶(MDH)的活性。淹水结束后0 d,V3-W、R3-W、R5-W与R7-W处理2年较CK降低了65.16%、57.15%、49.25%、44.16%。且V3-W于淹水结束后0—20 d内逐渐恢复到CK水平;R3-W在淹水结束后15—20 d恢复到CK水平。淹水后喷施6-BA缓解了MDH活性的下降,在喷施激素10 d后,V3-S处理较 V3-W 处理 2年平均增加了8.94%;R3-S处理增加了8.97%。饱果期淹水后喷施6-BA对MDH活性无显著影响。
2.3 外源6-BA对淹水胁迫下根源激素变化的影响
2.3.1 外源 6-BA对淹水胁迫下根源 ZR变化的影响随着生育时期的推进,根系中ZR含量表现为先升后降,在结荚期达到最大(图6)。淹水结束后,V3-W、R3-W、R5-W与R7-W处理2年平均降低了16.84%、15.61%、15.35%、6.58%。胁迫解除后,V3-W与R3-W处理ZR含量增加并逐渐恢复到CK水平。淹水后喷施6-BA增加了根系ZR含量,增加幅度表现为R3-S>V3-S>R5-S>R7-S,分别较各淹水处理增加了5.47%、4.51%、4.31%、1.78%。
2.3.2 外源6-BA对淹水胁迫下根源ABA变化的影响2018与2019年,根系ABA含量呈现先降后升的趋势,并于结荚期达到最低值(图 7)。与CK相比,不同生育时期淹水均增加了根系ABA含量,V3-W处理2年平均增加了 30.84%;R3-W 处理增加了 21.35%;R5-W处理增加了17.21%;R7-W处理增加了11.91%。且V3-W与R3-W处理分别于淹水结束后20—60 d与40—60 d内逐渐恢复到CK水平。淹水后喷施6-BA降低了ABA含量,以R3-S处理喷施效果明显,2个生长季平均比R3-W处理降低了5.66%。
2.4 花生根系内源激素与根系呼吸酶的关系
由表2相关分析结果表明,根系脱落酸(ABA)含量与乳酸脱氢酶(LDH)活性呈极显著正相关关系,与乙醇脱氢酶(ADH)、苹果酸脱氢酶(MDH)活性相关性不显著。根系玉米素核苷(ZR)含量与苹果酸脱氢酶(MDH)活性呈极显著正相关关系,与乙醇脱氢酶(ADH)、乳酸脱氢酶(LDH)活性无显著性相关关系。

图6 外源6-BA对不同生育时期淹水胁迫下花生根系ZR含量变化的影响Fig. 6 Effects of exogenous 6-BA on ZR content changes in peanut root under water-logging stress at different growth stages

图7 外源6-BA对不同生育时期淹水胁迫下花生根系ABA含量变化的影响Fig. 7 Effects of exogenous 6-BA on ABA content changes in peanut root under water-logging stress at different growth stages

表2 花生根系内源激素与根系呼吸酶的相关性Table 2 Relationship between photosynthetic parameters and respiratory enzyme in peanut root
2.5 外源6-BA对淹水胁迫下叶片光合特性的影响
2.5.1 外源6-BA对淹水胁迫下叶片净光合速率(Pn)变化的影响 由图8可以看出,叶片净光合速率在花生生育期内呈单峰变化,在结荚期达到最大值。不同生育时期淹水后花生净光合速率下降。V3-W、R3-W、R5-W 与 R7-W 处理Pn 2年平均降低了 17.98%、19.74%、25.57%与 14.32%。淹水结束后,V3-W 与R3-W 处理净光合速率逐渐恢复到 CK水平。喷施6-BA后提高了主茎倒三叶的Pn,其中以R3-S处理增加效果显著,比R3-W处理增加了7.92%。饱果期淹水后喷施6-BA对Pn无显著影响。

图8 外源6-BA对不同生育时期淹水胁迫下花生叶片Pn变化的影响Fig. 8 Effects of exogenous 6-BA on Pn changes in peanut leaves under water-logging stress at different growth stages

图9 外源6-BA对不同生育时期淹水胁迫下花生叶片SPAD值变化的影响Fig. 9 Effects of exogenous 6-BA on the SPAD value of peanut leaves under water-logging stress at different growth stages
2.5.2 外源6-BA对淹水胁迫下叶片SPAD值变化的影响 由图9可以看出,淹水使花生主茎倒三叶的SPAD值降低。降低幅度表现为 R5-W>R3-W>V3-W>R7-W。喷施6-BA后,SPAD值提高,增加幅度表现为R3-S>R5-S>V3-S>R7-S。淹水结束后0 d,2018与2019生长季R5-W处理SPAD值较CK平均降低了37.05%。喷施6-BA后5 d,R3-S处理较R3-W平均增加了 7.98%。R3-W 与 R3-S处理于胁迫解除后60—80 d逐渐恢复。R5-W与R5-S处理在淹水解除后一直低于CK。而R7-W与R7-S处理SPAD值于淹水结束后15 d内逐渐降低。
2.6 外源6-BA对淹水胁迫下荚果产量的影响
由表3可知,不同生育时期淹水显著降低了花生的单株结果数、单株产量、出仁率。与CK相比,R5时期淹水减产幅度最大,R5-W处理的单株产量2年度分别降低 30.43%(2018)与 25.75%(2019)。喷施6-BA后,不同生育时期喷施外源6-BA提高了花生单株产量,但增加幅度不同,以花针期喷施增产幅度最大。与R3-W处理相比,R3-S处理的单株产量2年分别提高了 5.68%(2018)与 8.10%(2019),这是由于外源 6-BA显著提高了单株结果数与双仁果率。与R7-W处理相比,饱果期喷施6-BA对单株结果数及百果重无显著影响。
3 讨论
3.1 外源6-BA对不同生育时期淹水胁迫下花生根系呼吸特性的影响
淹水导致可用的O2含量降低,根系从有氧呼吸转化无氧呼吸,表现为无氧呼吸酶ADH与LDH活性增强[21],有氧呼吸酶MDH活性降低[22],从而可以促进乙醇发酵与乳酸发酵,提高NADH的再氧化过程,并维持适当的 ATP水平[23]。僧珊珊等[24]研究发现淹水条件下,与耐涝品种相比,不耐涝玉米品种根系的ADH与LDH活性显著增加。另外,张凤等[25]的研究发现,不同生育时期淹水,花生根系的 ADH活性差异显著。本研究结果表明不同生育时期淹水均抑制了花生根系MDH活性,同时诱导了ADH、LDH活性的上升;不同生育时期相比,苗期酶活性增加幅度最大,表明淹水对根系生育前期的呼吸代谢影响较大。淹水胁迫解除后,ADH、LDH活性逐渐恢复到对照水平。淹水后喷施外源6-BA显著提高了根系MDH与ADH活性,降低了 LDH活性,且淹水胁迫解除后缩短了恢复期;各生育时期喷施6-BA相比,花针期喷施6-BA处理的ADH与MDH活性变化幅度最大,这表明淹水后施用外源6-BA可改善根系的呼吸作用;而ADH活性的提高可以促进乙醛转化为乙醇,降低其对根系细胞的毒性,缓解其对植株的伤害[26]。前人研究表明,LDH作为催化乳酸发酵的关键酶,其催化产生的乳酸引起胞质酸化是引起植株死亡的主要原因之一[27]。外源 6-BA的施用减缓了其活性的升高,抑制了胞质的酸化程度,降低了根尖细胞的损伤,从而提高了花生的抗涝性。
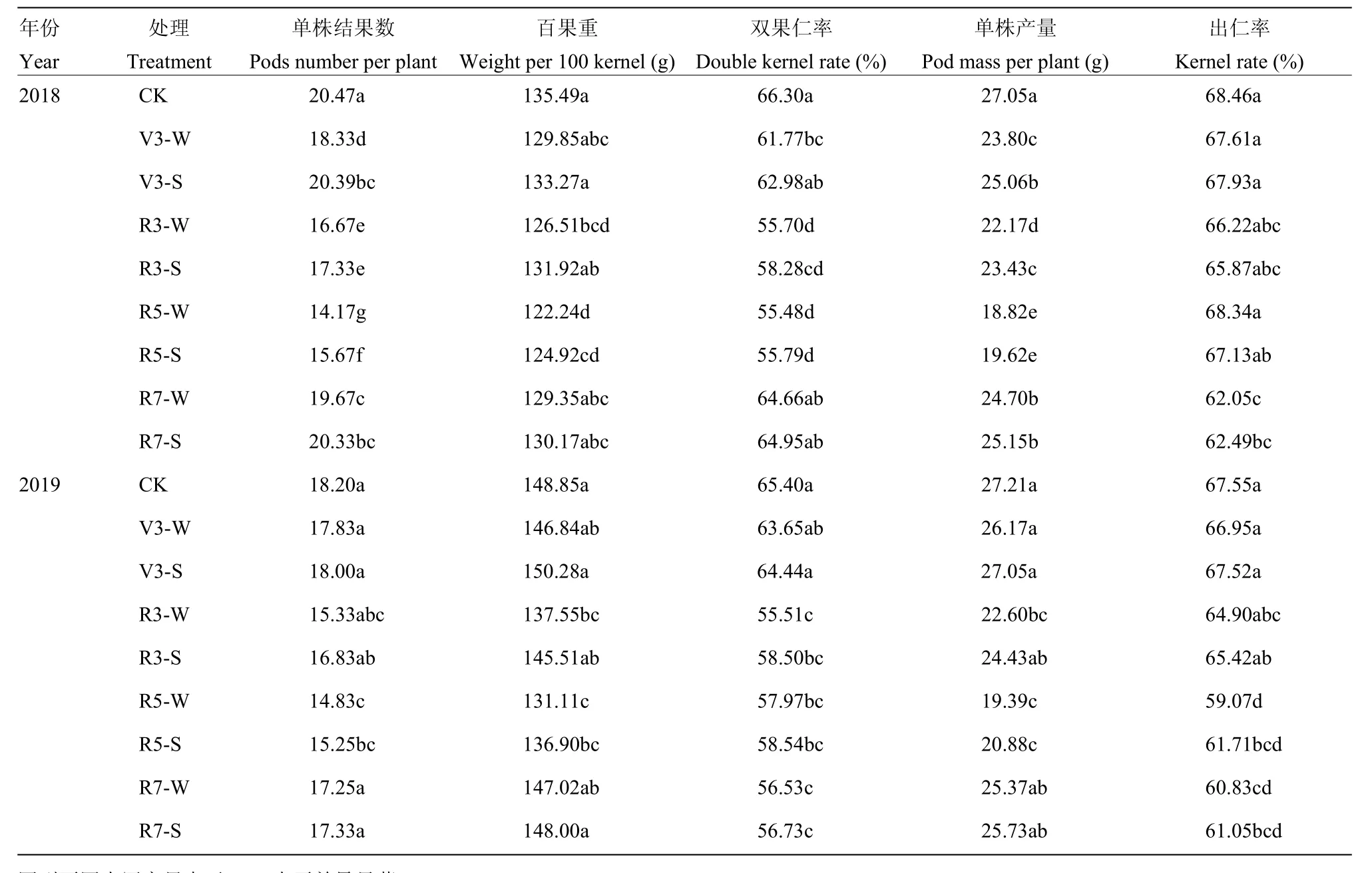
表3 外源6-BA对不同生育时期淹水胁迫下花生产量及产量构成因素的影响Table 3 Effects of exogenous 6-BA on yield and yield components of peanut under water-logging stress at different growth stages
3.2 外源6-BA对不同生育时期淹水胁迫下花生根系内源激素的影响
ABA和CTK是两种重要的激素信号物质,在逆境胁迫中具有重要的作用[28]。前人研究发现,在涝渍胁迫下,内源性 ABA含量迅速增加,通过合成第二信使(Ca2+、ROS、NO)来调节气孔开闭[29]。WANG等[30]发现叶片气孔关闭不仅仅受 ABA的影响,而是ABA含量增加和 ZR含量下降共同作用的结果。ZR在根中催化合成,通过木质部转运到枝条中以协调气孔开闭[31]。本研究发现各生育时期淹水均增加了花生根系中ABA的含量,降低了ZR的含量。这是由于淹水促进了细胞分裂素氧化酶基因的表达,提高了氧化酶活性,不利于ZR积累[32]。前人研究发现,ABA通过延缓细胞伸长来抑制根系的生长,而此过程的实现需要抑制 CTK信号的转导[33]。本研究发现,不同生育时期淹水抑制了根系生长,降低了根系长度。ABA抑制根的生长与NADPH氧化酶的活化和ROS的积累有关[34]。胁迫后喷施外源细胞分裂素可以提高内源CTK的含量[35]。刘敬然等认为外源6-BA可以显著提高棉花CTK含量,降低ABA含量[36]。本研究发现,淹水后喷施6-BA降低了根系ABA含量,提高了ZR含量。与淹水处理相比,淹水后喷施 6-BA增加了根系长度,提高了根系干重,表明外源 6-BA一方面降低了内源 ABA对根细胞伸长的抑制作用,促进根系的生长;另一方面提高了叶片的光合速率,促进了光合产物向根系的转运,进而提高根系生物量。研究发现,缺氧条件下低能量信号传导与植物激素信号传导途径密切相关[37]。而淹水缺氧条件下,根系产生ATP的主要机制为糖酵解与发酵。本试验相关性分析表明,ABA含量与LDH活性呈极显著正相关关系,ZR含量与 MDH活性呈极显著正相关关系,这表明内源 ZR和 ABA含量变化在根系呼吸中起重要作用。喷施外源细胞分裂素通过调节内源ZR、ABA含量,进而调控LDH和MDH活性。
3.3 外源6-BA对不同生育时期淹水胁迫下花生产量及其构成因素的影响
淹水影响叶片的光合作用,光合同化生产能力减弱,进而导致干物质积累量减少,影响籽粒充实,最终导致产量下降[38-39]。前人研究表明,淹水后小麦旗叶的叶绿素含量显著下降[40]。叶绿素是植物叶片光合作用的物质基础,其含量高低能反映植物的生长状况和叶片的光合能力。本研究表明,不同生育时期淹水后主茎倒三叶的 SPAD值显著降低(图9),分析原因为淹水胁迫影响了花生的呼吸代谢,细胞内积累较多的有害物质(氧自由基、乙醛、乳酸等),破坏了叶绿体的结构,加速了叶绿体的分解,最终导致叶绿素含量下降[41-42]。花生淹水后地上部叶片光合速率显著降低(图8),进而影响花生的干物质积累与分配,降低了花生的单株结果数与百果重,最终降低花生产量。本研究结果表明,R5时期淹水显著降低了花生的单株结果数,单株产量2年平均降低29.58%。研究发现涝后喷施6-BA能够提高作物的叶面积指数[15],增加叶绿素含量[43],从而提高作物光合生产能力,最终提高产量。本研究表明,淹水后喷施6-BA可显著提高花生单株产量,且以R3时期处理效果显著,产量比淹水处理平均提高6.89%,这表明6-BA对花生花针期淹水的调控效应最明显。
4 结论
淹水通过增加根系内源ABA含量,降低ZR含量,一方面降低了根系MDH活性,提高了根系ADH与LDH活性;另一方面降低了叶片的叶绿素含量与光合速率,减少了光合产物的积累,产量降低。淹水后喷施外源6-BA降低了根系内源ABA含量,提高了ZR含量,一方面提高了根系ADH、MDH活性,降低了LDH活性,改善根系的呼吸性能,促进根系生长;另一方面提高了叶片叶绿素含量和光合速率,促进干物质的积累与分配,提高了单株结果数与单株产量,且不同生育时期相比,花针期喷施单株产量增加效果明显。

