甘肃、青海地区小麦条锈菌监测及群体遗传多样性分析
黄苗苗,陈万权,曹世勤,孙振宇,贾秋珍,高利,刘博,刘太国
(1甘肃农业大学植物保护学院,兰州730070;2中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193;3农业农村部农产品质量安全生物性危害因子(植物源)控制重点实验室,北京 100193;4农业农村部国家植物保护甘谷观测实验站,甘肃甘谷741200;5甘肃省农业科学院植物保护研究所,兰州730070)
0 引言
【研究意义】小麦条锈病是一种气传病害,是危害我国小麦生产的主要流行病害之一,在世界各主要麦区也时有发生,其病原菌为条形柄锈菌小麦专化型(Puccinia striiformisf. sp.tritici,Pst)。小麦条锈菌主要在纬度较高或高海拔地区越夏,具有喜凉怕热、远距离气流传播、分布范围广、流行频率高、暴发性强、流行速度快、危害程度重等特点[1]。该病害流行时,可造成10%—70%的产量损失,严重时可至绝收[2-3],长期威胁着我国小麦主产区,包括西北、西南、黄淮海和长江中下游地区。新中国成立以来,小麦条锈病在我国年均发生400万公顷左右,特别是1950、1964、1990、2002和2017年的5次大流行,小麦产量损失达1 380万吨[4]。我国小麦条锈病的病菌来源分为秋季菌源基地和春季菌源基地,秋季菌源基地为甘肃陇南陇东、川西北、青海东部等,向条锈病菌冬繁区秋苗提供菌源[5]。前人在甘肃小麦条锈菌流行关系研究中,对与青海菌源的关系少有涉及,没有将甘肃和青海的菌源作为研究主体,存在样本量较小、条锈菌的标样未采集于病害流行初期等缺陷。因此,明确甘肃、青海两省春季流行期间的菌源传播以及生殖方式对条锈菌大区流行预测及确定越夏初始菌源来源等具有重要意义。【前人研究进展】我国西北、华北、西南主要流行区的条锈菌群体遗传多样性和遗传结构已进行了广泛而深入的研究,确定了我国小麦条锈菌具有较高的遗传多样性水平,尤其是甘肃陇南地区,不同流行区群体间存在着一定的基因交流[6-11]。西北地区的甘肃和青海是我国小麦条锈菌最重要的越夏区,条锈菌新小种的首次发现几乎均在这一区域。该区域秋季条锈菌菌源可向东部广大冬麦区传播,对周边地区有重要影响[1]。关于青海、甘肃、新疆、西藏4省(自治区)的小麦条锈菌毒性及遗传多样性的研究表明,青海和甘肃的条锈菌群体相似性较高,存在一定的菌源交换关系[12]。青海与甘肃条锈菌群体的菌源交流主要存在于陇南地区,基因流较强;与临夏群体的菌源交流则受到一定程度的限制,基因流相对较弱[10]。因此,学者们多认为青海春季、夏季菌源全部由甘肃陇南传播到青海[13]。【本研究切入点】虽然前人对甘肃、青海地区小麦条锈病做了相关研究,但关于小麦条锈菌在甘肃、青海地区周年循环的研究,包括越夏、越冬以及春夏季菌源传播,特别是春季流行期间甘肃、青海菌源传播以及两地可能存在的生殖模式等问题,尚缺乏一些直接的证据。【拟解决的关键问题】以采自自然发病条件下甘肃、青海地区小麦变异观察圃材料上的小麦条锈菌群体为对象,利用微卫星(simple sequence repeat,SSR)分子标记的方法研究甘肃和青海两省6个市(县)小麦条锈菌春季流行传播路线及群体遗传多样性和群体的生殖模式,阐明甘肃和青海两省小麦条锈菌的群体遗传关系,明确两省小麦条锈菌之间的传播流行关系及菌源交换规律,进而为两省小麦条锈病的预测预报、确定越夏初始菌源来源和有效治理提供理论依据。
1 材料与方法
1.1 试验点及标样采集
选择历年种植小麦、条锈病常发生的地区作为调查和研究区域。甘肃省共4个试验点:陇南市文县、陇东平凉市崆峒区、中部麦区定西市临洮县、临夏州临夏县;青海省2个试验点:西宁市城北区、海东市互助县。
供试6套82份小麦品种组成的抗病性变异观察圃材料由中国农业科学院植物保护研究所麦类真菌病害研究组提供,根据各地小麦播种适期,按照编号顺序依次种植在试验田中。每个小麦材料种植1行,行长2 m,行距0.33 m,每隔一段距离(一般18行)设置当地抗、感病品种各1行作为对照。在试验区周围播种2—3行铭贤169(高度感染条锈病品种)作为诱发品种。种植管理按照当地大田常规栽培管理方法进行,同时注意以下几点:(1)保持水肥适中,防止土壤干旱和植株倒伏;(2)小麦生育期内禁用任何杀菌剂;(3)不可进行人工接种,并尽可能远离接种试验地;(4)观察记载自然发病结果(始发期、盛发期)及各品种的小麦生长状况。
标样采集:从6个试验点82份变异观察圃上共收集到551份始发期小麦条锈病标样(表1)。每个试验点调查病害的普遍率、严重度和反应型[14]并采集条形柄锈菌夏孢子堆之间分界明显,无其他病原菌污染的叶片作为发病标样,用单张吸水纸包裹叶片,并单个放入干燥的信封中,对每个信封进行编号,并标明地名(市、县、乡镇)、小麦品种及采集时间,带回实验室后4℃干燥器中保存备用。
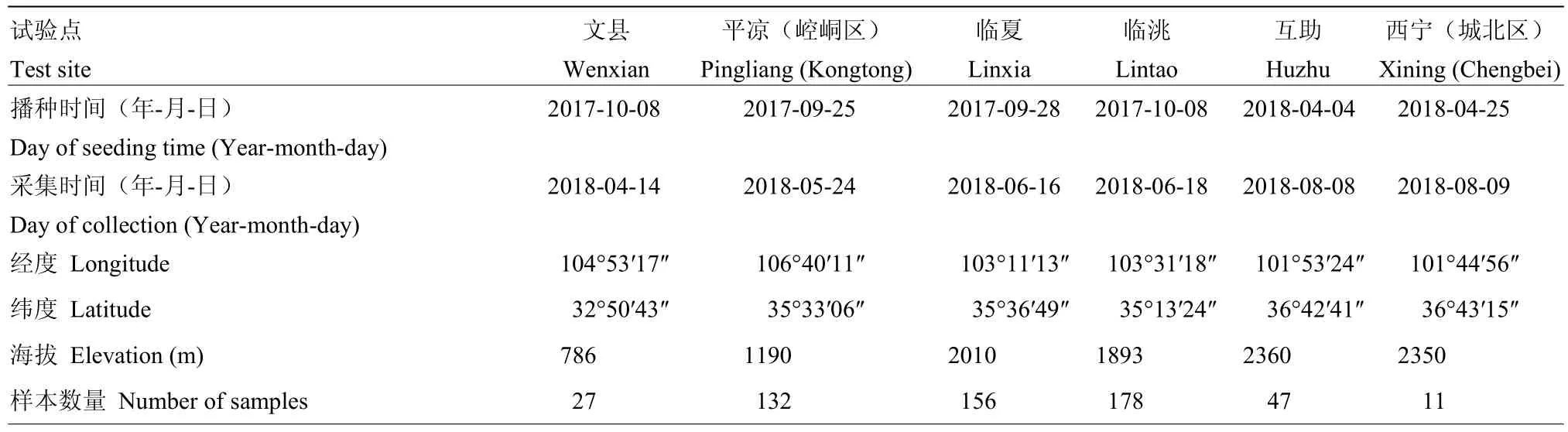
表1 甘肃、青海两省6个观察圃内小麦条锈病自然发病调查结果及采集的551份标样信息Table 1 The collection information of the 551 Pst samples from six regions in Gansu and Qinghai provinces and the incidence results under the natural infection by Pst

续表1 Continued table 1

续表1 Continued table 1
1.2 小麦条锈菌基因组 DNA的提取及微卫星位点的PCR扩增
对采集到的小麦条锈菌标样,小心将单一病斑剪下装入2 mL离心管中,按采集地点和品种进行编号,试验过程要严防交叉污染。基因组DNA的提取参照天根植物 DNA提取试剂盒的方法进行,使用Nano Drop(ND-1000,USA)测量DNA的浓度,并将 DNA浓度稀释至 50 ng·μL-1后置于-20℃冰箱保存备用。
用于SSR分子标记的15对引物[2,15](表2)均由上海生工合成。PCR反应体系及程序参照文献[2,15],对扩增产物进行 2%的琼脂糖凝胶电泳后筛选符合要求的反应产物,使用3500XL Genetic Analyzer(Applied Biosystems,USA)对扩增子进行检测。

表2 本试验使用的15对SSR小麦条锈菌引物信息Table 2 Information of the 15 SSR primers for Pst used in this study
3500XL Genetic Analyzer上机前的准备:按照1∶50的比例对PCR产物进行稀释,吸取1 μL稀释液加入9 μL的Hi-Di+Liz混合液(Hi-Di∶Liz = 1 000∶15),混匀后全部加入3500XL Genetic Analyzer配套的96孔板中,贴胶贴,在振荡仪上充分混匀后,2 000 r/min离心1 min收集待测反应液于管底,95℃变性5 min,冰浴5 min,随后上机。
1.3 数据处理
扩增子长度由3500XL Genetic Analyzer(Applied Biosystems,USA)检测分析后,用GeneMaker(V2.7.0)(Soft Genetics)读取数据。然后将数据按照二倍体的格式录入Excel表,利用GenAlEx 6.5[16]将数据转化为可供R软件POPPR v2.5.0分析的CSV数据格式,超过一半位点有缺失数据的样品去除。
利用GenAlEx计算以下遗传参数:(1)分子方差分析(analysis of molecular variation,AMOVA);(2)群体遗传分化系数(FST);(3)基因流(gene flow value,Nm)。
利用 POPPR v2.5.0[17]计算以下参数:(1)观察到的等位基因数量(Na);(2)均匀度(Evenness);(3)位点缺失比率(locus missing ratio);(4)每个采样试验点的样本个数(N);(5)特定个体在特定位点上携带的等位基因的组合,携带相同等位基因组合的个体称为具有相同的多位点基因型(multi locus genotype,MLG);(6)基因型多样性(G);(7)标准化关联指数(rbarD)[18];(8)基因型累积曲线(genotype accumulating curve):反映位点是否足以进行群体分析,基因型累积曲线达到 100%,代表所选择的位点数足够进行群体分析[19];(9)采用Bruvo’s distance绘制不同个体间的最小时空网络图(minimum spanning networks,MSN)[20];(10)主成分判别分析(discriminant analysis of principal components,DAPC)[21]。
(2)根据基岩面等值线图及现场地面调查可知场地溶洞、溶槽、石芽、漏斗等岩溶形态造成稳定持力层判断较困难;易出现部分基础位于隐伏陡崖上等不利情况。
2 结果
2.1 甘肃、青海地区6个试验点小麦条锈病监测
田间调查结果显示,82份全国变异观察圃材料在甘肃地区发病比青海地区严重,其中在临夏地区发病材料最多(54份),其次是平凉(44份)、临洮(40份)和文县(13份);有11份材料(Triticum speltaalbum、Joss Cambier、Armada、川育 23、Avocet S*/Yr24、Avocet S*/Yr26、Jupateco R Yr18、TcLr38、ISr6 Ra、ISr11 Ra、Trident Sr38)在6个地区均未发病,占供试材料的13.41%,其余71份材料至少在1个试验点发病;青海互助 14份材料发病,西宁仅 4份材料发病;青海地区发病的18份材料仅1份材料(铭贤169)在甘肃4个地区都发病,其他17份材料均未在甘肃文县发病,但在平凉和临夏地区部分材料发病(表 1),显示文县和青海群体小麦条锈菌毒性有一定差异。
2.2 小麦条锈菌遗传多样性水平
15对引物组合共扩增出81个位点,每对引物组合产生的多态性位点为2—12个。均匀度值在0.2719—0.8648,表明等位基因频率在样本之间分布不均,其中引物RJ21的均匀度接近0.5,即该引物的等位基因在样本中均等分布。各个位点的缺失比率在 0—9.62%(表3)。

表3 15对引物的遗传多样性信息Table 3 Information of genetic diversity about 15 SSR primers
551份样本克隆矫正后,共鉴定出505个MLG,甘肃和青海群体总的基因型多样性(0.917)高,群体的基因型多样性在 0.841—0.974,其中平凉群体的基因型多样性最高,互助群体次之,甘肃临洮群体的最低(表4),可以看出,6个群体的基因型多样性均比较高。
2.3 甘肃与青海小麦条锈菌群体菌源关系
在505个MLG中(表4),仅有32个MLG被克隆并进行了2—6次重新采样,各群体内部均检测到重新采样的MLG。甘肃、青海群体分别有29和3个MLG被重新采样,其中MLG-184在临洮的群体中重新采样6次,MLG-141在临夏的群体中重新采样5次,没有重新采样的MLG有473个,表明甘肃和青海小麦条锈菌群体中存在明显的遗传差异,MLG多样性与小麦条锈菌流行期的主要无性繁殖模式形成了明显的对比,即无性繁殖在群体中所占的比例不高。
青海西宁群体与甘肃平凉群体之间的基因流最大,临夏次之,表明西宁群体与平凉群体菌源交流最频繁,与临夏群体菌源交流较频繁;其与文县和临洮群体的基因流小且群体遗传分化系数大(0.234和0.246),说明西宁群体与文县、临洮群体之间有较大的遗传分化,菌源之间交流不频繁。青海互助群体与临夏群体之间基因流最大,菌源交流最频繁;与文县群体之间基因流最小且群体遗传分化系数最大,说明互助群体与文县群体之间遗传分化大,菌源交流不频繁。可推断,青海地区小麦条锈菌的菌源大多数来源于甘肃平凉和临夏地区的传播。甘肃的4个群体之间,平凉群体与临夏群体之间的基因流最大,菌源交流最频繁(表5)。

表4 重采基因型及克隆校正群体的基因型多样性统计Table 4 Resampled MLGs and genotypic diversity statistics of the clone-corrected data within all populations examined in this study

表5 甘肃和青海两省6个小麦条锈菌群体成对的群体遗传分化系数(对角线下部)和基因流(对角线上部)Table 5 Pairwise population FST values (lower diagonal) and Nm (upper diagonal) among six populations of Pst collected from Gansu and Qinghai provinces
最小时空网络图(MSN)结果表明,两省6个群体相互之间未发现共享MLG。临洮群体的MLG与其他5个群体之间的遗传关系较小,从而形成了一个独特的MLG基因簇。甘肃省4个小麦条锈菌群体之间存在不同程度的遗传变异;西宁群体的 MLG紧密聚集在一起,与甘肃临夏和平凉群体的部分个体菌源遗传距离相近,支持菌源从甘肃的临夏或平凉传播到西宁,随后在西宁群体产生了克隆分支。这说明尽管种群内部存在多样性,但个体亲缘关系仍然密切。文县群体同样紧密聚集在一起,并与青海西宁群体之间的遗传距离较远,来自甘肃临夏、平凉和青海互助的许多MLG非常接近,表明这些群体之间遗传关系更密切(图1)。
同样,非参数主成分分析(DAPC)验证了MSN的结果,青海互助和西宁的群体与来自于甘肃平凉和临夏的群体之间菌源关系最密切,差异最小;与临洮群体遗传距离相对较远且临洮群体为相对独立;文县群体则是一个完全独立的群体,与其他5个群体之间的差异最大(图 2)。DAPC的结果以及群体间较大的 FST(0.131)(表 6)再次说明小麦条锈菌各群体之间存在遗传变异。

图1 根据Bruvo’s距离进行的所有小麦条锈菌分离株的最小网络图Fig. 1 Minimum spanning network (MSN) of all isolates of Pst based on Bruvo’s distance

图2 不同小麦条锈菌群体主成分判别分析图Fig. 2 The discriminant analysis of principal components (DAPC) of different Pst populations
2.4 甘肃、青海小麦条锈菌群体繁殖方式分析
结果显示,等位基因与个体以及群体之间的基因座相关联这一假说得到了重要支持,整体上甘肃和青海小麦条锈菌群体表现出无性繁殖特征(表 4)。而来自于甘肃文县、临夏的群体以及青海西宁的群体具有与其他地区群体不同的特征,这3个群体存在不显著的rbarD值(表4、图3)表示连锁平衡,可能是有性生殖群体,尤其文县群体(rbarD=0.0139,P=0.186)显示出明显的有性重组特征,其他3个群体均为无性繁殖模式。

图3 甘肃、青海3个小麦条锈菌有性群体连锁不平衡分析Fig. 3 Linkage disequilibrium analysis of three Pst populations from Gansu and Qinghai
3 讨论
甘肃、青海地处西北内陆,地域辽阔,地形地貌复杂多样,区域间气候差异大,形成了小麦种植呈垂直分布,冬、春小麦成片交错种植的农田生态景观,是小麦条锈病周年流行的适宜场所,使其成为我国小麦条锈菌重要的越夏区。小麦条锈菌除了在甘肃、青海区域内往返传播循环外,还通过孢子的远程传播危及到我国东部广大麦区[1]。条锈菌的远距离传播一直是植物病害流行学中的热点研究领域之一,为大区病害流行规律的研究提供了极具价值的材料,也极大地丰富了流行学理论,可从根本上提供地域性病害防治与品种抗病性布局的科学依据。因此通过分子标记方法明确甘肃、青海小麦条锈菌传播及遗传多样性水平,对该地区小麦条锈病的准确预测和指导防治具有重要作用。

表6 甘肃、青海两省6个小麦条锈菌群体分子方差分析Table 6 Analysis of molecular variance (AMOVA) for six populations of Pst sampled from Gansu and Qinghai provinces
本研究中,春季流行时小麦条锈菌在甘肃和青海之间存在广泛的基因交流。根据田间实地调查条锈病初始发病时间,甘肃4个地区比青海2个地区发病早,且发病程度严重。最小时空网络图和主成分判别分析结果显示甘肃省4个群体之间,文县和临洮群体是2个相对独立的群体,临夏和平凉群体菌源关系最近,交流最频繁,且平凉地区发病时间早于临夏,两群体之间存在很大的基因流,可推断菌源从平凉传播到临夏,然后进行繁殖存活。文县群体和其他群体不同的原因主要是甘肃省春季发病初始菌源不同,甘肃省春季菌源结构复杂,有来自于甘肃省本地的越冬菌源,也有其他地方的菌源。2018年4月中旬,笔者在甘肃省春季病害实地调查中发现与陇南文县相邻的陕西汉中宁强、略阳的小麦生长期为灌浆期,其条锈病已进入暴发期;而甘肃天水、定西地区的小麦仅处于苗期,其条锈病呈始发或未发状态,平均病田率、病点率和病叶率均轻于陕西宁强和略阳。陕西黄陵以南是条锈菌在西北的主要越冬场所,也是条锈病的春季流行区[1]。另外,前人研究也表明陇南地区菌源可能来自于四川、云南的越冬菌源或陕西的春季流行菌源,而不是当地冬前菌源[22]。同时,陇中、陇东地区小麦种植以甘肃育成小麦品种为主,而陇南以四川及20世纪70年代引进的抗病品种为主[23-24],差异较大的寄主造成甘肃条锈菌群体出现一定差异。陇南地区在小麦条锈病综合治理中引进了较多抗病品种,使得小麦群体的抗病基因趋于多样,并对抗病品种进行合理布局和轮换,所以多元化的寄主抗病基因和较低的选择压力也是陇南地区条锈菌群体结构不同的主要成因。
本研究中群体差异主要来自各群体内部个体之间,这与之前研究各流行区群体遗传分化结果一致[6-8,10]。基因流反应群体的遗传分化水平,基因流大表示群体间的遗传分化小。本研究中,群体间成对的基因流均>1(表5),表明小麦条锈菌在各群体间有一定的基因交流,与LU等[10]研究不同,未发现6个群体之间共享任何基因型,仅在各个群体内部存在少数基因型重新采样,青海群体的基因交流不如甘肃群体频繁,较高的基因型多样性与小麦条锈菌流行周期的主要克隆性形成了明显的对比。
青海互助和西宁群体与甘肃陇东平凉和陇中临夏群体菌源之间的基因流要大于其与陇南文县群体之间的基因流,本研究表明青海的群体与甘肃临夏、平凉群体之间的遗传距离比陇南文县的近,文县群体是一个相对独立的群体。青海地区发病的变异观察圃材料,除了铭贤 169,其他材料均未在陇南文县地区发病,也是群体有差异的证据之一。而LU等研究认为青海春季菌源主要自陇南地区传播而来,两地群体间基因流较强,菌源交流广泛;与临夏群体的菌源交流则受到一定程度的限制,基因流相对较弱[10],这与本研究结果不同。造成本研究结果的原因,一是与各地区的地形地貌特征和区域间距离相关,文县地区高山林立,山川纵横,生态环境较为封闭,病菌与外地交流需借助较强的上升气流和适当的风向才可实现,且气候温和,冬季比较温暖,夏季凉爽,有利于病原菌完成周年循环;二是环境的改变,随着近年来温度的升高,菌株发生变异,加之种植制度的变化等原因;三是有性繁殖群体存在的影响。总的来说,导致陇南文县地区小麦条锈菌群体遗传多样性与其他地区不同的主要因素是地理气候特征,其次,有性生殖的存在也有一定的影响[10,25-26]。
小麦条锈病为气传病害,条锈菌夏孢子在风力作用下可大范围传播。其中青海互助和西宁群体之间基因交流不频繁,原因可能是这些地区有一部分菌源来源于青海已发病地区的菌源传播。在早春病情调查中发现,各地区小麦品种不尽一致,而青海尖扎、贵德地区的小麦条锈病发病时间略早于甘肃临夏等相邻地区,青海尖扎地区5月21日初始发病,发病严重度和普遍率较低(3/10/10),甘肃临夏地区6月 16日发病程度(4/40/60) 比尖扎严重,青海贵德6月14日发病(4/20/40),青海贵德和尖扎两地群体菌源来源也不相同。有研究表明,青海一些地区小麦条锈菌可以少量越冬[27]。所以青海春季流行的初始菌源不一定都来自于甘肃省,两省菌源有一定的交流。由此推断,青海小麦条锈菌越冬菌源在春季病害流行具有一定的作用。
本研究中,两省小麦条锈菌群体遗传多样性均较高,这与样本来源于地理跨度较大的不同县(市)有一定关系,是病菌受复杂多样生态环境自然选择的结果[28]。同时,样本来自不同的变异观察圃品种,小麦品种拥有多样化的抗性背景,寄主对病原菌群体结构产生了重新配置的作用[29-30]。另外,甘肃和青海地区是地形相似的自然区域,或为高寒冬春麦区,或为山川交错、冬春麦垂直分布的麦区,为条锈菌的生长和越夏提供了适宜的气候条件和生态环境,条锈菌在该地有较长的进化史。因此,这些地区的条锈菌群体有较高的遗传多样性和重组事件。6个群体间没有共享基因型存在,也说明条锈菌可通过遗传重组、突变、寄主选择及对当地生态环境的适应,在各地区进行了相对独立的进化。
根据哈迪-温伯格定律,无性繁殖的群体由于基因不是完全独立的遗传会出现显著的连锁不平衡现象,有性生殖的群体因配子的随机交配使得基因座间在遗传过程中没有相关性,处于连锁平衡状态。甘肃、青海省6个地区的群体中,甘肃文县、临夏的群体以及青海西宁的群体存在连锁平衡现象(图 3),说明这些地区存在有性重组的可能。ZHAO等[31]在甘肃省从锈菌侵染的小檗上分离纯化的2个锈子器可以产生条锈菌夏孢子,为甘肃小麦条锈菌群体存在有性生殖提供了最直接的证据,前人也报道了甘肃地区存在有性重组现象[9,25-26]。但是关于青海地区存在有性繁殖现象少有报道。青海地区存在大量的转主寄主小檗[32],且种类丰富。在5—7月份,青海大多数小檗可在自然条件下受到锈菌侵染,能产生锈子器,并大量分布在冬麦和春麦田边。青海东部地区广泛分布的鲜黄小檗、直穗小檗、置疑小檗、甘肃小檗、近似小檗、细叶小檗、匙叶小檗、松潘小檗、堆花小檗和秦岭小檗10 种小檗可以作为小麦条锈菌的转主寄主[31,33-34],这是青海群体可以发生有性生殖的必要条件之一。随着全球气候的变暖,耕作制度的变革,青海省东部地区冬小麦种植面积不断扩大,使得小麦条锈病的发生流行规律发生显著变化。甘肃和青海小檗种类繁多,为小麦条锈菌有性生殖发生提供了基础条件。本研究发现青海西宁地区可能存在有性生殖,群体具有很高的遗传多样性,赵杰等研究表明青海地区小檗分布较为广泛,春季小檗锈病发生非常严重[35],但目前尚未确定青海其他地区是否存在小麦条锈菌的有性生殖,需要结合更大的样本量和更多的采样点进一步深入研究证实。
4 结论
小麦条锈病春季流行期,甘肃和青海群体均具有较高的基因型多样性,甘肃地区与青海东部地区的传播路线以甘肃平凉、临夏到青海的传播为主,甘肃文县到青海的传播为辅。甘肃文县、临夏和青海西宁 3个群体存在有性生殖现象,对该地区条锈菌丰富的遗传多样性的形成具有一定作用。

