湿热-痰结-瘀毒型小鼠肠癌模型的建立
曹文 周小青

〔摘要〕 目的 建立一種湿热-痰结-瘀毒的大肠癌动物模型,为中医药预防大肠癌实验的多方位多角度开展提供模型保障。方法 将60只雄性小鼠随机分为实验A组、B组及C组,每组20只。A组腹腔注射氧化偶氮甲烷(Azoxymethane, AOM) 12.5 mg/kg;B组腹腔注射AOM 10 mg/kg ;C组一直为空白组,腹腔注射等量生理盐水,均1次。随后A、B两组行3个循环周期,自由饮用2.5%葡聚糖硫酸钠5 d+自由饮用无菌用水16 d为1个循环周期;C组自由饮用无菌用水,3组均采用高脂颗粒饲料喂养。造模结束后,断颈处死小鼠观察其瘤体组织变化。结果 与C组比较,A组和B组的造模前后的体质量差异有统计学意义(P<0.05),B组体质量变化大于A组(P<0.05);A组腺癌成癌率较高,B组腺瘤成瘤率较高,差异均有统计学意义(P<0.05);造模过程中A组死亡率大于C组,差异有统计学意义(P<0.05)。组织病理学显示A组腺癌细胞排列紊乱,乳头内间质少;B组腺瘤细胞排列呈大小不一的管状结构,腺上皮细胞数目增多,核细长,呈不同程度的异型性。结论 AOM 10 mg/kg剂量组适合腺瘤(痰结)模型,AOM 12.5 mg/kg更适合恶性肿瘤(瘀毒)模型。
〔关键词〕 结直肠癌;中医证候模型;氧化偶氮甲烷;高脂颗粒饲料
〔中图分类号〕R273 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.01.009
〔Abstract〕 Objective To establish an animal model of colorectal cancer with damp-heat, phlegm-stagnation, stasis-toxin, and to provide model guarantee for the experiment of preventing colorectal cancer by traditional Chinese medicine (TCM). Methods A total of 60 male mice were divided into an experimental group A (n = 20), a group B (n = 20), and a group C (n = 20). Group A was given intraperitoneal injection for AOM 12.5 mg/kg. Group B was given intraperitoneal injection for AOM 10 mg/kg. Group C was the blank group and was given intraperitoneal injection for the same amount of normal saline, all for once. Subsequently, Group A and B performed 3 cycles, and free drinking of 2.5% dextran sodium sulfate for 5 d + free drinking of sterile water for 16 days was a cycle; Group C had free drinking of sterile water for 3 cycles, and all of the 3 groups had high-fat pellet feed. After the modeling was completed, the mice were sacrificed by breaking neck to observe their tumor tissue changes. Results Compared with the group C, the differences in body weight before and after modeling were statistically significant in group A and group B (P<0.05). The change in body weight in group B was greater than that in group A (P<0.05); The adenocarcinoma formation rate of group A was higher, and the adenocarcinoma formation rate of group B was higher. The differences were statistically significant (P<0.05). The mortality of group A was greater than that of group C during the modeling process, and the difference was statistically significant (P<0.05). Histopathology showed disordered arrangement of adenocarcinoma cells in group A with less interstitial nipples; adenoma cells in group B had tubular structures of different sizes, increased number of glandular epithelial cells, slender nuclei, and different degrees of atypical. Conclusion AOM 10 mg/kg dose group is suitable for adenoma (phlegm-stagnation) model, and AOM 12.5 mg/kg is more suitable for malignant tumor (stasis-toxin) model.
〔Keywords〕 colorectal cancer; TCM syndrome model; azomethane; high-fat pellet feed
结直肠癌是我国消化系统常见肿瘤,近30年来,结直肠癌的发病率年均上升3%~4%,我国结直肠癌发病率和死亡例数却分别占全世界发病和死亡总例数的18.6%和20.1%,均居第1位[1]。研究发现,80%以上的结直肠癌是由结直肠腺瘤演变发展而来,结直肠腺瘤被认为是重要的结直肠癌的癌前病变[2]。正常的结直肠上皮细胞在炎症、酒精等因素作用下过度增生,形成向肠腔突出的隆起性病变,由早期腺瘤向晚期腺瘤发展,并最终形成恶性肿瘤,即结直肠癌的“腺瘤-癌序贯学说”。中医学认为大肠癌是湿热-痰结-瘀毒的演变过程,与“腺瘤-癌序贯学说”吻合。且中医药抗癌在预防肿瘤复发方面大有前途,但目前临床研究最常用的结直肠癌动物模型是移植瘤模型,尽管该模型成瘤率高,但不能模拟我们中医肿瘤病理病机演变过程,限制了中医药预防及抗肿瘤复发转移实验的进行。而啮齿类动物模型模拟腺瘤-癌的发病过程,更接近人类大肠癌发病机制[3]。研发湿热-痰结-瘀毒的大肠癌动物模型,可为中医药预防大肠癌实验提供多方位多角度模型保障。
本课题采用高脂饮食联合氧化偶氮甲烷(Azoxymethane, AOM)及葡聚糖硫酸钠(dextran sulfate sodium, DSS)模拟肠炎诱导肠癌发生过程。国内大多数资料报道均是用AOM 10 mg/kg腹腔注射1次,然后自由饮用2%~3%的DSS 5 d,3~4周期[4-6]。国外相关文献AOM 10~15 mg/kg腹腔注射1次较多[7-8],为了使造模成功率更高,稳定性更好,我们在本课题探索了两种AOM剂量,分别是10.0、12.5 mg/kg,DSS采用中间值2.5%的浓度,现就造模方法及结果报道如下。
1 材料
1.1 主要试剂
AOM(美国Sigma公司,产品型号:A5486-25MG);葡聚糖硫酸钠(dextran sulfate sodium salt, DSS)(上海甑准生物科技有限公司,产品型号:ZZR-0216011
080);无菌用水﹑0.9%生理盐水、苏木精染液、10%中性福尔马林固定液均由湖南省中医药研究院附属医院病理科提供。
1.2 主要设备
电子秤(上海舜宇恒平科学仪器有限公司,型号:FA1004);低温超速离心机(上海力申科学仪器有限公司,型号:Neofuge 23R);石蜡切片机(德国莱卡公司,型号:RM2235);病理组织烘烤仪(泰维科技,型号:TK-218);显微镜及摄像系统(OLYMPUS公司,型号:BX41);镊子、剪刀、注射器、手套、棉签、离心管由湖南省中医药研究院附属医院肿瘤中心实验室提供。
1.3 实验小鼠
C57BL/6雄性小鼠,60只,6周龄,体质量18~22 g,SPF级,购于湖南斯莱克景达实验动物有限公司(实验动物生产许可证号:SCXK(湘)2016-0002,实验动物合格证编号:43004700041870,实验单位使用许可证编号:SYXK(湘)2015-0008)。
1.4 饲养环境
饲养室保持良好通风,控制环境温度22~24 ℃,湿度40%~60%,12 h循环光照,高脂颗粒饲料喂养,自由饮水,实验室适应性饲养1周后,自第2周開始实验。
2 方法
2.1 动物分组及造模方法
60只小鼠购置饲养1周后,随机分为实验A组,B组和C组,每组20只。A组腹腔注射AOM 12.5 mg/kg,B组腹腔注射AOM 10 mg/kg,C组腹腔注射等量生理盐水,均1次,随后A、B两组分别自由饮用2.5% DSS 5 d,其余时间饮用无菌用水,21 d为1循环周期,分别循环3个周期,C组一直饮用无菌用水,均用高脂颗粒饲料喂养。造模结束,禁食1 d后,将小鼠断颈处死。
2.2 模型小鼠指标观察
2.2.1 各组小鼠一般体征观察 每天观察小鼠的毛发、大便量,每周测量小鼠的体质量,观察是否存在血便,记录小鼠死亡情况。
2.2.2 组织病理学检查 在造模结束后,禁食1 d,颈锥脱臼法处死小鼠,将小鼠固定在小鼠固定架上,剖开腹腔,从盲肠末端到肛门处取下整段结直肠,用眼科剪纵向剖开肠管,用无菌生理盐水清洁肠壁后,肉眼观察有无瘤体,并在4%的多聚甲醛液中固定,石蜡包埋,病理切片,HE染色,显微镜下确定瘤体性质。
2.3 统计学方法
所有数据均采用SPSS 22.0软件进行统计分析。计量资料结果以“x±s”表示,两样本均数比较采用成组t检验,定义检验水准a=0.05,以P<0.05为差异有统计学意义。
3 结果
3.1 各组小鼠的一般体征情况
在每个周期的最后一天测量小鼠的体质量,并计算第3周期造模成功后小鼠体质量与造模前的体质量差值,进行统计学分析,结果显示:与C组比较,A组和B组小鼠体质量增长缓慢,其中A组最慢,差异统计学意义(P<0.01或P<0.05)。见表1。
在饮用DSS第1周期的第7天,A组和B组小鼠的大便次数均开始增多变稀,7 d后大便性状恢复正常,而便次仍然多,两组均未观察到明显血便。第1周期结束后,两组小鼠毛发均有脱落,A组更严重。
3.2 各组小鼠瘤体情况
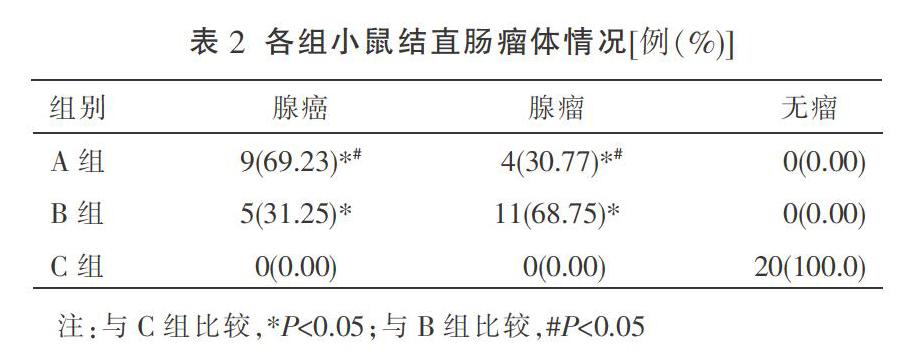
肉眼观察,A组可见肿瘤呈息肉状向肠腔突出,伴浅表溃疡,为腺癌。B组可见散发息肉,表面光滑,为腺瘤。实验小鼠结直肠可见多个散在结节,直径约0.1~0.5 cm。
与C组比较,A组和B组的腺癌成癌率、腺瘤成瘤率差异均有统计学意义(P<0.05)。A与B两组比较,A组腺癌成癌率较高,B组腺瘤成瘤率较高,差异均有统计学意义(P<0.05)。见表2。
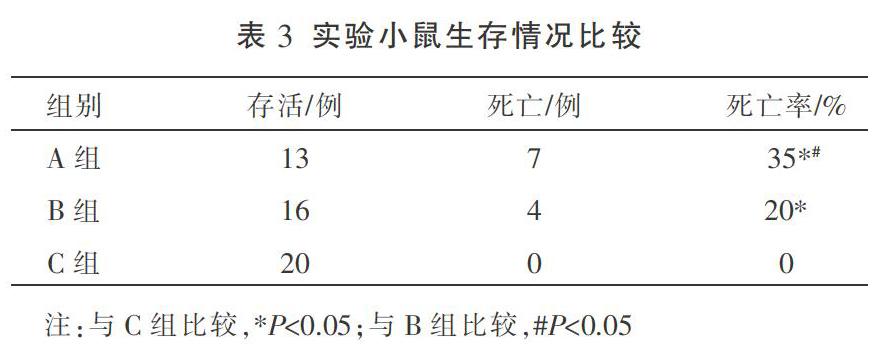
3.3 各组小鼠生存情况
实验结束时,A组小鼠死亡7只,B组死亡4只,C组无死亡。A组死亡率与B组相比,差异有统计学意义(P<0.05)。见表3。
3.4 各组小鼠瘤体组织学变化
显微镜下观察,可见腺癌细胞排列紊乱,乳头内间质少,见图1A。而腺瘤细胞排列呈大小不一的管状结构,腺上皮细胞数目增多,核细长,呈不同程度的异型性,见图1B。正常腺体见图1C。
3.5 该动物模型在成模过程中的证候演变
注射AOM前小鼠活泼好动,注射药物后,小鼠精神萎靡,蜷缩活动减少,倦怠乏力,饮用DSS后,小鼠大便次数增多变稀,毛发脱落,体重明显减轻,特别是A组。参照中医诊断学[12],按照中医方法学-类比法,注射药物前小鼠为平和质,给予高脂饮食联合AOM及DSS后,小鼠为湿热-痰结-瘀毒证型。在实验动物具体表现为:造模第1周期湿热证:小鼠腹泻、便次增多,伴有黏液,肛门发红;第2周期痰结证:大便性状恢复正常,但便次仍多,部分小鼠出现腺瘤;第3周期瘀毒证:大便次数减少,腺瘤癌变,小鼠体质量明显减轻,为恶病质。
4 讨论
啮齿类动物模型是临床实验最常用的动物模型,模拟湿热-痰结-瘀毒型结直肠癌发病机制的动物模型对结直肠癌中药新药的研发有重要的意义。
据周凤等[13]报道,高脂饮食联合AOM及DSS诱导法更符合临床脂代谢异常与肠息肉发病的密切相关性。每个周期的第1天给小鼠腹腔注射AOM(10 mg/kg),连续3周期,并饮用3%DSS水3 d+灭菌水4 d,第4周期后只饮用3%DSS水3 d+灭菌水4 d,重复6个周期,高脂饲料和DSS同步干预。第9个周期所有小鼠均出现腹泻、稀便,部分小鼠有肉眼血便,不典型增生发生率为75%。该模型造模周期短,说明高脂饮食可以加重AOM及DSS诱导的小鼠UC及其不典型增生。该方法的缺点为不能模拟腺癌的发生。另张华月等[14]报道,AOM与DSS联合诱导法,第1天腹腔注射AOM(12.5 mg/kg),第6天起连续5 d饮用2.5%DSS水,21 d为1周期,循环3周期。第4周小鼠出现急性黏膜炎和畸形腺窝灶,7周出现腺瘤中-重度不典型增生改变,14周出现腺癌。该造模方法较好地模拟人类肠炎向肠癌进展过程,但缺点是造模时间过长。
我们目前需要一种既能较好模拟人类肠炎向肠癌进展过程又周期相对较短的动物模型。徐德魁等[15]报道,高脂饮食后,脂类在消化道代谢过程中产生的一些产物,如次级胆酸、硫化氢等可损害大肠黏膜,破坏肠道内微环境,引起菌群失调,导致黏膜炎症。黏膜损伤,肠道细菌可移位到肠黏膜内,激发炎症反应对结肠组织进一步破坏。本实验采用了AOM+DSS诱导造模的优点及高脂饮食破坏肠道的特点,用高脂饮食联合不同剂量的AOM+2.5% DSS造模,发现:如果用AOM 10 mg/kg剂量,腺瘤成瘤率较高,本次实验为68.75%,用AOM 12.5 mg/kg,腺癌发生率较高,约69.23%,但注射AOM时需严格掌握剂量,剂量超过,将直接导致小鼠肠道坏死,小鼠大量死亡。
中医认为,大肠癌是在内外因素作用下,由湿热、瘀毒等浸淫腸道所致。湿邪致病具有缠绵难愈的特性,并可严重阻滞气机,湿邪在肠癌的发生发展过程中具有特殊作用。湿邪阻滞日久,气血失调,气滞可阻津,进而生痰,气滞痰阻又可碍血运行,出现瘀血,进而痰瘀互结,迁延难愈,久而成毒,于是菀郁壅遏,化为癌肿。痰结是由湿热发展为瘀毒的中间过程,在此过程中,湿热可化生为有形之邪——痰,结直肠癌是由结直肠腺瘤(痰结)演变发展而来,结直肠腺瘤被认为是重要的结直肠癌的癌前病变。上述实验过程显示,结直肠癌形成的3个周期可能为湿热-痰结-瘀毒。
综上所述,由高脂饮食联合AOM和DSS模拟的炎性结直肠癌小鼠模型符合中医大肠癌湿热-痰结-瘀毒的演变过程,AOM 10 mg/kg剂量组适合腺瘤模型,AOM 12.5 mg/kg更适合恶性肿瘤模型,且9周成功造模。本实验为中医药物研究结直肠癌提供了相对成熟的模型,对研发预防和治疗结直肠癌的中药新药提供了模型保障,具有一定的科学价值。
参考文献
[1] 郑 树,张苏展,黄彦钦.结直肠癌研究30年回顾和现状[J].实用肿瘤杂志,2016,31(1):2-5.
[2] 秦 文,庄丽维,李 滨,等.IGF-Ⅰ调节血脂异常在结直肠腺瘤发生和恶变中的作用[J].现代生物医学进展,2013,13(11):2168-2171.
[3] CORPET D E, PIERRE F. How good are rodent models of carcinogenesis in predicting efficacy in humans? A systematic review and meta-analysis of colon chemoprevention in rats, mice and men[J]. European Journal of Cancer, 2005, 41(13): 1911-1922.
[4] 张 悦,田 洁,田新宇,等.氧化偶氮甲烷和葡聚糖硫酸钠致肠炎相关性结直肠癌小鼠模型的建立[J].江苏大学学报(医学版),2015, 1:19-21.
[5] 林凯璇,瞿秀华,赵晓航.AOM/DSS模型与炎症相关癌变研究进展[J].生命科学,2012(3):228-235.
[6] 李文彬.炎症因子和益生菌在溃疡性结肠炎癌变中的作用与相关机制研究[D].北京:北京协和医学院,2017.
[7] ANGELOU A, ANDREATOS N, ANTONIOU E, et al. A novel mod?鄄
ification of the AOM/DSS model for inducing intestinal adenomas in mice[J]. Anticancer Research, 2018, 38(6): 3467-3470.
[8] PARANG B, BARRETT C W, WILLIAMS C S. AOM/DSS model of colitis-associated cancer[J]. Methods in Molecular Biology, 2016: 1422:297.
[9] SUZUKI R, KOHNO H, SUGIE S, et al. Strain differences in the susceptibility to azoxymethane and dextran sodium sulfate-induced colon carcinogenesis in mice[J]. Carcinogenesis, 2005, 27(1): 162-169.
[10] KOHNO H, SUZUKI R, CURINI M, et al. Dietary administration with prenyloxycoumarins, auraptene and collinin, inhibits colitis-related colon carcinogenesis in mice[J]. International journal of cancer, 2006, 118(12): 2936-2942.
[11] BECKER C, FANTINI M C, WIRTZ S, et al. In vivo imaging of colitis and colon cancer development in mice using high resolution chromoendoscopy[J]. Gut, 2005, 54(7): 950-954.
[12] 朱文峰.中醫诊断学[M].北京:中国中医药出版社,2007:4-5.
[13] 周 凤,刘维新,于艳红,等.高脂饮食对诱导的小鼠不同周期溃疡性结肠炎的影响及白细胞介素的改变[J].中国医科大学学报,2017,46(3):232-237.
[14] 张华月,李 琦,付晓伶.结直肠相关癌前病变动物模型的研究进展[J].中国医药导报,2018,15(5):27-31,36.
[15] 徐德魁,郎绪龙,于庆功,等.高脂饮食对结肠炎小鼠肿瘤坏死因子-α表达的影响[J].中华实用诊断与治疗杂志,2014,28(11):1075-1076.
(本文编辑 苏 维)

