硫化氢对断奶仔猪生长性能及免疫性能的影响
陈小风,崔 嘉,杨新宇,吴峰洋,陈宝江,3*
(1.河北农业大学 动物科技学院,河北 保定 071000;2.唐山古冶区农业农村局,河北 唐山 0631002;3.河北省牛羊胚胎工程技术研究中心,河北 保定 071000)
畜舍内空气环境对养猪业至关重要,舍内的空气质量直接影响猪群健康。硫化氢(hydrogen sulfide,H2S)是一种毒性很大的神经毒剂,无色且易挥发、拥有刺激性气息,是猪舍中危害性最大的气体之一[1]。我国畜禽场环境质量标准(NY/T388)要求,猪舍内硫化氢最高不得超过10 mg/m3[2]。现代猪场多采用封闭式管理,通风不畅,被微生物还原为硫酸盐有机物,大量蓄积,会导致硫化氢浓度超标。有研究报道,硫化氢会使畜禽的日常行为、呼吸系统、免疫系统、机体抗氧化性受损[3]。硫化氢是具有生物学效应的气体小分子,它在免疫系统中发挥重要的调节功能[4],但其作用机制尚完全不清晰,本试验从生长性能及免疫角度进行分析,为阐明硫化氢的毒性作用提供参考。
1 材料与方法
1.1 试验材料与方法选取24头(11.25±1.01) kg 35日龄断奶仔猪(杜×长×大),随机分为4个处理,每个处理组6个重复,每个重复1只。将其随机放置于4个结构相同的环境控制舱内(23.5 m×2.5 m×2.5 m),控制硫化氢浓度(0,5,10,15 mg/m3)为唯一变量(NH3<0.3 mg/kg,CO2<1.5 g/kg)。常规饲养,每天8:00和18:00进行饲喂,自由饮水。传感器监测屋内硫化氢浓度,气体检测变送器根据检测结果加注或减排舍内H2S含量使舍内H2S浓度保持在设定的浓度。预饲7 d,正式试验28 d。试验期间各组饲喂同一种饲料,试验日粮组成及营养水平见表1。试验时间为2018年8月9日至2018年9月6日;试验地点为河北农业大学西校区。
1.2 样品采集在试验开始时以个体为单位对所有试验猪空腹称质量,并详细记录数据;试验过程中详细记录每个重复的采食量,并统计腹泻、死亡和淘汰情况。试验结束后前腔静脉采血,置于促凝管37℃ 温浴2 h后,3 500 r/min离心10 min,分离血清至离心管内保存。
在试验结束前收集各组饲料样品并保存。试验结束前3 d,连续收集仔猪的粪便,称质量后重复混合,1式2份,其中1份喷洒10%盐酸溶液进行固氮以便于后续粗蛋白质测定,将样品置于-20℃冰箱内冷冻保存,以便后续样品测定。
1.3 样品检测
1.3.1常规检测 GB/T6432-1994法检测粗蛋白含量;GB/T6433-2006法检测粗脂肪含量;GB/T6436-2002法检测钙含量;GB/T6437-2002法检测磷含量;GB/T 23742-2009法检测酸不溶灰分含量;氧弹式燃烧测热法检测总能含量。日粮中营养物质表观消化率公式如下:
日粮中营养物质表观消化率=100% -(A0/A1×C1/C0)×100,式中A0为日粮中酸不溶性灰份(AIA)含量;A1为粪中AIA含量;C0为日粮中营养物质含量;C1为粪中营养物质含量。
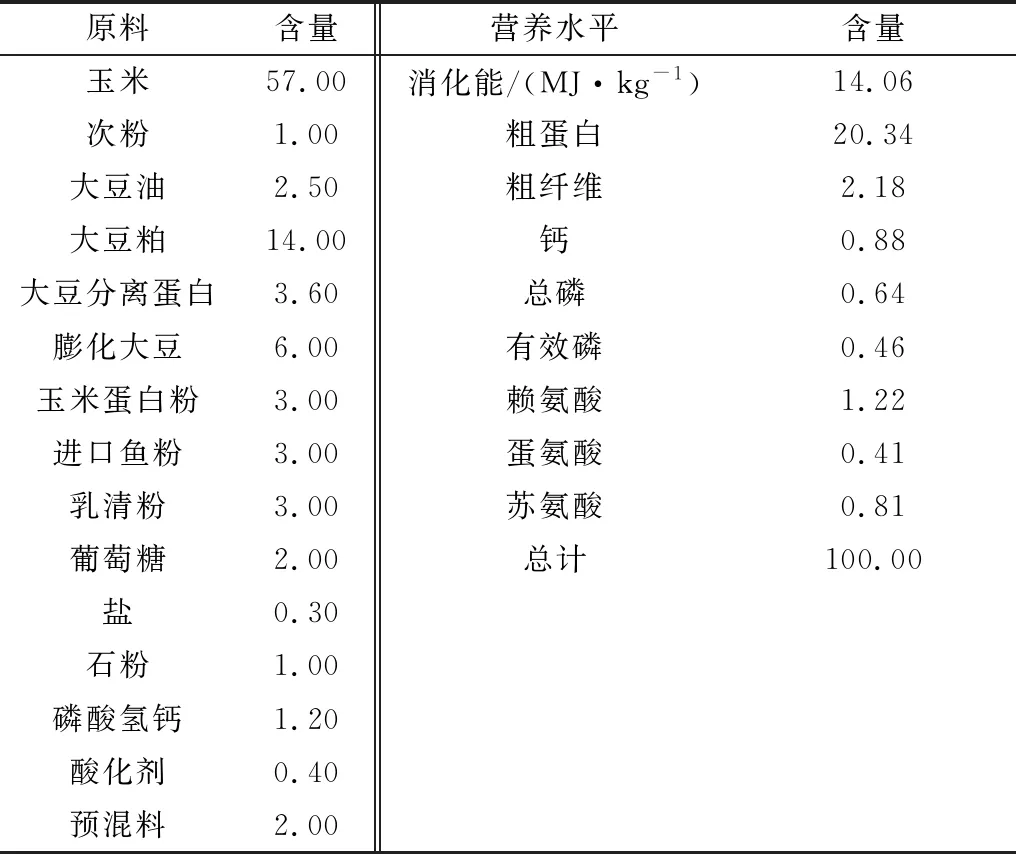
表1 日粮营养物质组成及其含量(风干基础) %
1.3.2血清指标测定 IgA、IgM、IgG、IL-4、Il-6、TNF-α、MDA、SOD、BAX、Bcl-2、Caspase3、Caspa-se8和 Caspase9采用ELISA法测定,试剂盒购自北京市海瑞祥天生物科技有限公司。

2 结果
2.1 硫化氢对断奶仔猪生长性能的影响硫化氢胁迫的各组中,试验组平均日增体质量极显著低于对照组(P<0.01);随硫化氢浓度增高而降低,试验2,3组采食量极显著降低对照组(P<0.01);试验1,3组料重比极显著高于对照组(P<0.01),试验2组显著高于对照组(P<0.05)(表2)。
2.2 硫化氢对断奶仔猪腹泻率及死亡率的影响由表 3可知,与对照组相比,随着硫化氢浓度的升高,仔猪的腹泻率有上升的趋势,粪便评分降低,但均无显著差异(P>0.05)。在试验浓度下,各组均无猪只死亡。
2.3 硫化氢对断奶仔猪营养物质表观消化率的影响与对照组相比,各处理组蛋白表观消化率分别降低了6.77%,9.58%和9.17%,差异显著(P<0.05);粗纤维分别降低5.26%,5.49%和10.36%,其中试验3组差异显著(P<0.05);各试验组粗脂肪、钙、磷的表观消化率均低于对照组(P>0.05);其中粗脂肪分别降低1.68%,3.57%和4.03%;钙分别降低1.45%,0.98%和0.65%;试验1,3组磷分别降低0.49%和1.43%;试验2,3组能量表观消化率均显著低于对照组,分别降低了9.34%和9.85%(P<0.05)(表4)。

表2 硫化氢对断奶仔猪生长性能的影响
2.4 硫化氢对断奶仔猪免疫球蛋白含量的影响与对照相比,各试验组IgA含量分别降低2.76,5.16和13.34 mg/L,其中试验3组降低显著(P<0.05);试验组IgG分别降低3.91,6.01和5.02 mg/L(P>0.05); IgM分别降低4.52,2.99和3.48 mg/L(P>0.05)(图1)。
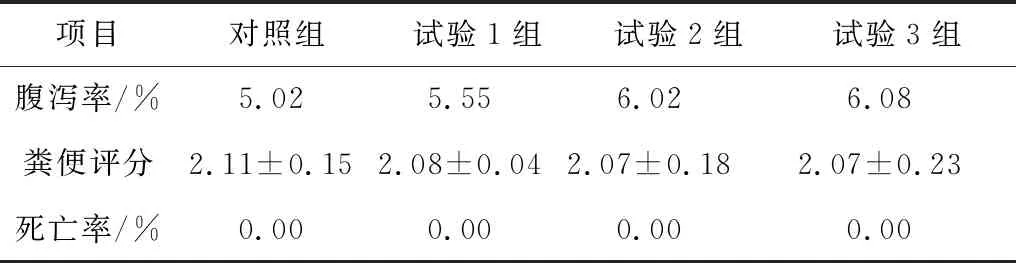
表3 硫化氢对断奶仔猪腹泻率和粪便形态的影响
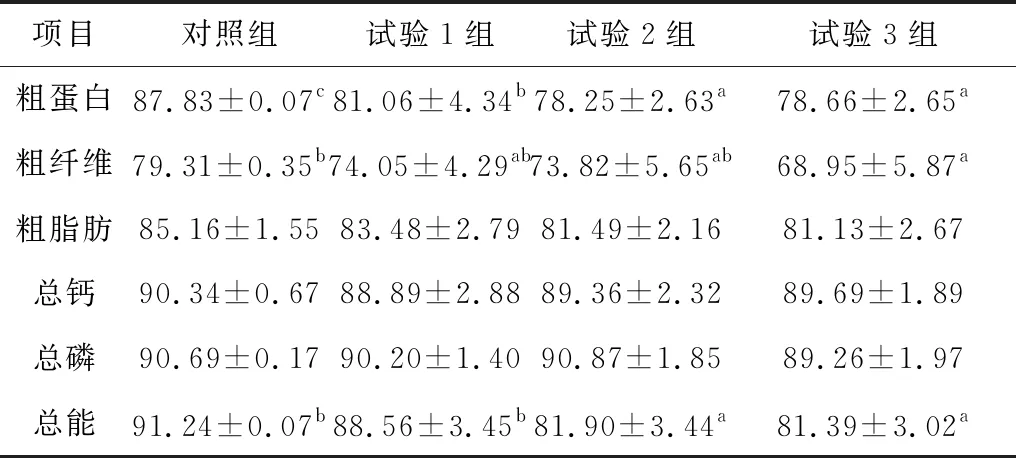
表4 硫化氢对断奶仔猪营养物质消化率的影响 %
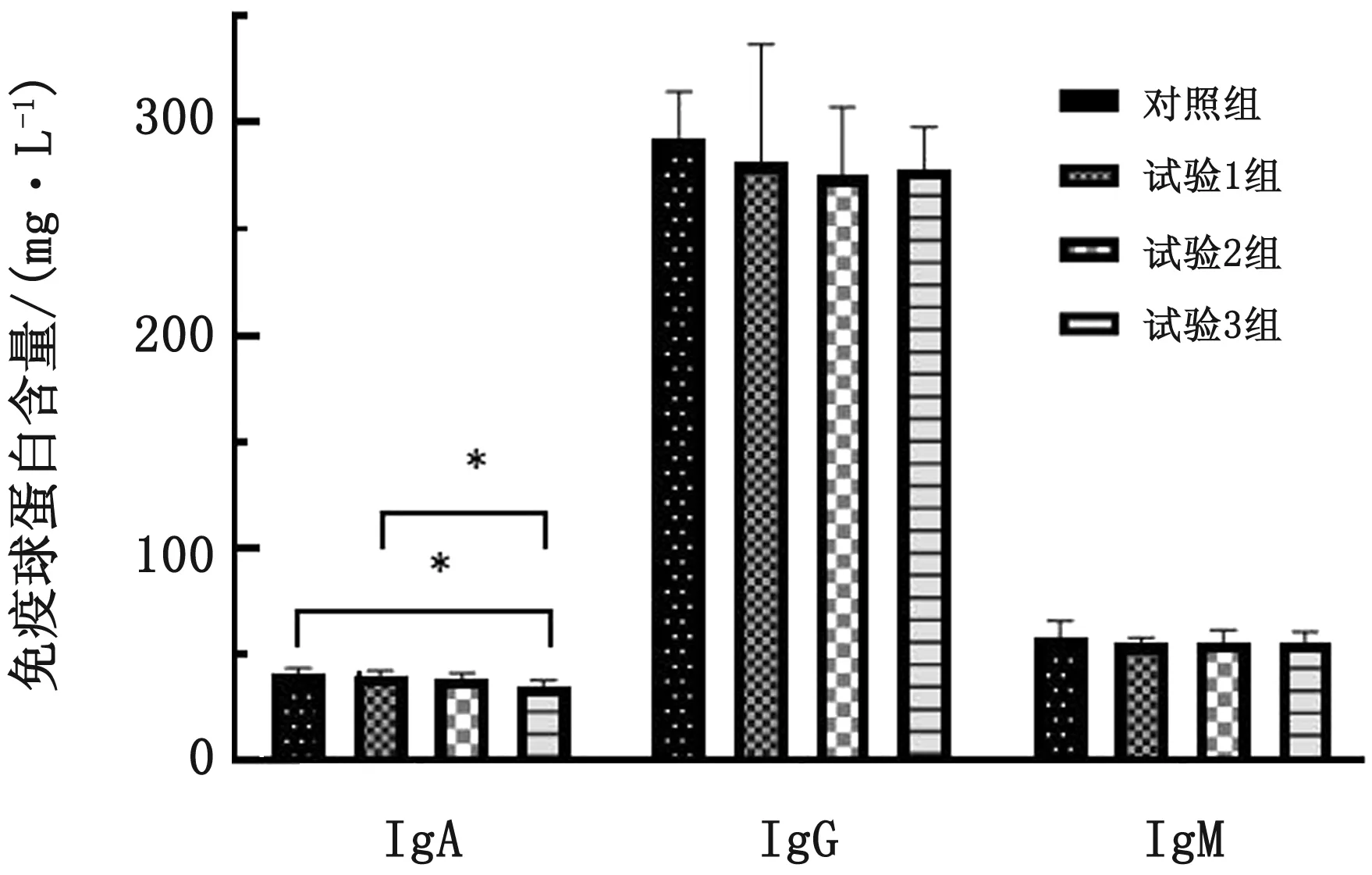
图1 硫化氢对断奶仔猪免疫球蛋白含量影响
2.5 硫化氢对断奶仔猪炎性因子水平的影响与对照组相比,试验组IL-4分别升高1.62,2.14和5.78 ng/L(P>0.05);试验组的IL-6分别升高1.89,4.51和9.11 ng/L,试验3组较对照组显著增高(P<0.05);TNF-α分别降低2.73,16.27和11.01 ng/L(P>0.05)(图2)。
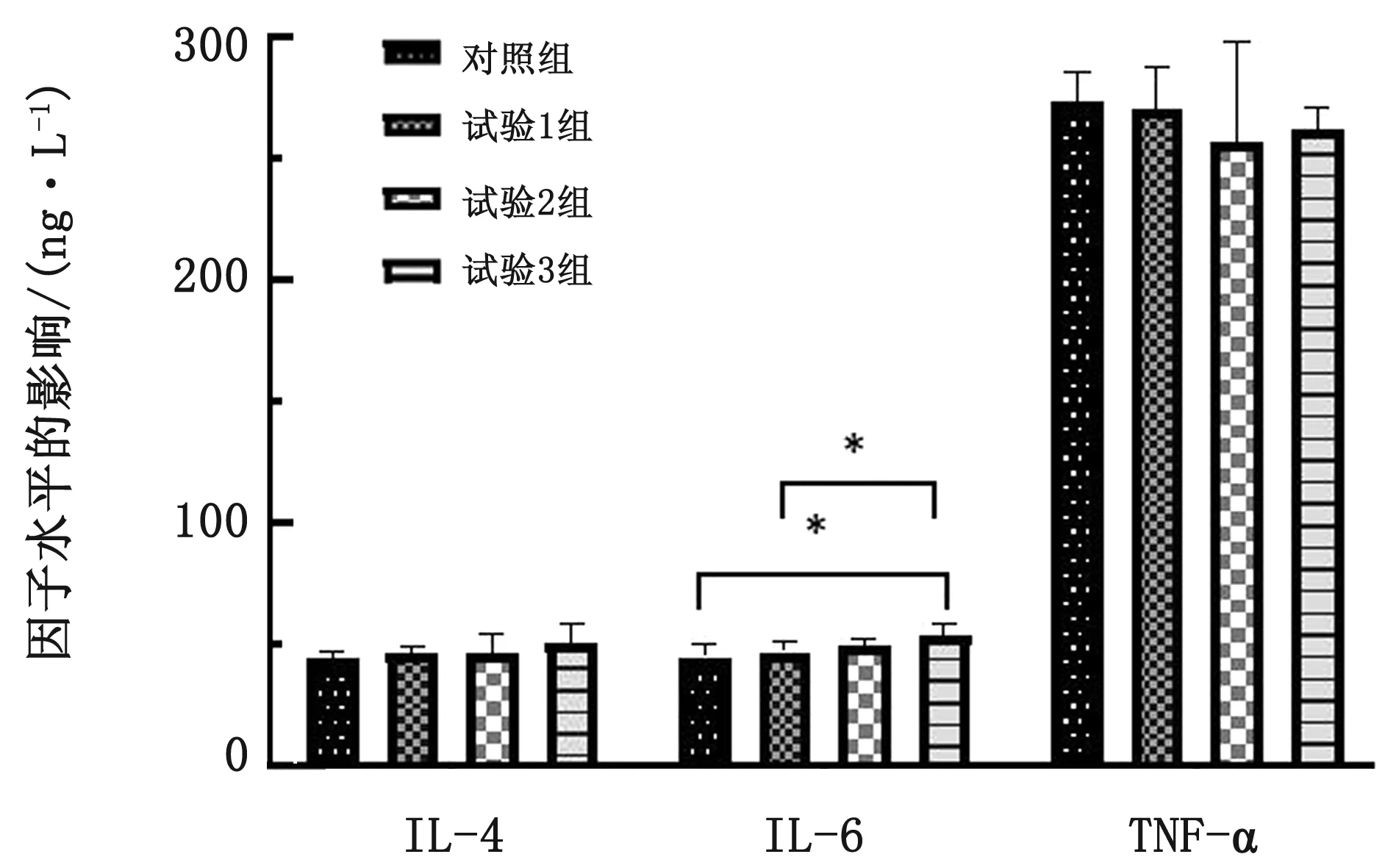
图2 硫化氢对断奶仔猪细胞免疫含量影响
2.6 硫化氢对断奶仔猪肠细胞凋亡因子水平的影响试验组BAX含量有下降趋势,试验2,3组分别降低32.99和26.78 ng/L(P>0.05);处理组Bcl-2含量升高,且试验2,3组显著增加29.84和29.98 ng/L(P<0.05);Caspase-3含量分别下降0.72,2.28和6.08 μg/L(P>0.05);试验3组Caspase-8显著降低1.06 μg/L(P<0.05);试验2组 Caspase-9 显著降低3.19 μg/L(P<0.05)(图3)。
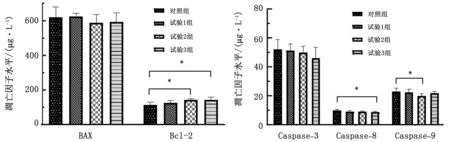
图3 硫化氢对断奶仔猪细胞凋亡因子影响
2.7 硫化氢对断奶仔猪抗氧化能力的影响与对照组相比,处理组MDA含量升高,试验1,2组分别升高1.50和1.86 mmol/L,试验3组增高3.48 mmol/L(P<0.05);试验组SOD活性降低,试验1,2组分别降低8.65和15.84 μg/L,且试验2组极显著降低24.98 μg/L(P<0.01)(图4)。
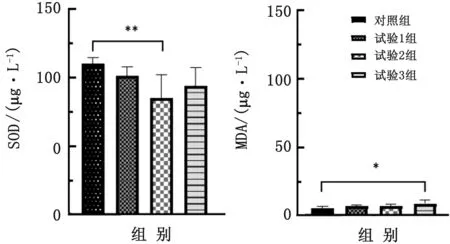
图4 硫化氢对断奶仔猪抗氧化性的影响
3 讨论
3.1 硫化氢对断奶仔猪生长性能的影响外源性的硫化氢脂溶性较强,主要通过呼吸道和消化道进入机体,可快速穿过生物质膜结构,在细胞质和线粒体间进行自由扩散,硫化氢作为一种新型的炎性介质,可参与不同的炎症反应,引起中枢神经系统及呼吸系统损伤,致使畜禽生长缓慢,从而影响畜禽的生长性能[5]。孟庆平等[6]试验结果表明,0~3周的肉仔鸡处于(2~8) ×10-6的硫化氢环境下,试验组ADG及ADFI显著降低,F/G显著增加。WANG等[7]报道也表明,鸡的日采食、日增重会随着硫化氢浓度的增加而减少。DAVID等[8]试验表明,在80×10-6硫化氢环境中,试验鼠的采食量明显下降。孙建忠等[9]报道20 mg/kg 硫化氢使猪食欲不振,超过50 mg/kg 猪开始出现呕吐、腹泻。本试验结果与上述研究结果相近。出现这一现象可能的原因是硫化氢是一种刺激性气体,与呼吸道黏膜接触发生碱化作用生成Na2S,进入血液后水解释放出硫化氢,从而引起呼吸系统疾病和眼部损伤,影响了仔猪的食欲,降低采食量,最终降低仔猪生产性能。同时硫化氢的吸收,也会通过结合Fe3+与谷胱甘肽的巯基,抑制机体内呼吸链的电子传递与细胞生物氧化过程,从而降低仔猪对氧气的利用能力,引起缺氧,这也是降低仔猪采食量的原因之一。高浓度硫化氢更能刺激神经中枢,造成动物体嗅觉神经快速损伤及基底神经节异常,损害动物免疫机能,并引发炎症,使用于生长发育的能量减少,造成生产性能降低[10]。本试验中,处理组仔猪生长速度、采食量下降,饲料转化率降低,主要养分及能量利用率降低,腹泻率升高,说明硫化氢刺激会导致仔猪的健康受损,生长抑制。
3.2 硫化氢对断奶仔猪免疫球蛋白含量的影响机体的免疫系统能够识别和清除非自身的大分子物质,从而激活维持机体内外环境平衡的生理学反应[11]。应激后会发生免疫激活,但长期的免疫激活可以改变畜禽行为、代谢和神经内分泌,最终抑制生长[12]。免疫球蛋白(Ig)是免疫活性因子的关键成员之一,IgA、IgG和IgM在机体特异性免疫中发挥重要作用[13]。IgA 具有最高的日合成率,在受到抗原刺激后产生的抗体中约80%是IgA。IgM 通过结构中的五聚体,发挥其抗感染作用和免疫调节等功能,通过激活补体系统的替代途径使细菌裂解增加。IgG具有中和毒素和病毒、调节吞噬作用、激活补体经典途径等功能,在抗感染免疫尤其是再次免疫应答中发挥重要作用。孟庆平等[6]研究表明,高浓度硫化氢会降低肉鸡血清IgA、IgG和IgM水平。王飞等[14]试验发现随着硫化氢浓度升高应激程度增加,血清IgA、IgM和IgG含量显著降低。本试验中,随硫化氢浓度升高,对机体的刺激加强,血清IgA、IgG和IgM水平随之降低,机体的免疫力减弱,表明硫化氢的刺激抑制了仔猪血液Ig合成,对断奶仔猪的免疫功能有一定的抑制作用。
3.3 硫化氢对断奶仔猪抗氧化力的影响抗氧化系统是机体清除体内多余的活性氧、保护自身免受氧化损伤的重要体系[15]。超氧化物歧化酶(SOD)和丙二醛(MDA)是指示机体氧化水平的重要指标[16-19]。本试验中,处理组SOD活性较对照组均降低,MDA水平升高或显著性升高,说明硫化氢刺激可以通过抑制SOD活性,使脂质发生过氧化反应,导致断奶仔猪的过氧化应激。这与高晶等[20]在肉鸡与赵天等[21]在羊试验中得到的研究结果相近。出现这一结果的原因为硫化氢刺激使机体长期处于应激状态,导致抗氧化酶活性低于正常水平而不足以及时清除大量的自由基,造成机体氧化和抗氧化的失衡,从而使细胞破坏,造成脂质过氧化,MDA大量分泌。
3.4 硫化氢对断奶仔猪炎性因子水平的影响白介素 4( IL-4),是趋化因子家族的一员,也是一种抗炎因子。本试验中处理组IL-4水平高于对照组,与赵天等[21]和李国峰等[22]的研究结果相近,白介素6(IL-6),是机体发生炎症反应时血液中标志性的指标之一,是一种前炎症因子,为炎症反应的主要调节介质,参与血管的炎症反应和免疫应答[23],是炎症反应的促进因子。本试验中,各试验组仔猪血液IL-6水平均高于或显著高于对照组,与李国风等[22]研究结果相近。肿瘤坏死因子α(TNF-α),是对抗肿瘤作用效果非常明显的因子之一,也是一种炎症促进因子。本试验中试验组TNF-α水平降低,表明试验量硫化氢对TNF-α因子有一定影响。赵天等[21]在青年母羊的生长环境中添加不同浓度的氨气和硫化氢混合气体,结果表明,试验组血清中IL-1β、IL-6和抗炎因子IL-10均显著的升高,与本试验结果一致。造成这一结果的原因是硫化氢引发了仔猪的炎症反应,促炎因子水平升高,造成机体的炎症损伤,机体免疫系统的作用下,抗炎因子水平也相应升高,恢复硫化氢胁迫造成的影响。
3.5 硫化氢对断奶仔猪肠细胞凋亡因子水平的影响促凋亡基因Bax和抑凋亡基因BCL-2以及Caspase-3、Caspase-9在细胞凋亡过程中发挥着重要的调控作用。硫化氢在微摩尔量下,可以改变参与血管舒张、代谢、细胞凋亡和线粒体电子传递链(ETC)的各种信号通路,还可以通过抑制p38MAPK 途径间接下调BCL-2水平,下调NFκB水平、激活Caspase 3诱导细胞凋亡[24-25]。张成玉等[26]报道高浓度的硫化氢环境对细胞的凋亡有相反的促进作用。闫辉等[27]为4周龄雄性大鼠注射56 μmol/kg硫化氢前体物质 NaHS,发现硫化氢对平滑肌细胞的增殖有显著的抑制作用,并且能通过降低Bcl-2等的表达,激活Caspase3引起平滑肌细胞凋亡。李国风等[22]在大鼠的相关研究中发现,硫化氢的处理导致大鼠Bax和Caspase-3蛋白表达下降,Bcl-2的表达上升。王飞等[14]试验发现,小鼠免疫器官中凋亡因子Caspase-3和Caspase-9随着硫化氢浓度升高而逐渐升高。本试验结果显示,试验组血清中BAX与Caspase-3、Caspase-8以及Caspase-9含量低于或显著低于对照组,Bcl-2含量高于或显著高于对照组,说明硫化氢刺激导致仔猪机体受损,细胞凋亡速度加快。这与YANG等[27]研究结果相近。产生这一现象可能的原因是硫化氢通过影响细胞色素C氧化酶的功能作用,影响线粒体的呼吸作用,引起细胞内部线粒体途径的凋亡,同时,硫化氢还可以通过细胞外部死亡受体途径调控自由基形成﹑内质网应激、谷胱甘肽和细胞内铁的释放发挥促凋亡作用[28-29]。

