沙门菌Hfq依赖型小RNA GcvB靶基因trpE的鉴定
潘 永,杨 阳,李 晨,刘丽娟,杨 琦,5*
(1.贵州大学 动物科学学院,贵州 贵阳 550025;2.贵州大学 动物疫病研究所,贵州 贵阳 550025;3.贵州省畜禽资源遗传管理站,贵州 贵阳 550025;4.都匀市动物疫病预防控制中心,贵州 都匀558000;5.贵州省动物疫病与兽医公共卫生重点实验室,贵州 贵阳 550025)
鼠伤寒沙门菌(Salmonellatyphimurium,serovartyphimurium LT2,STM LT2)是最常见于人类和动物胃肠道感染中分离的血清型之一,也是研究最多的细菌病原体之一[1]。因其重要且生长要求较低并易培养,长期被视作研究细菌的模型之一。
细菌小RNA(small RNA,sRNA)是普遍存在于细菌中长度约为40~500 nt的非编码RNA分子。目前可把sRNA分为3类[2],其中最重要一类sRNA具有调控细菌基因转录后表达作用,sRNA能与靶mRNA相互作用并影响mRNA的稳定性进而抑制或促进mRNA翻译[3]。STM LT2中已经报道过的sRNA 以GcvB的研究为主,研究表明,GcvB在与STM LT2大部分靶mRNA作用时依赖伴侣蛋白Hfq调节,该伴侣蛋白通过与GcvB协同作用影响STM LT2毒力、营养物质的摄取、氨基酸合成以及应激反应机制等[4]。因此,更多 GcvB的生物学功能还待研究。
此前,关于GcvB研究主要在大肠杆菌和沙门菌中,以Hfq为切入点,筛选受Hfq及GcvB共同作用的靶基因。到目前为止,在STM LT2中已鉴定的受GcvB及Hfq调控的靶标至少20个[5],除此之外,自GcvB 3个种子结合区被证实以来,建立种子结合区R1(TTGGCTTACGGTTGTGATGTTGTGTTGTTGTGTTTGCAATTGGTCTGCG)、R2(ACUUCCUGUA)和R3(CUGUC)区的单敲除或多敲除的模型筛选受GcvB调控的靶基因也成为另一种命中率较高的方式[6]。MURPHY等[7]1998年首先尝试用λ噬菌体Red重组系统在大肠杆菌中构建基因缺失,由此建立了新的原核缺失操作技术,之后在辅助性质粒pKD46中表达整套Red同源重组系统,首创两步同源重组法,使原核缺失变得简单高效。本实验室前期转录组研究结果显示STM LT2gcvB或Hfq基因的缺失导致编码邻氨基苯甲酸合酶Ⅰ和参与氨基酸生物合成和代谢的trpE基因转录水平分别上调2.2和2.4倍,但该研究仅在转录水平验证了trpE基因受GcvB和Hfq调控,是否在蛋白表达水平受到影响并未探究。
本研究通过Red同源重组系统构建trpE基因的lac融合,通过P22噬菌体转导技术构建gcvB和Hfq基因单缺失及双缺失株,β半乳糖苷酶试验检测该基因的蛋白表达活性,并结合生物信息学系TargetRNA2分析trpE基因与GcvB R1区的作用关系,旨在验证STM LT2 sRNA GcvB的靶标trpE基因,为GcvB的调控机理研究奠定基础。
1 材料与方法
1.1 主要试验材料试验菌株3409(STM LT2 wild)、10241(STM LT2 gcvB::cat)和10675(STM LT2 Hfq::tet);Red同源重组系统涉及质粒pKD46为同源重组的辅助质粒,含有温度敏感复制子,≥37℃培养可去除,20%阿拉伯糖诱导后能够表达Gam、Beta和Exo 3个λ噬菌体重组酶;pKD13含卡那霉素(kn)抗性基因和FRT位点 (FLP重组酶识别位点), 为重组转化子提供筛选标志;pCP21是含氨苄青霉素(Amp) 抗性和氯霉素(Cm)抗性基因的温度敏感型质粒,能够表达FLP重组酶,≥37℃培养可去除,该质粒用于消除FRT位点间的kn基因;pCE40为携带lac基因的质粒(lac基因表达半乳糖苷酶,lac基因无起始密码子,该基因上游4 nt处有单FRT位点,在FLP重组酶的作用下能与另单一FRT位点产生融合);转导用的P22噬菌体,以上所有材料均由法国国家科学研究中心(CNRS)分子遗传学Bossi实验室惠赠;pfu高保真酶和ONPG购自北京索莱宝科技有限公司。
1.2trpE基因lac融合菌株的构建
1.2.1引物设计 P1和P2中下划线序列分别与trpE基因两翼同源,未加下划线部分与质粒pKD13 kn基因两侧同源,P5和P6位于trpE基因同源重组区两侧,P3和P7均来自trpE基因同源重组区上游侧,P4和P8分别来自于trpE基因插入的kn和lac序列,P9和P11分别来自于gcvB和Hfq同源重组区上游侧,P10和P12分别来自插入的(Con)和四环素(tet)抗性序列,引物送往上海英潍捷基生物科技有限公司合成(表1)。

表1 扩增所用引物
1.2.2打靶PCR产物的制备纯化 Touchdown PCR进行80 μL反应体系扩增。反应体系为:pKD13模板(10 mg/L)10 μL,引物P1和P2各1 μL,Pfu DNA Polymerase(5 U/μL)0.25 μL,Taq DNA Polymerase(5 U/μL)0.75 μL,dNTPs Mix(10 mmol/L)2 μL,10×PFU Buffer 2 μL,10×Taq Buffer 6 μL,ddH2O 57 μL。反应条件:95℃ 6 min;95℃ 10 s,60℃ 30 s,72℃ 90 s,循环5次;95℃ 10 s,53℃ 30 s,72℃ 90 s,循环20次;72℃ 8 min。产物取10 μL经琼脂糖凝胶电泳检测,若无特异性条带产生则将剩余产物用产物纯化试剂盒回收并测量DNA浓度。
1.2.3Red重组酶的诱导和第1次同源重组 按1∶100取3409过夜菌液于5 mL 液体LB中30℃培养至D600为0.4~0.6,10%甘油洗涤3次后50 μL 10%甘油悬浮即为电转化感受态细胞,将1 μL pKD46(浓度约为100 ng)与50 μL感受态细胞混合并转入0.1 cm的Bio-Rad电极杯中,按Bio-Rad电转仪预定参数2.5 kV 5.8 ms电击转化并迅速加入1 mL SOCS复苏液,将杯内液体转出并于摇床30℃ 170 r/min培养1 h,取200 μL涂布于Amp的LB平板,挑单个阳性菌30℃过夜培养并在26 μL 20%阿拉伯糖的诱导下制备40 mL菌液终体积100 μL 的电转化感受态细胞,取上述制备的PCR产物(质量浓度约为200 mg/L)5和50 μL感受态细胞混合电击,37℃复苏后取100 μL涂布于Kn抗性LB平板,挑单个菌落PCR及测序鉴定。
1.2.4FLP酶的诱导及专一性重组 将编码FLP专一性重组酶的质粒pCP21电转化入重组菌STM trpE::kn,涂布于Amp抗性平板30℃培养后,筛选阳性转化子,30℃制备感受态细胞,将质粒pCE40电转化入FRT疤痕重组菌株STM trpE::scar,涂布于Kn抗性平板37℃培养,筛选阳性转化子划线培养于Kn抗性麦康凯培养基。
1.3 噬菌体转导构建gcvB和Hfq基因的单缺失及双缺失制备P22肉汤:2 mL 50×E、1 mL 20%葡萄糖和0.1 mL P22噬菌体混合并用液体LB定容至100 mL。取2 mL P22肉汤与过夜培养的10241和10675各500 μL混合并于37℃过夜培养,转入2 mL 离心管12 000 r/min离心3 min并取上清加入3滴氯仿充分振荡,4℃静置1 h,20 μL上清加入1 mL LB 稀释,20 μL稀释后样本与过夜培养的重组菌STM trpE::lac混合后37℃ 170 r/min培养1 h,各取200 μL涂布于Cm、tet抗性和双抗平板37℃过夜培养,筛选相应阳性转化子,挑单个菌落划线至相应抗性LB平板培养,挑单个菌落划线至EBU平板直到验证噬菌体已丢失。
1.4 β半乳糖苷酶试验分别将trpE::laz、trpE::laz△gcvB、trpE::laz△Hfq和trpE::laz△Hfq△gcvB基因型菌株培养至对数早期(D600值为0.3~0.5),准确测量并记录D600值,重复3次取平均值。设4个试验组,1个对照组,试验组将500 μL菌液与500 μL Z缓冲液混合于转导型玻璃管,对照组加入1 mL Z缓冲液。用巴斯德吸管向各组加入1滴甲苯并漩涡振荡30 s,于42℃恒温水浴2 h后立即转入28℃恒温水浴5 min,加入0.2 mL ONPG(4 g/L)并记录每个组的时间t0,待溶液变黄,加入0.5 mL 1 mol/L Na2CO3终止反应并记录时间tf,将各组溶液转入2 mL离心管12 000 r/min离心3 min,测量各组上清D420值,重复3次取平均值,带入公式1 000×D420/ (tf- t0)×0.5×D600计算β半乳糖苷酶活性。
1.5trpE基因与GcvB R1区作用位点的预测登陆网站(http://cs.wellesley.edu/~btjaden/TargetRNA2/),输入分析对象(Salmonellaenterica subsp.enterica serovar Typhimurium str.LT2),输入GcvB R1区共识序列 (TTGGCTTACGGTTGTGATGTTGTGTTGTTGTGTTTGCAATTGGT-CTGCG),mRNA匹配区域为-70~+30 nt,sRNA窗口大小数值为13,最小杂交种子数为7,P值最大阈值为0.05,过滤尺寸值为400,点击搜索并导出结果。
2 结果
2.1trpE基因lac融合菌株的构建及PCR鉴定利用Red同源重组系统将lac与STM LT2 wild株候选基因trpE融合,结果显示,STM LT2 trpE::lac菌株经特异性引物PCR扩增后,出现与预期相符大小为757 bp的条带(图1),经深圳华大生物科技有限公司的扩增产物测序结果也与预期相符,接种麦康凯固体培养基能分解半乳糖苷呈现红色菌落(图2),该菌株被命名为PY1,本试验成功构建STM LT2trpE基因lac融合菌株。
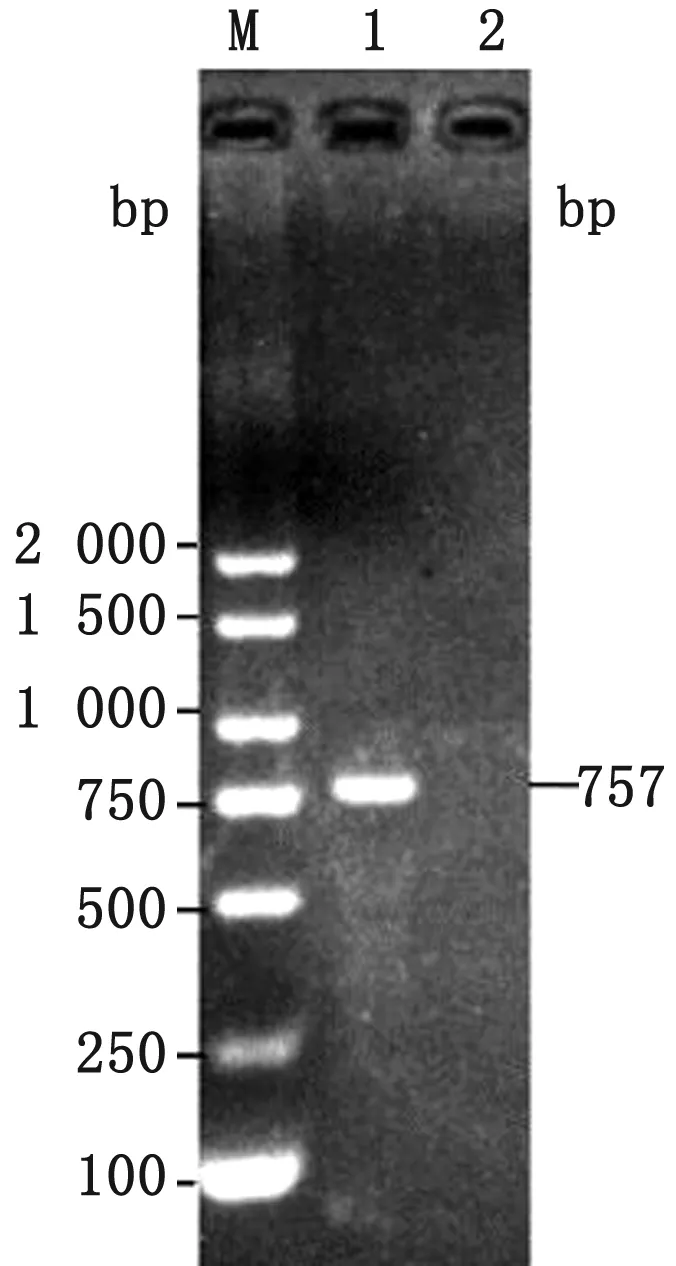
图1 STM LT2 trpE基因lac融合的PCR检测结果 M.DL2000 DNA Marker;1.STM LT2 trpE::lac样本;2.空白对照
2.2gcvB和Hfq基因单缺失及双缺失株的构建及PCR鉴定利用噬菌体转导技术敲除PY1菌株的gcvB和Hfq基因,结果显示,PY1△gcvB、PY1△Hfq和PY1△Hfq△gcvB菌株经特异性引物PCR扩增后,分别出现与预期相符的696和826 bp条带(图3),经深圳华大生物科技有限公司的扩增产物测序结果也与预期相符,PY1△gcvB、PY1△Hfq和PY1△Hfq△gcvB分别被命名为PY11、PY12和PY13。本试验成功构建PY1菌株基因gcvB和Hfq的单缺失及双缺失。
图2 STM LT2 trpE基因lac融合菌株麦康凯固体培养基培养结果 A.空白对照;B.STM LT2 trpE::lac样本
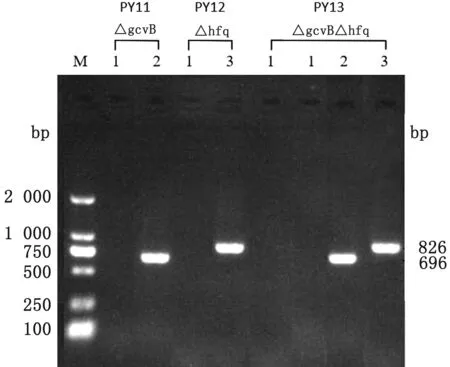
图3 PY1菌株gcvB和Hfq基因的单缺失及双缺失PCR检测结果 M.DL2000 DNA Marder;1.空白对照;2.gcvB缺失样品;3.Hfq缺失样品
2.3 β半乳糖苷酶试验检测trpE基因的表达通过测定PY1、PY11、PY12和PY13菌株的半乳糖苷酶活性。结果显示,PY11和PY12相比PY1分别增加了1.2和1.1倍,而PY13增加仅0.5倍(图4),而这与转录组分析结果中STM LT2gcvB或Hfq基因的缺失导致trpE基因转录水平分别上调2.2和2.4倍的趋势一致。结果表明,GcvB和Hfq调节trpE基因的蛋白表达。
2.4 GcvB R1区与trpEmRNA的相互作用位点TargetRNA2系统预测STM LT2 GcvB R1区与trpEmRNA的相互作用位点,结果显示trpEmRNA +2 nt至+9 nt富含CA的区域能与GcvB富含GU的R1区72~97 nt的区域形成8个连续或18个不连续的碱基互补(图5)。结果表明,trpE基因极有可能受GcvB的直接调控 。
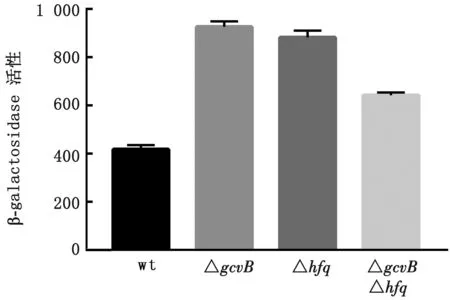
图4 Hfq和gcvB基因缺失对trpE-lac融合蛋白表达影响
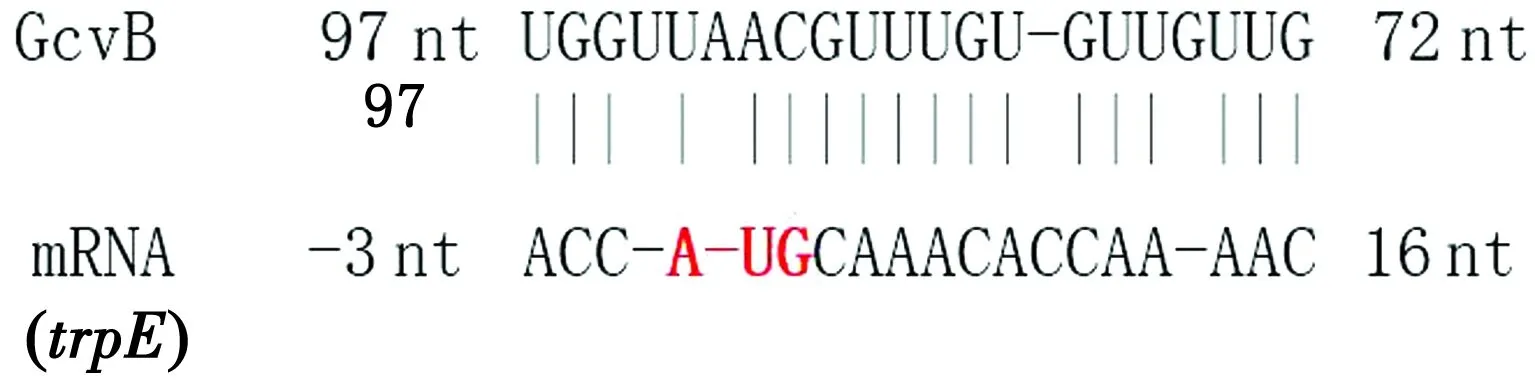
图5 GcvB R1区与trpE mRNA相互作用预测结果
3 讨 论
此前,SITTKA等[13]利用高通量焦磷酸测序(HTPS)技术对Hfq基因缺失的STM LT2进行转录组分析,结果显示,Hfq控制着所有STM LT2基因近1/5表达。本研究室前期对STM LT2基因gcvB和Hfq基因敲除的转录组分析结果显示,GcvB和Hfq共同调控着所有STM LT2基因近1/10的表达,足以证明sRNA GcvB对STM LT2的重要,通过将该1/10的基因与SHARMA等[5-6]和URBANOWSKI等[14]所鉴定的GcvB靶标进行比较,结果表明,本项研究结果并未包含所有已被鉴定的靶基因,提示GcvB在基因转录后调控作用机制中或许有不影响mRNA的稳定性但影响mRNA正常翻译的情况出现,GcvB的这种作用机制尚未见报道,值得探究。GULLIVER等[15]最新研究表明,对多杀性巴氏杆菌的Hfq和gcvB基因缺失株进行转录组和蛋白质分析时发现,转录水平未发生改变的基因却在蛋白水平发生了改变,而蛋白组分析产生差异表达的基因数量大于转录组。
随着生物信息学分析工具越来越成熟,利用得当便事半功倍, TargetRNA2是一台网络服务器,可识别细菌中sRNA调控的mRNA靶标,该系统被KERY等[16]开发并通过测试评估,评估结果显示,其命中已知GcvB靶标的能力优于其他所有系统。在该系统预测GcvB R1区对trpE mRNA的作用中发现,trpE基因是评分最高的基因,该基因此前由SHARMA[5]等通过比较脉冲表达的方法鉴定到其受GcvB R1区的影响,但由于构建的报告基因荧光低,无法通过gfp融合得到证实。另一个有趣的现象是预测R1区与trpEmRNA能够形成8个连续或18个相邻碱基互补,而这18个碱基跨越了trpEmRNA的5′UTR及CDS区,这与此前已发表文章报道过的GcvB作用于靶mRNA 5′UTR核糖体结合位点或邻近核糖体结合位点上游的区域不同,该配对区域覆盖了trpEmRNA 起始密码子AUG,这种作用机制目前尚未见相关研究报道,若该机制被证实,将进一步刷新sRNA的调控方式。
lac融合被广泛用于验证基因蛋白表达水平的变化[17-18],由ELLERMEIRE等[10]开发的一种结合λRed和FLP同源重组系统将携带lac序列但无起始密码子(ATG)的质粒pCE40巧妙的与目的基因FRT疤痕融合,与目的基因共用5′UTR功能区以及起始密码子 (ATG)。成功构建的lac融合便能进行β半乳糖苷酶试验,测定其表达的β半乳糖苷酶的活性,从而间接定量该基因蛋白表达的水平。该研究前期猜测GcvB和Hfq对trpE基因的蛋白表达产生抑制作用,如β半乳糖苷酶试验结果所示,GcvB和Hfq单缺失时trpE基因的表达得到了提升,若与预期相符,当GcvB和Hfq同时缺失时trpE基因的表达水平应高于任一单缺失,但结果表明,GcvB和Hfq的双缺失没有带来更高的提升,相反,trpE基因的表达水平与对照组相近,仅提升0.5倍。产生该现象的原因推测为当trpE基因的转录或蛋白表达无法受到来自GcvB或Hfq的抑制时,第3种调控trpE基因转录或翻译的机制将被激活,而这种机制可能受GcvB或Hfq的负调控,该机制值得进一步探究。

