绵羊肺炎支原体及其脂质相关膜蛋白诱导绵羊肺泡巨噬细胞IL-1β表达的分子机制
白 帆,吴金迪,王晓晖,吕天星,王艳芳,郝永清*
(1.内蒙古农业大学 兽医学院,微生物与免疫学实验室,内蒙古 呼和浩特 010018;2.内蒙古农牧业科学院 兽医所,内蒙古 呼和浩特 010031;3.内蒙古农业大学 兽医学院农业部兽医药理学实验室/动物疫病临床诊疗技术重点实验室,内蒙古 呼和浩特 010018)
绵羊肺炎支原体(Mycoplasmaovipneumoniae,Mo)已被证实可引起绵羊、山羊和野生小反刍动物慢性非进行性肺炎[1-4]。是一种世界性流行病,几十年来给养羊业造成巨大的经济损失[2,4-5]。虽然已有人对Mo感染机制进行广泛研究,但感染后巨噬细胞反应分子基础仍不清楚。
脂质相关膜蛋白(lipid-associated membrane proteins,LAMPs)是一类表达于支原体表面的脂蛋白混合物,是与宿主细胞相互作用的主要结构[6]。已有多种支原体的LAMPs被证明具有生物活性,且是支原体感染时最有效的炎症反应启动剂[7-10]。LAMPs通过与宿主细胞的直接作用,影响巨噬细胞、单核细胞和脑星形胶质细胞功能,从而引起促炎细胞因子产生。在某些情况下,还可引起细胞的坏死或凋亡,逃避宿主免疫应答,促进感染[11]。因此,更好地了解宿主细胞与支原体LAMPs间的分子机制,将为支原体感染分子发病机制提供重要思路[6,10,12-13]。
已有研究成果表明,Toll样受体(Toll-like receptor,TLRs)在宿主对入侵微生物的早期先天识别和炎症反应中起重要作用[14-15]。TLRs是一类高度保守的I型跨膜受体家族,可识别特定的病原相关分子模式,包括LAMPs、脂多糖、脂磷壁酸和其他细菌壁成分,其对支原体LAMPs的识别已被广泛报道。具体来说,TLR1、TLR2和TLR6参与识别多种支原体菌株产生LAMPs[10,12-13,16-17]。TLR2与TLR1或TLR6组成异源二聚体,从而增强脂蛋白的识别,进而上调细胞因子应答[18]。
为证明TLR2是否参与Mo或LAMPs刺激肺泡巨噬细胞时细胞因子的表达,本试验利用Mo或LAMPs刺激绵羊肺泡巨噬细胞,检测细胞因子产生及其激活途径。为深入了解Mo感染机制提供重要基础,并为治疗和预防牲畜感染Mo提供理论依据。
1 材料与方法
1.1 试验材料Mo野生菌株NM2010由本实验室从内蒙古自治区分离鉴定,并保存;Mo LAMPs参考TAKASHI等[12]制备;原代绵羊肺泡巨噬细胞由本实验室分离制备。
1.2 试验试剂兔抗磷酸化p38、兔抗非磷酸化p38、兔抗磷酸化JNK、兔抗非磷酸化JNK、兔抗磷酸化Erk、兔抗非磷酸化Erk单克隆抗体均购自Cell Signaling Technology公司;兔抗GAPDH多克隆抗体购自GeneTex公司;羊抗兔HRP偶联IgG二抗购自天津三箭生物技术有限公司;p38 MAPK抑制剂(S1863)、JNK抑制剂(S1876)、Erk抑制剂(S1805)为碧云天公司产品;PE偶联TLR2流式抗体为eBioscience公司产品;非偶联抗TLR2功能抑制性抗体为Biolegend公司产品;D-PBS、白细胞介素1β和ELISA检测试剂盒为Thermo Fisher公司产品。
1.3 引物的设计与合成参考 GenBank中IL-1β、Tlr2和Gapdh 的基因序列,利用Primer Premier 5.0设计引物(表1)。

表1 引物序列
1.4 绵羊肺泡巨噬细胞的分离培养无菌采集绵羊完整肺脏,向肺脏内注入预冷的无菌PBS溶液 400 mL,轻轻拍打后收集冲洗液,经200目细胞筛过滤后,4℃ 1 000×g离心5 min,小心弃去上层液体,用加有青霉素(100 IU/mL)和链霉素(100 mg/L)的无菌PBS重悬沉淀,再次4℃ 1 000×g离心5 min,小心弃去上层液体,重复洗涤1次。用加有20%胎牛血清的RPMI-1640细胞营养液重新悬浮细胞并进行细胞计数,将细胞浓度调整为4×106个/mL 后接种到六孔细胞培养板中,每孔加入1 mL 细胞原液。细胞培养板置于37℃、5% CO2的培养箱中静置2 h。弃去上层液体,用RPMI-1640细胞营养液冲洗2次,除去未黏附细胞后,重新加入适量混有20%胎牛血清的RPMI-1640细胞营养液,置于37℃、5% CO2的培养箱培养备用。
1.5 Mo及其LAMPs刺激绵羊肺泡巨噬细胞后TLR2受体基因及细胞因子基因表达情况检测将前述细胞培养物置于37℃ CO2培养箱培养8 h后,Mo按MOI 5∶1、10∶1、15∶1和20∶1,LAMPs按1,2,3,4和5 mg/L分别加入六孔细胞培养板中混匀,置于37℃ CO2培养箱继续培养2,4,8,12和24 h后分别提取细胞总RNA,反转录为cDNA后,使用荧光定量PCR检测受体基因表达情况。
1.6 巨噬细胞表面TLR2受体蛋白表达检测Mo按MOI 10∶1,LAMPs按3 mg/L分别加入培养有巨噬细胞的六孔细胞培养板中,置于37℃ CO2培养箱继续培养16 h后,利用PE偶联TLR2流式抗体对细胞表面的TLR2蛋白进行标记,并使用BD FACSAria Ⅱ型流式细胞仪对上述细胞样本进行检测。Flowjo V10软件对所有流式检测数据进行数据处理。
1.7 Mo及其LAMPs刺激绵羊肺泡巨噬细胞后丝裂原活化蛋白激酶(MAPK)信号转导通路激活检测分别按Mo MOI 10∶1,LAMPs 3 mg/L加入培养有巨噬细胞的六孔细胞培养板中,置于CO2培养箱37℃继续培养15,30,60和120 min后提取细胞总蛋白。利用Western blot检测信号通路激活情况。
1.8 Mo及其LAMPs刺激绵羊肺泡巨噬细胞后细胞因子表达量检测Mo按MOI 5∶1、10∶1、15∶1和20∶1,LAMPs按1,2,3,4和5 mg/L加到培养有巨噬细胞的六孔细胞培养板中,置于CO2培养箱37℃培养9 h后,收集六孔板中液体,利用IL-1β ELISA试剂盒根据说明书提示检测IL-1β含量。
1.9 TLR2对Mo及其LAMPs刺激绵羊肺泡巨噬细胞后MAPK信号转导通路激活影响检测向培养有巨噬细胞的六孔细胞培养板中加入终质量浓度为10 mg/L的TLR2抗体,37℃温箱作用30 min后,Mo以MOI 10∶1,LAMPs以3 mg/L分别加到六孔细胞培养板中,置于培养箱继续培养15,30,60和120 min后提取细胞总蛋白。利用Western blot检测信号通路激活情况。
1.10 TLR2对LAMPs刺激绵羊肺泡巨噬细胞后细胞因子基因表达影响检测向培养有巨噬细胞的六孔细胞培养板中加入终质量浓度分别为1,5,10和20 mg/L 的TLR2抗体,37℃温箱作用30 min后,分别按Mo MOI 10∶1,LAMPs 3 mg/L加到六孔细胞培养板中,置于37℃ CO2培养箱继续培养8 h 后提取细胞总RNA,反转录为cDNA后,使用荧光定量PCR检测细胞因子基因表达情况。
1.11 MAPK信号转导通路对LAMPs刺激绵羊肺泡巨噬细胞后细胞因子基因表达影响检测向培养有巨噬细胞的六孔细胞培养板中加入终浓度分别为1,5,10和20 μmol/L的MAPK抑制剂,37℃温箱作用30 min后,加3 mg/L LAMPs到六孔细胞培养板中,置于37℃ CO2培养箱继续培养8 h后提取细胞总RNA,反转录为cDNA后,使用荧光定量PCR检测细胞因子基因表达情况。
1.12 MAPK信号转导通路和TLR2对LAMPs刺激绵羊肺泡巨噬细胞后细胞因子蛋白表达影响检测向培养有巨噬细胞的六孔细胞培养板中加入终浓度为10 μmol/L的MAPK抑制剂或10 mg/L的TLR2抗体,37℃温箱作用30 min后,LAMPs分别以3和5 mg/L加到六孔细胞培养板中继续刺激培养16 h后,收集六孔板中液体,利用IL-1β ELISA试剂盒检测IL-1β含量。
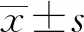
2 结果
2.1 Mo及其LAMPs刺激绵羊肺泡巨噬细胞后TLR2受体基因表达情况为验证Mo及其LAMPs对绵羊肺泡巨噬细胞TLR2受体基因表达量的影响,以不同比例Mo刺激巨噬细胞不同时间后,与对照组相比,Tlr2基因受到刺激2 h后,基因表达量均上升并且差异显著,在8 h时达到最大值,随后下降。同时,不同比例的Mo均能刺激巨噬细胞使其受体基因表达量出现极显著增加,表达量与支原体添加比例呈正相关(图1)。
以不同浓度LAMPs刺激巨噬细胞不同时间后,与对照组相比,Tlr2基因在细胞受到刺激后,4 h时基因表达量出现极显著差异,在8 h时便达到最大值,随后逐渐下降。不同浓度的LAMPs均能刺激巨噬细胞使其受体基因表达量出现极显著增加,且表达量随着LAMPs浓度的上升而增加(图2)。
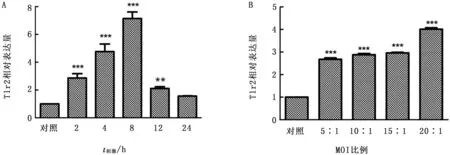
图1 不同时间(A)和不同比例(B)Mo刺激绵羊肺泡巨噬细胞后Tlr2基因表达
图2 不同时间(A)和不同质量浓度(B)LAMPs刺激绵羊肺泡巨噬细胞后Tlr2基因表达
2.2 巨噬细胞表面TLR2受体蛋白表达利用流式细胞术检测细胞表面TLR2受体蛋白表达情况,结果显示,受到不同刺激后,TLR2蛋白表达量出现明显上升(图3)。
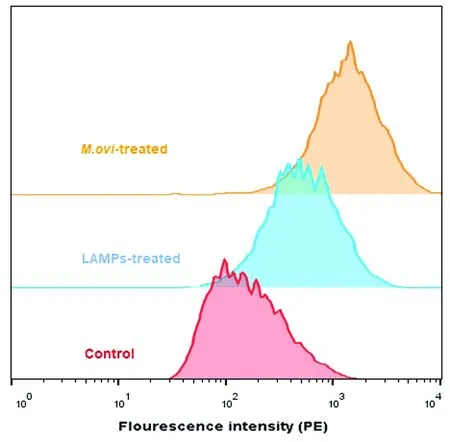
图3 Mo或LAMPs刺激巨噬细胞后细胞表面TLR2蛋白表达
2.3 Mo及其LAMPs刺激绵羊肺泡巨噬细胞后MAPK信号转导通路激活当Mo以MOI 10∶1比例刺激绵羊肺泡巨噬细胞后,巨噬细胞中JNK、Erk和p38蛋白在15 min时便出现明显磷酸化,在30 min 时程度最高,随后逐渐下降。
当LAMPs以3 mg/L刺激绵羊肺泡巨噬细胞后,巨噬细胞中Erk和p38蛋白在15 min时出现明显磷酸化,30 min程度最高,随后逐渐下降。而JNK蛋白在15 min时便达到磷酸化最高水平,随后下降(图4)。
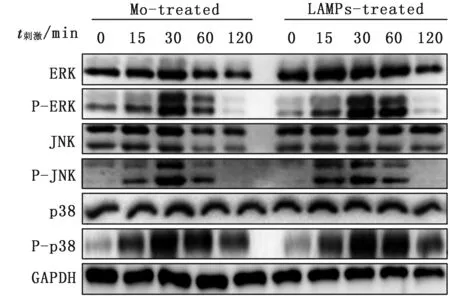
图4 Mo和LAMPs刺激巨噬细胞后JNK、Erk及p38蛋白磷酸化情况
2.4 Mo及其LAMPs刺激绵羊肺泡巨噬细胞后细胞因子基因表达情况以Mo刺激巨噬细胞不同时间后,与对照组相比,IL-1β基因在细胞受到刺激4 h 后,基因表达量出现上升并且差异显著,随后逐渐增加并在24 h时达到最大值。同时,不同比例Mo均能刺激巨噬细胞使其细胞因子基因表达量显著增加,并且表达量与支原体添加比例呈正相关(图5)。
在LAMPs刺激巨噬细胞不同时间后,与对照组相比,IL-1β基因在细胞受到刺激后,不同时间基因表达量均出现上升并在24 h时达到最高值。同时,不同浓度的LAMPs均能刺激巨噬细胞使其细胞因子基因表达量极显著增加,并且表达量随着LAMPs浓度的上升而增加(图6)。
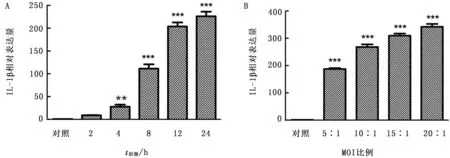
图5 不同刺激时间(A)不同比例(B)Mo刺激绵羊肺泡巨噬细胞后IL-1β基因表达
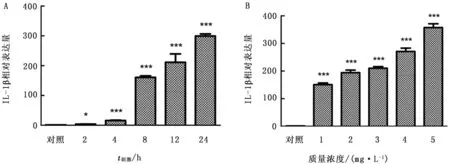
图6 不同刺激时间(A)不同质量浓度(B)LAMPs刺激绵羊肺泡巨噬细胞后IL-1β基因表达
2.5 Mo及其LAMPs刺激绵羊肺泡巨噬细胞后细胞因子表达量与对照组相比,使用Mo或LAMPs刺激巨噬细胞后,细胞因子IL-1β的表达水平均显著上升,并且表达量与Mo或LAMPs添加比例正相关,且差异极显著(图7,8)。
2.6 TLR2对Mo及其LAMPs刺激绵羊肺泡巨噬细胞后MAPK信号转导通路激活影响无论是Mo还是LAMPs都无法使巨噬细胞中JNK、Erk、p38蛋白发生明显的磷酸化反应,据此判断,TLR2在Mo和LAMPs激活巨噬细胞MAPK信号转导通路过程中发挥着作用(图9)。
2.7 TLR2对LAMPs刺激绵羊肺泡巨噬细胞后细胞因子基因表达影响以不同浓度TLR2功能抑制性抗体对TLR2抑制后,与LAMPs刺激组相比,随着TLR2抗体浓度的升高,TLR2的功能受到充分抑制,细胞因子IL-1β基因表达量逐渐下降。据此判断,TLR2在LAMPs诱导巨噬细胞促炎性细胞因子IL-1β释放中发挥着作用(图10)。
2.8 MAPK信号转导通路激活对细胞因子基因表达影响与LAMPs刺激组相比,随着抑制剂浓度的升高,MAPK信号转导通路的功能受到充分抑制,细胞因子IL-1β基因表达量逐渐下降。据此判断,MAPK信号通路在LAMPs诱导巨噬细胞促炎性细胞因子IL-1β释放中均发挥着作用(图11)。

图7 使用Mo刺激绵羊肺泡巨噬细胞后细胞因子释放
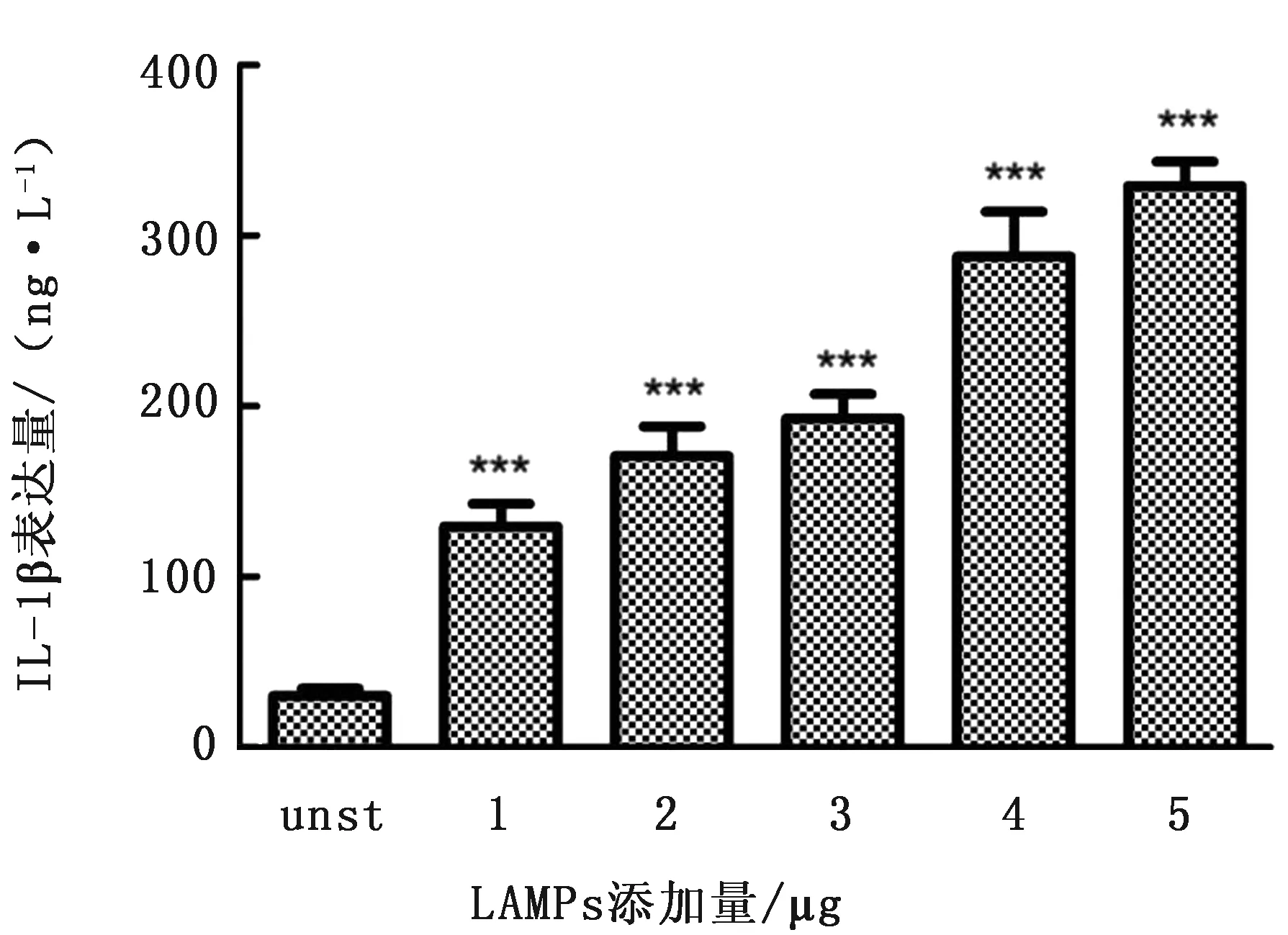
图8 使用LAMPs刺激绵羊肺泡巨噬细胞后细胞因子释放

图9 Mo和LAMPs刺激巨噬细胞后JNK、Erk及p38蛋白磷酸化
2.9 TLR2及MAPK信号转导通路对LAMPs刺激绵羊肺泡巨噬细胞后细胞因子蛋白表达影响与对照组相比,使用LAMPs刺激巨噬细胞后,细胞因子IL-1β的表达水平上升,并且表达量与刺激物添加比例呈正相关。同时,与LAMPs刺激组相比,添加抑制剂的组均出现明显下降,且差异极显著(图12)。
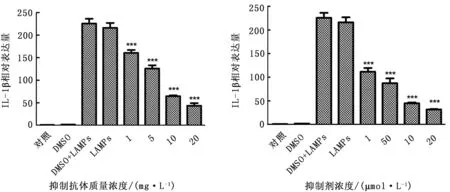
图10 巨噬细胞TLR2活性被抑制后IL-1β基因的表达 图11 巨噬细胞JNK、Erk及p38蛋白活性被抑制后IL-1β的表达
3 讨论
Mo是一种病原微生物,是导致原发性非典型肺炎发生的主要因素[19-20],近期,Mo流行给全球养羊行业造成了巨大经济损失[21]。肺脏中的肺泡巨噬细胞作为机体抵抗病原微生物侵袭机体的第一道防线,接触致病因子后,肺泡巨噬细胞通过吞噬或胞饮等方式形成封闭小体,与细胞内中的溶酶体融合,从而达到消除病原微生物的目的。同时,肺泡巨噬细胞还参与特异性免疫[22-23],对侵入机体的外源性抗原物质进行加工递呈,分泌白细胞介素、干扰素、肿瘤坏死因子等多种活性因子对炎性反应进行调节、启动。同时,它也是研究病原微生物侵染肺脏的重要细胞模型。
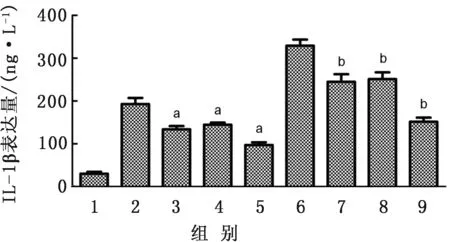
图12 巨噬细胞JNK、Erk、p38及TLR2蛋白活性被抑制后IL-1β表达 1.unst;2.LAPMs(3 μg);3.LAMPs(3 μg)+anti-Tlr2(10 μg/L);4.LAMPs(3 μg)+anti-MAPK(10 μmol/L);5.LAMPs(3 μg)+anti-TLR2(10 μg/L)+anti-MAPK(10 μmol/L);6.LAMPs(5 μg);7.LAMPs(5 μg)+anti-TLR3(10 μmol/L);8.LAMPs(5 μg)+anti-MAPK(10 μmol/L);9.LAMPs(5 μg)+anti-TLR3(10 μmol/L)+anti-MAPK(10 μmol/L)。注:a为与LAMPs(3 μg)预处理组进行比较;b为与LAMPs(5 μg)预处理组进行比较
TLR2可以识别来自多种病原体(包括支原体、细菌、真菌、寄生虫和病毒)的各类病原相关分子模式,被认为是宿主识别入侵微生物的主要分子[24]。当TLR2接触到侵入机体的病原微生物时,便会触发pro-IL-1β的合成。另有研究表明,多种支原体的LAMPs通过TLR1、2、6,激活NF-κB,从而诱导单核细胞和巨噬细胞促炎细胞因子的表达[13,25]。
本试验以不同浓度Mo及LAMPs 刺激绵羊肺泡巨噬细胞后,利用荧光定量PCR对TLR2基因以及细胞因子IL-1β的基因表达水平进行检测,结果显示,Mo及LAMPs在不同浓度时TLR2和IL-1β的表达水平均显著增高,因此确定LAMPs的最佳刺激质量浓度为3 mg/L;Mo的最佳刺激浓度为MOI 10∶1。Mo及LAMPs的最佳刺激时间为 8 h。为了印证这一结果,利用流式细胞术和ELISA分别对TLR2受体及细胞因子IL-1β蛋白表达水平进行检测,结果显示均可产生显著影响。并且,Western blot结果显示MAPK信号通路也均被激活。而当使用TLR2功能抑制性抗体时,不论是使用Mo还是LAMPs对靶细胞进行刺激,由于TLR2受体的功能被抑制,信号通路的激活以及细胞因子的产生均受到较大影响,这说明绵羊肺泡巨噬细胞在受到Mo或LAMPs刺激后,信号通路的激活和细胞因子的分泌过程中,TLR2都参与其中并发挥着关键作用。同时,荧光定量PCR以及ELISA结果显示,在使用MAPK信号转导通路抑制剂时,由于信号通路的激活被抑制,靶细胞在受到不同刺激时,细胞因子的表达及释放也均受到明显影响。
本研究证明Mo及其LAMPs可通过绵羊肺泡巨噬细胞的TLR2受体激活MAPK信号通路途径继而引起巨噬细胞细胞因子IL-1β的分泌增多,为了解Mo的感染机制提供坚实的基础。

