MnSOD、SIRT3在肺腺癌组织及癌旁组织中的表达及其与临床病理、预后的关系分析
戚永超,缪 劲,张爱平,郑 琳
(南京医科大学附属南京医院/南京市第一医院心胸血管外科,江苏南京 210000)
肺腺癌是起源于肺支气管黏膜上皮的原发性恶性肿瘤疾病,多数为非小细胞肺癌(NSCLC),以胸闷、气短、咳嗽、咯血、呼吸急促为临床症状,居癌症原因死亡首位[1]。锰超氧化物歧化酶(MnSOD)则是存在于线粒体基质的抗氧化酶,可清除机体细胞代谢产生的活性氧(ROS),保护线粒体免受超氧阴离子损伤,对维持正常细胞功能、细胞存活至关重要[2]。FU等[3]的动物实验也证实,MnSOD过表达可触发叉头框转录因子M1(FoxM1)上调,诱导和维持人肺癌细胞自我更新,促进NSCLC进展。去乙酰化酶3(SIRT3)作为NDA依赖的去乙酰化酶,也是重要的线粒体蛋白,可依据不同细胞、肿瘤类型发挥抑癌或致癌基因作用[4]。XIONG等[5]报道,SIRT3通过转录后修饰调控Akt的活化,增加NSCLC恶性程度,但对鳞状细胞癌的致癌倾向更明显。基于此,本研究采集资料着重分析MnSOD、SIRT3在肺腺癌患者肺腺癌组织及癌旁组织中的表达及其与临床病理、预后的关系,旨在为肺腺癌的临床诊治提供参考依据,具体报道如下。
1 资料与方法
1.1一般资料 选取本院心胸血管外科2016年1月至2018年12月收治的60例留存有肺腺癌及癌旁组织标本的肺腺癌患者作为研究对象。所纳入患者均经手术病理活检确诊为肺腺癌,有明确病理诊断结果,在肺腺癌组织及癌旁组织标本采集前均无任意放化疗或靶向治疗史,无肺腺癌以外的其他内外科疾病,如心脑血管疾病,肝、肾功能异常及慢性阻塞性肺疾病等非肿瘤性疾病。
1.2仪器与试剂 MnSOD免疫组织化学SP试剂盒、MnSOD一抗、二抗均购自北京博奥森生物技术有限公司,SIRT3一抗、二抗均购自Santa Cruz公司,SIRT3免疫组织化学SP试剂盒及DAB显色试剂盒均购自上海基尔顿生物公司。
1.3方法 以查阅电子病历方式统计患者性别、年龄、组织学分级、淋巴结转移、远处转移、TNM分期、肺腺癌亚型等临床病理资料,采用免疫组织化学(SP法)检测MnSOD、SIRT3在肺腺癌组织及癌旁组织中的表达情况,比较不同临床病理特征患者肺腺癌组织MnSOD、SIRT3表达差异。
1.3.1免疫组织化学染色 石蜡切片脱蜡、脱水处理,采用3%H2O2溶液去除内源性过氧化物酶活性,采用pH值为6.0的枸橼酸盐缓冲液抗原修复,依次滴加SIRT3抗体一抗、二抗,DAB显色,400倍显微镜下观察染色程度,若染色满意则立即用PBS冲洗终止染色,苏木精复染细胞核,逆梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察摄片。MnSOD、SIRT3免疫组织化学染色均严格按照试剂盒说明书操作,以已知阳性组织切片为阳性对照,阴性对照以磷酸盐缓冲液(PBS)代替一抗。
1.3.2读片 每张切片随机选取5个视野(×400),显微镜下观察显色反应,由1名病理科医生、2名读片者采用免疫组织化学评分系统(IRS)双盲读片,显微镜下可见细胞质内有棕黄色颗粒则为MnSOD表达阳性,对染色结果进行评分(染色深度面积×染色面积比例);其中染色深度按完全阴性、弱阳性、中度阳性、强阳性对应0~3分,着色细胞比例按染色细胞比例为全视野的0%~25%、>25%~50%、>50%~75%、>75%~100%对应1~4分,IRS总分12分,8~12分为阳性,否则为阴性。
1.4统计学处理 应用SPSS20.0软件进行统计学分析,计数资料用例数或百分比表示,行χ2检验或连续校正χ2检验,采用Cox回归模型分析影响患者预后的危险因素,绘制Kaplan-Meier生存曲线分析MnSOD、SIRT3对肺腺癌患者生存时间的影响,生存率的比较采用Log-Rank检验,P<0.05为差异有统计学意义。
2 结 果
2.1MnSOD、SIRT3在肺腺癌组织及癌旁组织中的表达 MnSOD、SIRT3均定位于肺腺癌细胞质,呈棕黄色颗粒表达,且在肺腺癌组织中MnSOD阳性表达率、SIRT3阳性表达率均明显低于癌旁组织,差异有统计学意义(P<0.05),见表1。
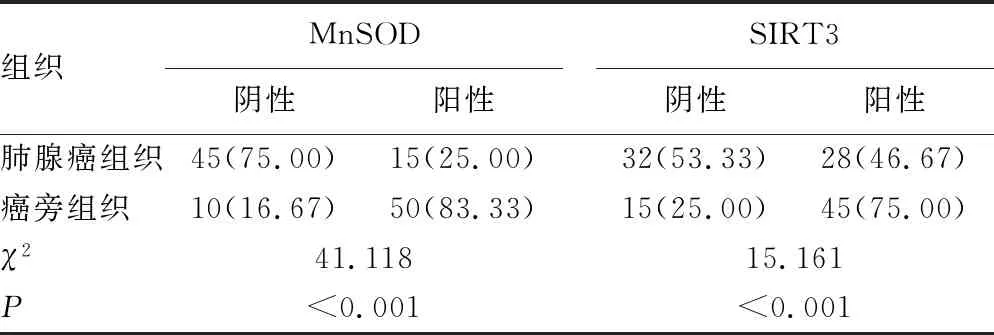
表1 MnSOD、SIRT3在肺腺癌组织及癌旁组织中的表达[n=60,n(%)]
2.2MnSOD、SIRT3与肺腺癌临床病理的关系 不同性别、年龄、肺腺癌亚型,以及有、无吸烟史的肺腺癌患者肺腺癌组织MnSOD、SIRT3表达差异无统计学意义(P>0.05),但随着组织学分级增加肺腺癌组织MnSOD阳性表达率、SIRT3阳性表达率,呈明显下降趋势,TNM分期为Ⅲ期患者的肺腺癌组织MnSOD阳性表达率、SIRT3阳性表达率明显低于Ⅰ+Ⅱ期患者,差异有统计学意义(P<0.05),见表2。
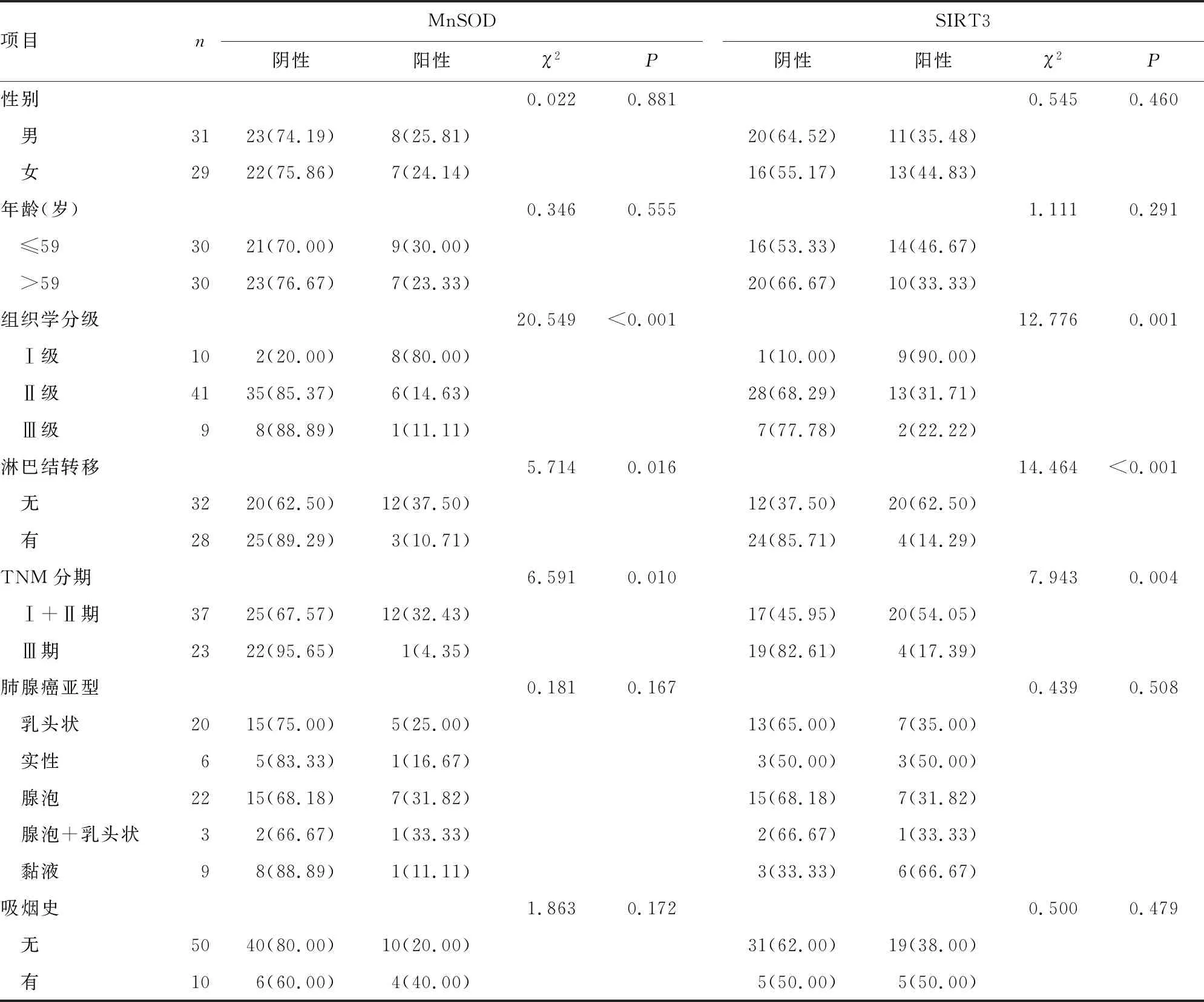
表2 MnSOD、SIRT3与肺腺癌临床病理的关系[n(%)]
2.3MnSOD、SIRT3与预后的关系 60例患者随访时长为18~38个月,平均(26.37±4.12)个月。将患者临床病理特征、肺腺癌组织MnSOD及SIRT3表达、治疗方案均纳入Cox回归模型协变量范围,结果显示,MnSOD阴性、SIRT3阴性与组织学分级Ⅲ级、淋巴结转移、TNM分期Ⅲ期均是影响肺腺癌患者生存的独立危险因素,见表3。
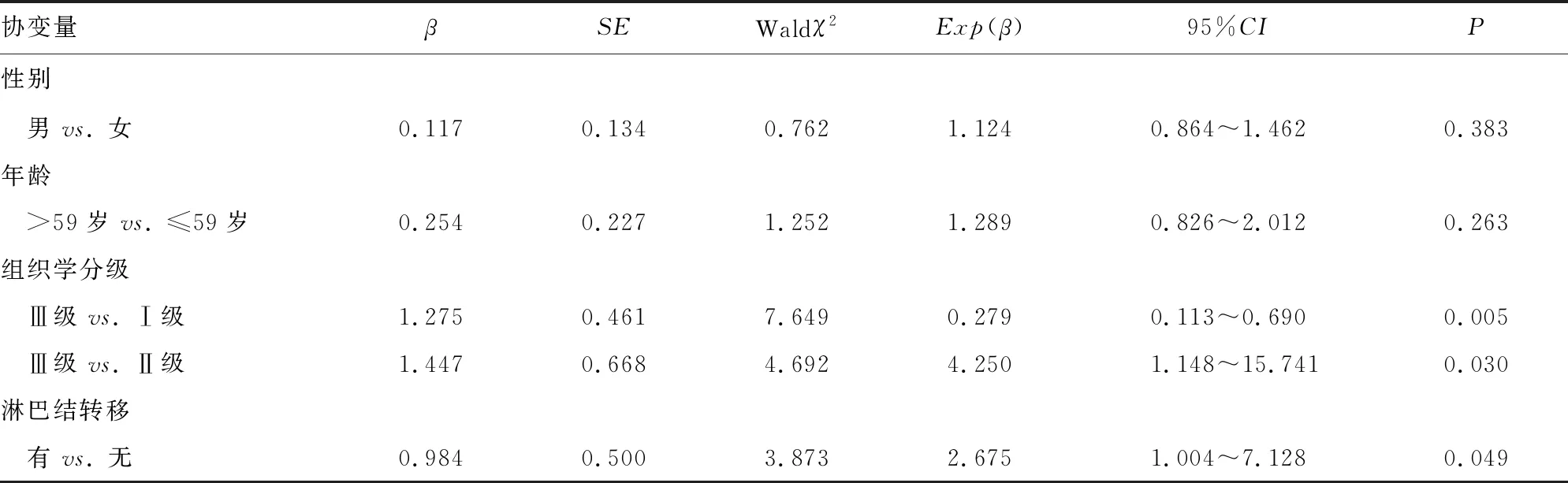
表3 MnSOD、SIRT3与预后的关系
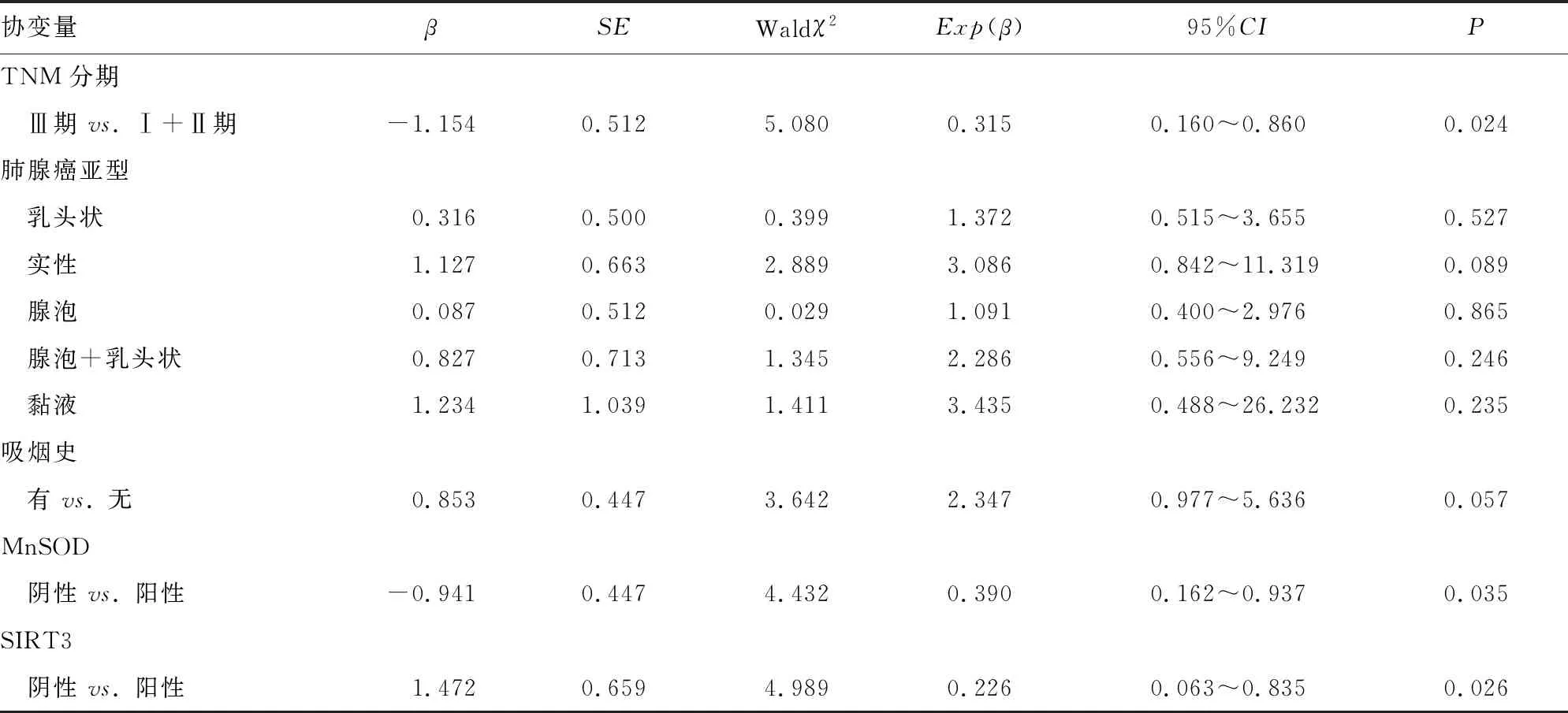
续表3 MnSOD、SIRT3与预后的关系
2.4不同MnSOD、SIRT3表达的Kaplan-Meier生存分析 MnSOD、SIRT3阴性表达患者累积生存率明显低于MnSOD、SIRT3阳性患者,差异有统计学意义(χ2=6.601、8.895,P=0.010、0.003),见图1。

注:A为MnSOD;B为SIRT3。
3 讨 论
ROS是产生于细胞线粒体的氧化呼吸链,适量的ROS可对细胞增殖、分化、凋亡等发挥正向调控机制,ROS过表达则可能引起细胞内DNA、蛋白质及脂质损伤,诱导肿瘤发生、发展[6]。MnSOD则是线粒体内重要的超氧阴离子自由基清除剂,也是线粒体内主要的抗氧化酶,可维持细胞氧化还原平衡,使其免受ROS损害[7-8]。在机体内,MnSOD的表达直接影响细胞内ROS的清除情况,但基于当前临床研究,MnSOD在肿瘤疾病中或可发挥双向作用,如在鼻咽癌中MnSOD便呈明显高表达[9],而在前列腺癌组织中MnSOD则呈明显低表达[10]。由此可见,MnSOD表达或可因肿瘤部位、不同病理类型的瘤细胞或组织中ROS的不同而呈不同表达趋势。因此,研究不同肿瘤疾病中MnSOD表达十分必要。本研究结果显示,肺腺癌患者肺腺癌组织MnSOD阳性表达率明显低于癌旁组织。这与MARTIN等[11]的报道结论相符。随着组织学分期增加,肺腺癌组织MnSOD阳性表达率呈明显下降趋势,TNM分期为Ⅲ期患者肺腺癌组织MnSOD阳性表达率明显低于Ⅰ+Ⅱ期患者,进一步提示MnSOD在肺腺癌组织中或充当抑癌基因。
SIRT3与MnSOD相似,同样可维持适当的ROS生产以防止细胞凋亡、促进细胞增殖;同时,SIRT3还能通过调节线粒体内稳定,保护线粒体膜完整性,增加细胞对氧化应激的抗性,从而抵抗细胞凋亡,发挥致癌作用[12]。而在头颈部鳞状细胞癌中,SIRT3也可通过对ROS的维持作用防治细胞凋亡、抵抗癌变,发挥抑癌作用[13]。随着研究的深入,SIRT3在肿瘤疾病中所发挥的临床价值逐渐引起重视,但其功能可因细胞类型、肿瘤类型而呈现差异性表达,因此SIRT3与肿瘤间的关系存在争议,分析SIRT3在单一肿瘤疾病中的表达,明确其与肿瘤的关系十分必要。本研究结果显示,肺腺癌组织SIRT3阳性表达率明显低于癌旁组织,这与XIAO等[14]的报道结论相似,且其与临床病理的关系也与MnSOD相似,由此可见,肺腺癌组织中,SIRT3与MnSOD相似,均表现出抑癌作用。
本研究还对MnSOD、SIRT3表达与肺腺癌患者预后进行分析,结果显示,MnSOD阴性、SIRT3阴性与组织学分级Ⅲ级、淋巴结转移、TNM分期Ⅲ期均是影响肺腺癌患者生存的独立危险因素,提示MnSOD、SIRT3表达与肺腺癌患者生存密切相关,进一步绘制生存曲线分析生存率,同样获得相似结论,MnSOD、SIRT3阴性患者的累积生存率明显低于MnSOD、SIRT3阳性患者。分析原因可能是,在肺腺癌组织中SIRT3高表达可通过增加Bax/Bcl-2、Bad/Bcl-XL比值促进AIF易位至细胞核,诱导细胞凋亡[15]。
4 结 论
肺腺癌患者肺腺癌组织MnSOD、SIRT3阳性表达率明显低于癌旁组织,其表达与肺腺癌组织学分级、TNM分期、预后等关系密切,或可用于肺腺癌患者病情、预后评估。本课题组拟在下阶段深入探究MnSOD、SIRT3在肺腺癌发生、发展中的机制。

