新型冠状病毒肺炎与其他呼吸道病原体感染疾病的实验室数据比较*
罗 佳,应斌武,曹 玲,朱 玛,李青峰△
(1.成都市公共卫生临床医疗中心,四川成都 610066,2.四川大学华西医院实验医学科,四川成都 610041)
由新型冠状病毒(SARS-CoV-2)感染导致的呼吸系统疾病统称为新型冠状病毒肺炎(COVID-19)[1]。感染者以发热、咳嗽、乏力为主要表现,其次为咳痰、气短、肌肉酸痛或关节痛、咽喉痛、头痛、寒战和腹泻等,也有部分患者没有发热等临床症状,表现为无症状病毒携带者[2]。与COVID-19类似,冬春季节由其他呼吸道病原体引起的急性呼吸道感染也是导致疾病流行和死亡的主要原因,尤其是婴幼儿、人类免疫缺陷病毒(HIV)感染者等免疫力低下人群,常导致无症状感染、季节性流感、肺炎、支气管炎和严重呼吸衰竭,甚至死亡[3-4]。对常见呼吸道感染性疾病病原体的快速鉴定,有助于公共卫生医疗行业制订更行之有效的治疗策略,快速抑制疾病流行。本文对成都市公共卫生临床医疗中心收治的COVID-19及其他呼吸道病原体引起的肺炎患者的各项实验室数据进行比较分析,以期发现COVID-19的实验室数据特点,为进一步了解COVID-19的发生、发展机制奠定基础。
1 资料与方法
1.1一般资料 以成都市公共卫生临床医疗中心2020年1—2月发热门诊收治患者(1 011例)、COVID-19确诊患者(102例)、疑似COVID-19住院患者(58例),以及2017年4月确诊的H7N9人感染禽流感患者(10例)为研究对象。102例COVID-19确诊患者(COVID-19组),男52例,女50例,年龄3个月至84岁;死亡3例(2.94%),危重型15例(14.71%),重型16例(15.7%),普通型43例(42.16%),轻型25例(24.51%);其中1例除感染SARS-CoV-2外,同时分离出人呼吸道合胞病毒。H7N9人感染禽流感确诊患者10例(H7N9组),男7例,女3例;年龄44~73岁;死亡3例,痊愈出院7例。发热门诊检出其他呼吸道病原体335例,检出率33.14%(335/1 011),其中男180例,女155例;年龄4个月至80岁;最终发展为甲型流感性肺炎90例[InfA肺炎组,37.50%(90/240)],乙型流感性肺炎34例[InfB肺炎组,35.79%(34/95)]。疑似COVID-19住院患者58例,检出其他呼吸道病原体8例,检出率为13.79%(8/58)。其他呼吸道病原体分布见表1。

表1 其他呼吸道病原体分布
1.2方法 呼吸道标本为患者鼻咽拭子。SARS-CoV-2、H7N9、InfA、InfB采用RT-PCR方法检测,呼吸道13项病毒采用赛默飞世尔的Sanger测序平台检测。COVID-19患者根据国家卫生健康委员会办公厅/国家中医药管理局办公室发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》[2]确诊。H7N9人感染禽流感患者符合原国家卫生和计划生育委员会人感染H7N9禽流感重症诊疗方案(2017版)诊断标准。流感病毒性肺炎诊断标准参照《流感诊断与治疗专家共识(2015版)》[5]。所有实验室项目均按标准化操作规程进行检测。
1.3统计学分析 应用GraphPad Prism 5.0软件进行数据统计分析,呈非正态分布的计量数据采用中位数(四分位间距)[M(P25,P75)]表示,组间比较采用秩和检验,以P<0.05为差异有统计学意义。
2 结 果
COVID-19组与其他呼吸道病毒引起的肺炎患者(InfA肺炎组、InfB肺炎组、H7N9组)的实验室数据比较结果见表2。COVID-19组患者的血常规、肝功能、肾功能、心肌酶谱、淋巴细胞亚群等实验室指标出现不同程度的变化,其中LY、CRP、AST、ALB、BUN、CREA、LDH、CK、CK-MB、α-HBDH等指标与其他组比较,差异均有统计学意义(P<0.05)。
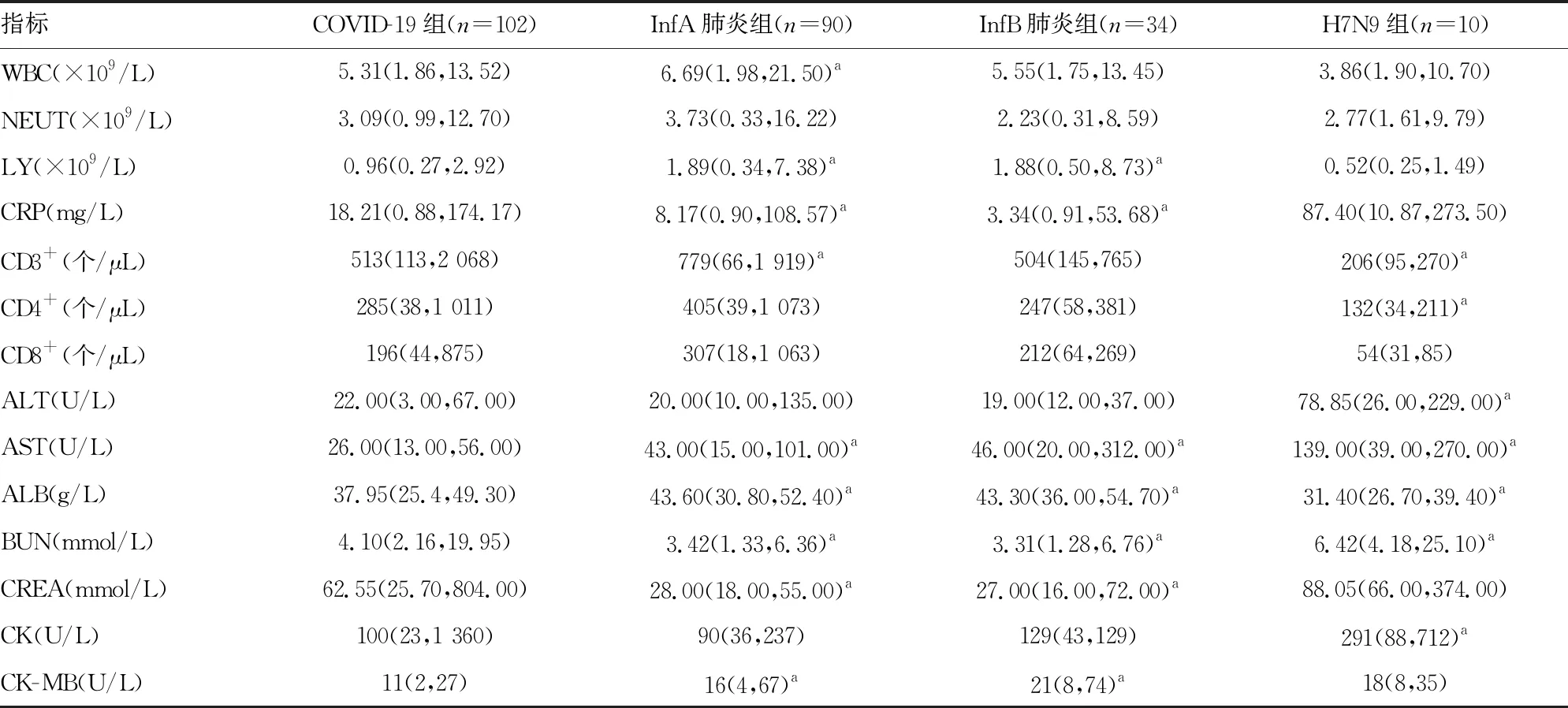
表2 COVID-19与其他呼吸道病原体性肺炎患者实验室数据比较[M(P25,P75)]

续表2 COVID-19与其他呼吸道病原体性肺炎患者实验室数据比较[M(P25,P75)]
3 讨 论
COVID-19是以肺部病变为主的新发传染病,通过飞沫、接触等途径在人与人之间迅速传播。相关报道指出,约有一半的COVID-19患者会发生呼吸困难,约1/3的患者需送入ICU进行治疗[6]。作为一种全球性的新发传染病,COVID-19的来源、病理机制、治疗策略等方面尚待进一步探索。本研究对呼吸道病毒感染引起的肺炎患者的实验室数据进行分析,旨在发现COVID-19与其他肺炎患者实验室指标的区别,以期为临床治疗COVID-19提供有价值的信息。
CRP是炎症、感染和组织损伤极其敏感的标志物,对炎症和感染有很好的监测作用[6-9]。当机体受到SARS-CoV-2刺激后[10],促炎性细胞因子增加,导致炎症风暴,继而导致CRP升高。有研究指出,SARS-CoV-2感染会引起CRP升高和LY减少[11]。本研究中,COVID-19组患者LY及CRP水平较InfA肺炎组、InfB肺炎组明显升高,差异有统计学意义(P<0.05);COVID-19组患者WBC低于InfA肺炎组,差异有统计学意义(P<0.05),原因可能为纳入统计的样本量不足及个体差异所致。
相关研究证实,呼吸道病毒感染引起的急性呼吸综合征重症患者中发现LDH升高[11-13]。刘映霞等[14]指出,ALB降低、LDH升高、CD8+细胞计数降低可能是预测COVID-19导致肺部损伤严重程度的生化指标。本研究中,COVID-19组患者与InfA肺炎组、InfB肺炎组患者ALB水平比较,差异有统计学意义(P<0.05),说明ALB水平可用于判断COVID-19所导致的肺损伤。COVID-19组与InfA肺炎组、InfB肺炎组及H7N9组LDH比较,差异有统计学意义(P<0.05),临床诊治方案也提到LDH可用于COVID-19的检测[6],但由于LDH在组织中存在的广泛性,因此只能在明确了COVID-19的情况下,LDH才可作为导致肺损伤程度的评判指标。
本研究中,COVID-19组与InfA肺炎组、InfB肺炎组及H7N9组AST水平比较,差异均有统计学意义(P<0.05)。XU等[15]与李翠芝等[16]的研究描述了多种复杂机制共同作用导致COVID-19患者出现肝损伤,说明SARS-CoV-2与其他呼吸道病毒相比,引起肝损伤的程度更严重。贺勇等[17]的研究也证实,肝功能受损可能是COVID-19的严重并发症。对于危重患者AST检查可评估对肝脏的损伤程度,当出现肝功能受损时应及时更换或加用保肝药物。肾脏是SARS-CoV-2感染的肺外靶器官之一,急性肾损伤(AKI)是COVID-19 患者死亡的独立危险因素之一。有研究发现,COVID-19相关AKI发病率与疾病严重程度呈正相关,且年龄大、合并慢性肾脏疾病的患者更容易并发AKI[18]。本研究中COVID-19组与InfA肺炎组、InfB肺炎组CREA水平比较,差异有统计学意义(P<0.05),提示CREA对于提高COVID-19患者救治率、降低病死率至关重要。
SARS-CoV-2感染后导致多种免疫紊乱,如TNF-α高表达,引起T细胞凋亡。据报道,SARS-CoV-2感染患者病程早期CD3+、CD4+、CD8+细胞计数均明显降低[19]。本研究结果显示,COVID-19组与InfA肺炎组及H7N9组CD3+细胞计数比较,差异有统计学意义(P<0.05),说明SARS-CoV-2导致的T细胞免疫功能抑制比其他呼吸道病毒感染更为严重。另外,COVID-19组与InfA肺炎组、H7N9组CD4+细胞计数比较,差异有统计学意义(P<0.05),表明患者机体免疫力受到抑制,而与H7N9组的比较,差异无统计学意义(P>0.05),可能是因为这两种病毒造成了患者T细胞耗竭和抗病毒免疫功能的钝化[20],另外,病毒感染引起的T细胞凋亡也可能是其减少的原因[21]。
有报道指出,H7N9人感染禽流感病毒主要引起心肌损伤[22]。本研究发现,COVID-19组与H7N9组心肌损伤的指标cTnT、NT-proBNP、MYO水平比较,差异无统计学意义(P>0.05);COVID-19组与H7N9组ALT水平比较,差异有统计学意义(P<0.05)。XU等[15]研究也表明,COVID-19不会造成心肌实质损伤,但本研究中,COVID-19组与InfB肺炎组MYO水平比较,差异有统计学意义(P<0.05)。COVID-19组与InfA肺炎组、InfB肺炎组CK-MB、BNP水平比较,差异均有统计学意义(P<0.05);COVID-19组与H7N9组LDH、CK、α-HBDH水平比较,差异有统计学意义(P<0.05),说明COVID-19会引起急性心肌损伤,可能是因为COVID-19患者症状主要为发热、心肌缺氧或耗氧量增加,从而诱发心肌的损伤[16],给予抗心力衰竭等治疗后好转。
4 结 论
COVID-19虽引起全球大范围流行,但在成都地区冬春季节发热患者的呼吸道感染病原体仍以InfA、InfB为主,SARS-CoV-2引起的感染所占比例较小;SARS-CoV-2可引起肺、肝、肾、心脏及机体免疫系统等多系统受损;与人感染高致病性H7N9比较,二者对机体的损伤差异主要表现在肝、肺损伤,对心脏的损伤差异不大[23];与SARS-CoV-2的10%致死率[24]、MERS-CoV的37%致死率[24],以及人感染高致病性禽流感H7N9的39%致死率[25]相比,成都市公共卫生临床医疗中心SARS-CoV-2的致死率较低,为2.94%,与既往研究相近[26]。

