贵州地区胆道系统感染常见病原菌及其耐药性分析*
罗湘蓉,许永杰,胡方芳,李红凌,张 华
(贵州省人民医院检验科,贵州贵阳 550002)
胆道感染为外科腹腔感染中的常见、多发、难治性疾病。重症感染可造成患者全身炎症反应综合征、脓毒症、多脏器功能不全,甚至死亡,识别致病微生物是治疗胆道感染的重要步骤,明确病原菌及其耐药性是初始经验性治疗和后续“降阶梯”治疗的重要依据[1]。不同地区不同时期引起胆道感染的病原菌及耐药性存在差异,在抗菌药物耐药性不断出现和增加的时代,监测和更新当地的抗菌药物谱已成为当务之急。及时了解本地区引起胆道感染的主要病原菌种类及其耐药状况,对临床经验性治疗胆道感染时选择抗菌药物具有重要意义[1-2]。目前,贵州地区尚缺乏引起胆道感染的病原菌及其耐药性的较大规模流行病学资料,因此,本研究对贵州省6家三级甲等医院2014-2018年胆道感染患者的胆汁标本中分离的病原菌及其耐药性进行分析,以期为治疗胆道系统感染提供依据。现报道如下。
1 材料与方法
1.1菌株来源 收集2014-2018年贵州省6家三级甲等医院怀疑胆道感染患者胆汁标本中分离的临床菌株,剔除重复菌株,共收集到1 778株细菌,涉及胆道疾病包括胆管结石、胆囊结石、胆管炎性狭窄、胆管肿瘤、十二指肠乳头癌、胰腺癌及胆囊癌等。质控菌株为贵州省人民医院微生物实验室保存的大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853、金黄色葡萄球菌ATCC29213、粪肠球菌ATCC29212。
1.2仪器与试剂 美国BD公司生产的PHOENIX100型全自动微生物分析仪及其配套试剂,法国梅里埃公司生产的VITEK2 COMPACT型全自动微生物分析仪及其配套试剂,广州迪景微生物公司或郑州安图公司生产的血琼脂平板、麦康凯琼脂平板。
1.3方法
1.3.1胆汁标本采集 通过外科方法采集胆汁标本,以无菌方式抽取注入无菌瓶中,立即送往检验科微生物室进行接种和细菌培养。
1.3.2病原菌培养及药敏鉴定试验 胆汁标本接种血平板和麦康凯平板。分离培养根据《全国临床检验操作规程(第4版)》[3]进行。采用美国BD公司生产的PHOENIX100型全自动微生物分析仪及其配套试剂或法国梅里埃公司生产的VITEK2 COMPACT型全自动微生物分析仪及其配套试剂全自动微生物分析仪进行鉴定与药敏试验,依据美国临床和实验室标准化协会2018年发布的标准(CLSI2018)[4]对药敏试验结果进行判读。
1.4统计学处理 采用WHONET5.6软件进行病原菌分布与耐药性分析。
2 结 果
2.1病原菌分布 1 778株病原菌包括革兰阴性杆菌1 417株(79.7%),革兰阳性球菌361株(20.3%)。前5位病原菌分别为大肠埃希菌772株(43.4%)、肺炎克雷伯菌242株(13.6%)、屎肠球菌170株(9.6%)、粪肠球菌122株(6.9%)、阴沟肠杆菌101株(5.7%)。见表1。
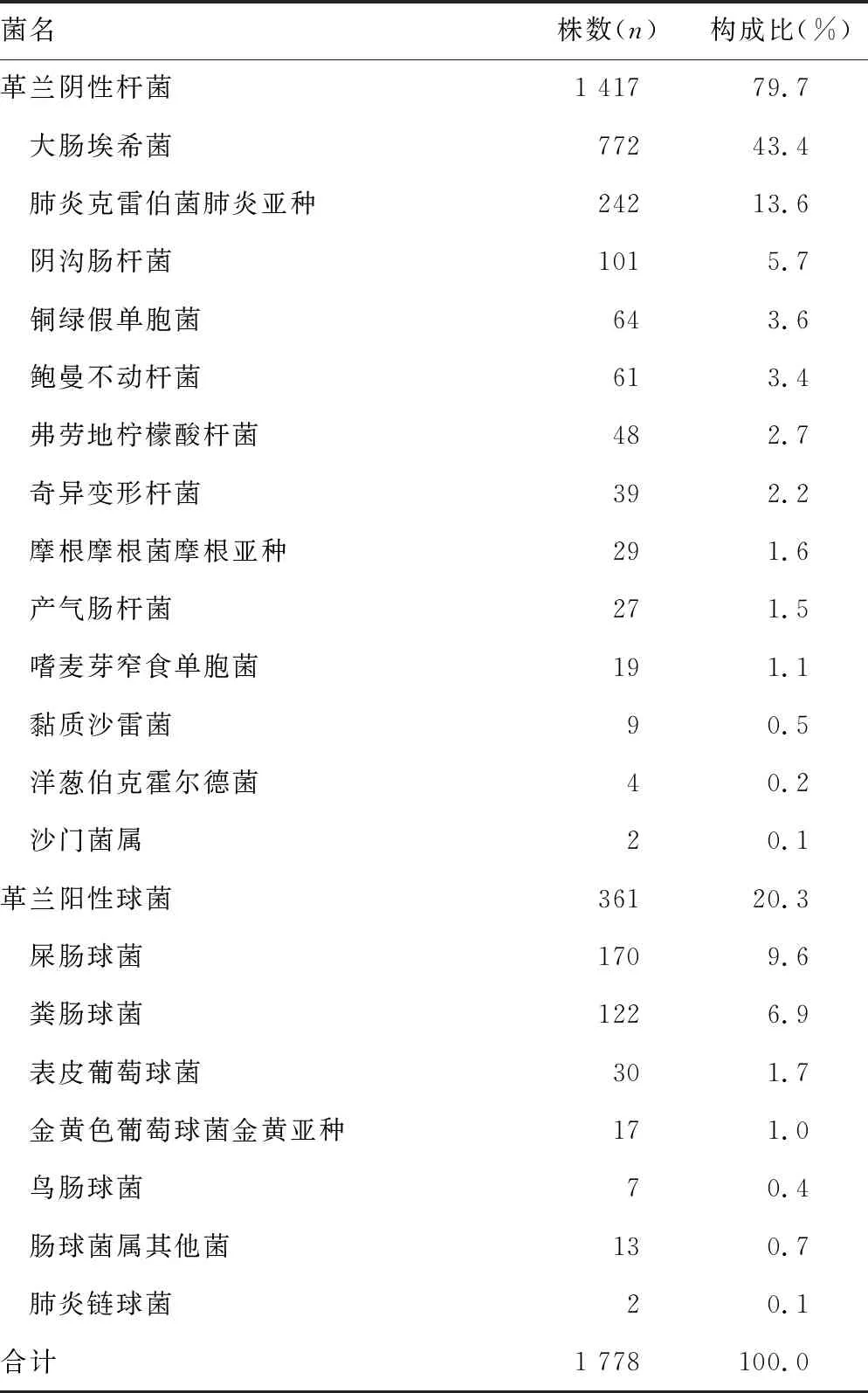
表1 胆汁标本病原菌分布
2.2药敏分析
2.2.1革兰阴性杆菌的耐药性 大肠埃希菌和肺炎克雷伯菌产超广谱β-内酰胺酶(ESBLs)的阳性率分别为62.5%(235/376)、48.6%(53/109)。大肠埃希菌对头孢噻肟、头孢他啶、头孢吡肟的耐药率分别为65.1%、39.1%、43.4%。大肠埃希菌对碳青霉烯类抗菌药物、阿米卡星、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦的耐药率较低(<20.0%)。见表2。
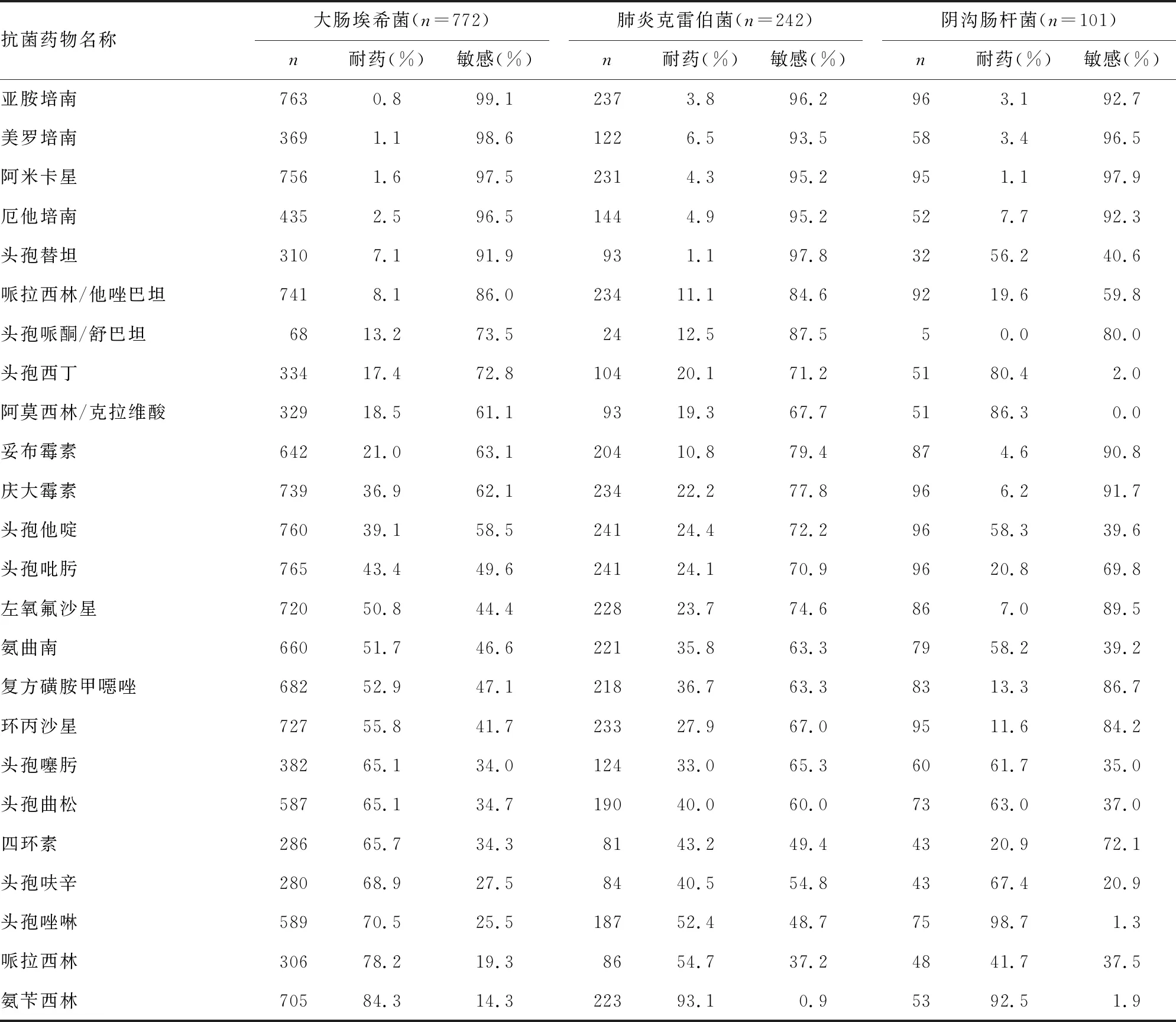
表2 胆汁标本主要革兰阴性杆菌对常用抗菌药物的耐药率
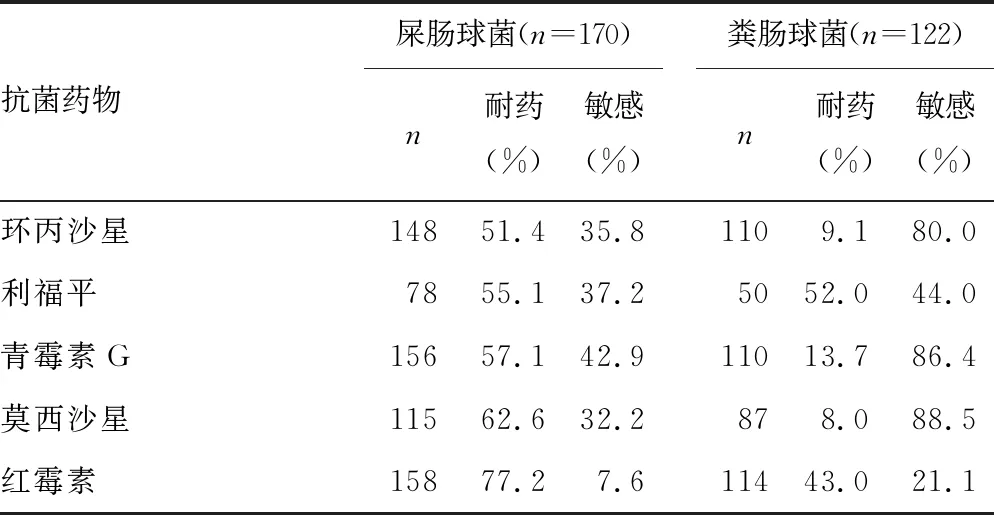
续表3 胆汁标本主要革兰阳性球菌对常用抗菌药的耐药率
2.2.2革兰阳性球菌的耐药性 未检出对利奈唑胺、替加环素耐药的屎肠球菌和粪肠球菌。耐万古霉素的屎肠球菌(VREM)、耐万古霉素的粪肠球菌(VREF)分别为0.6%、1.8%。粪肠球菌对喹诺酮类(左氧氟沙星、环丙沙星、莫西沙星)及氨苄西林的耐药率较低(<10.0%),屎肠球菌对多数抗菌药物的耐药率高于粪肠球菌。见表3。
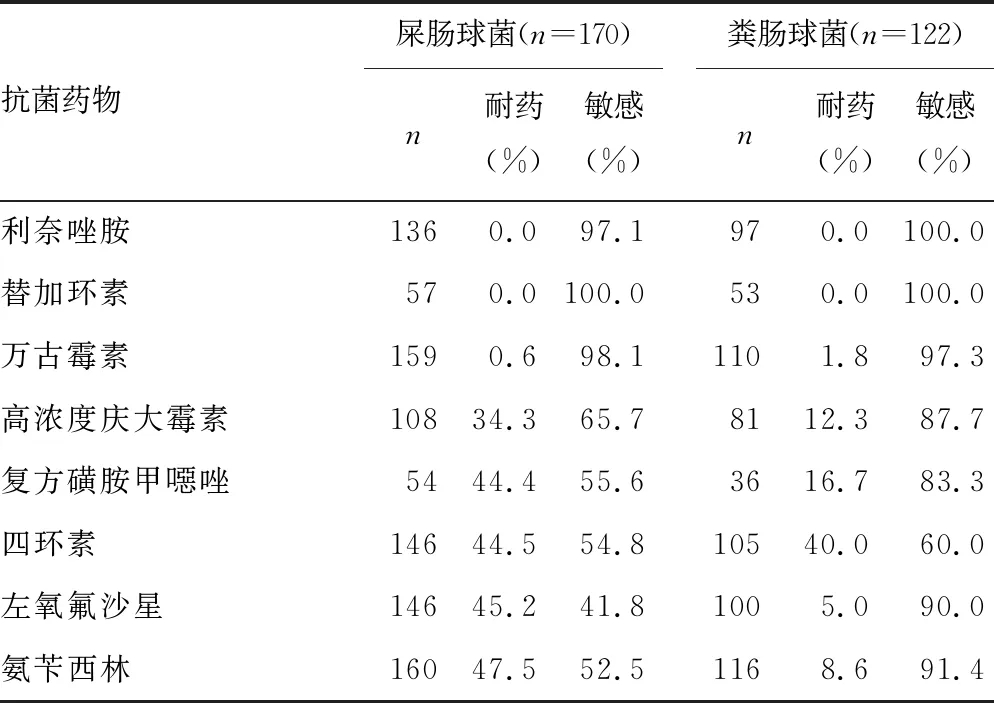
表3 胆汁标本主要革兰阳性球菌对常用抗菌药的耐药率
3 讨 论
正常情况下胆汁是无菌的,由于胆总管与消化道相连,当发生胆道结石、胆道狭窄等病理情况时,肠道细菌可能逆行至胆道系统,当侵入胆道的病原菌在胆道内异常增殖时可引起胆道感染[5]。有研究显示,胆道手术史、既往经内镜逆行胰胆管造影(ERCP)操作、合并胆结石、合并胰腺癌等是胆道感染的相关危险因素,其中胆道手术史、胆结石、胰腺癌等是胆道感染的独立危险因素[6],对该类高危人群应给予密切关注和适时干预。引起胆道感染的病原菌主要来源于十二指肠,各地区感染菌种存在一定差异。本研究结果显示,导致胆道系统感染的主要是革兰阴性杆菌(79.7%),占比高于宁波地区(61.5%)[7],其中肠杆菌科细菌占优势(71.4%);革兰阳性球菌(20.3%)低于宁波地区(32.9%)[7],与云南报道的25.1%接近[8];前5位细菌为大肠埃希菌(43.4%)、肺炎克雷伯菌(13.6%)、屎肠球菌(9.6%)、粪肠球菌(6.9%)、阴沟肠杆菌(5.7%),均为肠道细菌;革兰阳性球菌以肠球菌为主,其中以屎肠球菌、粪肠球菌为主,与文献[7]、[8]报道的结果一致。铜绿假单胞菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌等非发酵菌占一定比例,可能与近年来抗菌药物的广泛使用、侵入性治疗的广泛开展有关。也有文献报道,厌氧菌占胆道感染病原菌的4%~12%[9],所以存在胆肠吻合病史时,应经验性地覆盖脆弱拟杆菌属等厌氧菌[2]。贵州地区厌氧菌分离情况,还有待进一步研究。
胆道感染除需尽快解除梗阻和引流胆汁外,及时合理选用抗菌药物也十分重要。本研究结果显示,引起胆道感染的主要阴性杆菌对亚胺培南、美罗培南、厄他培南、阿米卡星、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦较敏感,与文献[10]报道结果相似。本研究结果还显示,大肠埃希菌、肺炎克雷伯菌对碳青霉烯类抗菌药物的敏感率在93.5%以上,碳青霉烯类抗菌药物虽然敏感性高,但因其价格昂贵,抗菌谱广,易造成菌群失调,引起真菌二重感染,故仅适用于危重患者严重感染时。考虑到阿米卡星有耳毒性、肾毒性等不良反应,不适合临床经验用药。贵州地区哌拉西林/他唑巴坦、头孢哌酮/舒巴坦对引起胆道感染的前3位革兰阴性杆菌的耐药率较低,可考虑作为治疗胆道感染的经验用药。由于细菌耐药性的变迁,本研究结果显示,大肠埃希菌等引起胆道感染前3位革兰阴性杆菌对氨苄西林,第二、三、四代头孢菌素及氨曲南具有较高耐药率,这几种抗菌药物已不适合作为贵州地区治疗胆道感染的首选经验用药。
本研究中,大肠埃希菌、肺炎克雷伯菌对青霉素类、喹诺酮类、头孢菌素、氨曲南耐药性较高很可能与高产ESBLs有关。产ESBLs菌株除对碳青霉烯酶类、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、阿米卡星、头霉菌素等保持较好的敏感率以外,对其他抗菌药物均显示较高的耐药率,与非产ESBLs菌株的耐药性存在显著性差异[8]。本研究结果发现,大肠埃希菌产ESBLs的检出率为62.5%,与宁波地区报道的62.50%相同[7],高于文献[8]、[11]报道的52.36%和45.20%;肺炎克雷伯菌产ESBLs的检出率为48.6%,高于文献[7]报道的34.2%;大肠埃希菌对头孢噻肟的耐药率(65.1%)明显高于头孢他啶(39.1%)、头孢吡肟(43.4%),与我国ESBLs耐药基因主要为blaCTX-M型有关[8]。
耐碳青霉烯类的肠杆菌科细菌(CRE)往往呈多重耐药甚至泛耐药的特征[12-13],导致患者陷入无药可用的困境。本研究中引起胆道感染的CRE比例为3.3%,与韩国与宁波地区报道的3.5%、1.03%~4.74%一致[14]。从细菌分布看,CRE分离率排前3位的为肺炎克雷伯菌(6.5%)、阴沟肠杆菌(7.7%)、大肠埃希菌(2.5%)。本研究耐碳青霉烯类的肺炎克雷伯菌(CRKP)检出率6.5%,比文献[8]报道的8.93%稍低。中国细菌耐药性监测网(CHINET)显示,肺炎克雷伯菌对亚胺培南和美罗培南的耐药率分别从2005年的3.0%和2.9%上升到了2017年的20.9%和24.0%,同时肺炎克雷伯菌每年的分离率呈稳步上升趋势[15]。在我国CRKP呈现快速上升趋势,应引起临床高度重视。有研究显示,碳青霉烯类耐药菌株对多数临床常用抗菌药物高度耐药,多数为仅对替加环素和多黏菌素敏感的广泛耐药菌株[13]。贵州地区CRKP主要耐药机制是产KPC-2型碳青霉烯酶,其次是产NDM-1和IMP-8型碳青霉烯酶。CRKP可在科室间、科室内克隆传播,应加强对CRKP的监测和医院内感染控制[13]。
肠球菌属是重度社区获得性急性胆管炎和胆囊炎患者治疗中需考虑的重要病原体[2],肠球菌耐药机制复杂,对头孢菌素、氨基糖苷类、克林霉素等多种抗菌药物天然耐药[4],屎肠球菌和粪肠球菌对利奈唑胺、替加环素、万古霉素耐药率低。本研究中出现了少量耐万古霉素的肠球菌,需引起重视。本研究中粪肠球菌对喹诺酮类和氨苄西林的耐药率低于10.0%,对粪肠球菌引起的胆道感染,可考虑选用该类抗菌药物。屎肠球菌对高浓度庆大霉素、复方磺胺甲噁唑、氨苄西林、喹诺酮类、青霉素G、红霉素的耐药率明显高于粪肠球菌。对于肠球菌引起的胆道感染,菌种鉴定及体外药敏试验结果对选用抗菌药物尤为重要。屎肠球菌对高浓度庆大霉素的耐药率为34.3%,高于文献[8]报道的22.8%。
4 结 论
综上所述,贵州地区胆道感染病原菌以大肠埃希菌、肺炎克雷伯菌等肠杆菌科细菌为主,其次为屎肠球菌、粪肠球菌等肠球菌,耐药细菌较多。检验人员应重视胆汁标本培养及药敏试验,定期获得可靠的细菌耐药性动态监测数据,从而有效指导临床用药。

