京尼平交联对兔脱细胞气管基质生物相容性的影响
仲毅 潘子寅 李剑锋 邹其成 史宏灿
1扬州大学临床医学院胸心外科225000;2南京中医药大学附属沭阳医院胸心外科,宿迁223600
0 引言
气管疾病主要由感染、创伤、肿瘤和先天性缺陷等因素所引起[1]。其常规治疗方案为切除病变气管并行端端吻合。然而,当气管缺损长度超过成人气管长度的1/2或儿童气管长度的1/3时,手术难以达到良好的治疗效果[2]。近年来,随着气管移植替代物研究的不断深入,组织工程显示出了巨大潜能,为患者提供了新的治疗选择。组织工程是利用原生、异体或人工合成等材料,结合种子细胞及生长因子,修复缺损器官并恢复其生理功能的替代治疗方法。理想的气管替代物应具有类似于原生气管的特征,包括致密性、无毒性和不可降解性等[3]。有研究结果显示,许多用于制备基质的脱细胞方法在去除细胞成分的同时可保持细胞外基质的结构和生物力学特性,例如曲拉通处理法(Triton-X 100 processed method,TPM)与去污剂联合酶法(detergent enzymatic method,DEM)等[4-5]。但脱细胞气管基质易降解和缺乏生物相容性限制了其临床应用。京尼平是一种天然交联剂,可形成稳定性强、细胞毒性低、生物相容性良好和不易钙化的交联产物,并可通过阻断降解酶进入基质来防止支架降解,增强交联产物的生物力学性能[6]。本研究旨在评估京尼平对脱细胞气管基质的结构和生物相容性的影响,并寻找制备组织工程气管支架的合适方法,仿生构建出一种新型的低免疫原性组织工程气管,为气管移植的临床应用研究提供理论基础和实验依据。
1 材料与方法
1.1 主要材料与仪器
脱氧胆酸钠、脱氧核糖核酸酶I、甲醛(美国Sigma公司),苏木精-伊红染液(南京凯基生物科技发展有限公司),胎牛血清(美国Clark Bioscience公司),DMEM-F12培养基(美国HyClone公司),CCK-8(Cell Counting Kit-8)工作液(中国Biosharp公司),京尼平(大连美仑生物技术有限公司)。健康无特定病原体级6月龄新西兰兔30只(气管供体),体质量范围2.5~3.0 kg,雌雄不限;健康无特定病原体级成年新西兰兔15只(异体移植受体),体质量范围2.5~3.0 kg,雌雄不限,均购于扬州大学临床医学院实验动物中心,许可证号为SYXK(苏)2012-0029。实验动物均于无特定病原体级动物房中分笼饲养,温度为18~24℃,相对湿度为40%~70%,自然光照,自由进食饮水。本研究所有的动物实验均获得扬州大学实验动物福利伦理委员会批准。
SW-CJ-1FD医用超净工作台(苏州安泰空气技术有限公司),BX41TF光学显微镜(日本Olympus公司),EVOS FL荧光显微镜[赛默飞世尔科技(中国)有限公司],S-4800场发射扫描电镜(日本Hitachi公司),AGS-X万能拉力试验机(日本Shimadzu公司),Epoch酶标仪(美国BioTek公司)。
1.2 方法
1.2.1 脱细胞气管支架的制备
30只健康无特定病原体级6月龄新西兰兔经耳缘静脉空气栓塞致死后,无菌条件下采用标准外科操作获取整段气管,剥离气管外表面疏松结缔组织,截取气管5~6 cm,置于含质量浓度为10 g/L抗生素药物的4℃磷酸盐缓冲液(phosphate buffered saline,PBS)中。分别采用TPM和DEM对气管进行脱细胞处理。
1.2.1.1 TPM
将新鲜气管置于4℃无菌蒸馏水中孵育48 h,随后置于质量浓度为20 g/L的Triton X-100溶液中室温孵育12 h,再于含2 000 kU/L脱氧核糖核酸酶I的1 mol/L NaCl溶液中37℃孵育4 h,无菌蒸馏水清洗(3次×5 min)后置于含质量浓度为10 g/L抗生素药物的PBS中4℃保存。
1.2.1.2 DEM
将新鲜气管置于4℃无菌蒸馏水中孵育48 h,随后置于质量浓度为40 g/L的脱氧胆酸钠溶液中室温孵育4 h,再于含2 000 kU/L脱氧核糖核酸酶I的1 mol/L NaCl溶液中37℃孵育3 h,无菌蒸馏水清洗(3次×5 min)后置于含质量浓度为10 g/L抗生素药物的PBS中4℃过夜;次日行下一循环,直至获取完整的脱细胞气管基质(7个DEM周期)。
1.2.2 京尼平交联脱细胞气管基质
将脱细胞气管基质置于质量浓度为10 g/L的京尼平溶液中37℃恒温交联1 h,用含质量浓度为10 g/L抗生素药物的PBS冲洗(3次×5 min),然后置于含质量浓度为10 g/L抗生素药物的PBS中4℃保存。
1.2.3 生物力学测试
将气管样本固定于万能拉力试验机上,给定初始负荷0.1 N,室温下以30 mm/min的恒定速率进行测试,实时记录样本组织的负荷及伸长率,分析样本的最大应力、抗拉强度、弹性模量以及组织变形情况。
1.2.4 扫描电镜观察
将气管样本用含质量浓度为25 g/L戊二醛的PBS(pH7.2)固定,梯度乙醇脱水,临界点干燥,喷金,采用扫描电镜观察气管基质结构。
1.2.5 细胞接触毒性实验
将气管样本剪为0.5 cm×0.5 cm大小,浸入体积分数为75%的乙醇中30 min,取出再置于紫外线下照射2 h。取培养至第4代的骨髓间充质干细胞悬液100 μl,滴至预先置有气管的96孔板中,密度为3×104个细胞/块,37℃孵育4 h。取出气管置于新培养板中,每孔加入200 μl含体积分数为10%胎牛血清的DMEM-F12培养基继续培养,每48小时更换1次培养基。分别于第1、3、5、7天吸弃培养基,加入100 μl CCK-8 工作液(稀释比例为 1∶10),37 ℃避光孵育2 h。吸取50 μl上清液,采用酶标仪测定上清液于450 nm处的吸光度(A450)值。
1.2.6 同种异体气管移植实验
将15只健康无特定病原体级成年新西兰兔按照随机数字表法分为原生气管移植组、京尼平交联TPM脱细胞气管基质移植组和京尼平交联DEM脱细胞气管基质移植组,每组5只。新西兰兔麻醉后分别于兔背部移植原生气管、京尼平交联TPM脱细胞气管基质和京尼平交联DEM脱细胞气管基质,移植气管长度均为2 cm。
1.2.7 组织学染色
移植后30 d处死各组新西兰兔,获取移植物样本,置于体积分数为10%的中性甲醛(pH7.4)中固定24 h,蒸馏水冲洗,梯度乙醇脱水,石蜡包埋,并切成4 μm厚切片。切片脱蜡后,分别进行苏木精-伊红染色和CD68分子免疫组化染色,观察移植物的微观结构。
1.3 统计学方法
采用SPSS19.0统计学软件处理数据,符合正态分布的计量资料采用均值±标准差(Mean±SD)表示,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 生物力学性能
由表1可知,与原生气管相比,京尼平交联TPM脱细胞气管基质和京尼平交联DEM脱细胞气管基质的最大拉伸应力差异均无统计学意义(均P>0.05),而拉伸强度与50%压缩变形应力均明显下降,差异均具有统计学意义(均P<0.05)。
2.2 扫描电镜结果
由图1可知,原生气管外表面可见大量黏膜上皮细胞,而京尼平交联后的脱细胞气管组织基膜结构仍然完整,且结构更加致密;与京尼平交联TPM脱细胞气管基质相比,京尼平交联DEM脱细胞气管基质外表面形成了网孔状纤维结构,有利于细胞黏附生长,表明京尼平交联联合DEM脱细胞处理可有效改善气管的表面结构。
2.3 细胞接触毒性实验
CCK-8细胞接触毒性实验结果见表2,黏附于气管支架表面的细胞在培养1~5 d内不断增殖,细胞数量持续增加;培养7 d时,因缺乏后续传代、细胞接触抑制及自身凋亡,细胞数量减少;各时间点两组京尼平交联脱细胞气管基质的细胞数量均明显多于原生气管组,差异均具有统计学意义(均P<0.05),表明京尼平交联可增强脱细胞气管基质的生物相容性。

表1 原生气管及京尼平交联脱细胞气管基质的生物力学性能
2.4 同种异体气管移植实验
术后30 d内各组动物均生长良好,体质量均有所增加,且手术切口基本吻合。术后30 d时,与移植前相比,移植物管腔被炎性结缔组织包绕,长度缩短,质量增加;其中原生气管管腔结构完全塌陷并堵塞,埋植物黏附于植入床上不易剥离,大量脓液积聚于囊性气管内,正常的气管解剖结构遭到破坏;与原生气管相比,两组京尼平交联脱细胞气管基质均能维持管腔状结构,周围包绕的结缔组织较少,无明显排斥迹象,且支架表面有血管生成(图2)。苏木精-伊红染色与CD68分子免疫组化染色结果表明,原生气管结构紊乱,软骨组织几乎完全被破坏,炎症细胞浸润,腺体结构丢失,且许多CD68阳性表达细胞分布于软骨中;与京尼平交联TPM脱细胞气管基质相比,京尼平交联DEM脱细胞气管基质炎症细胞浸润程度稍轻,无钙化等不良反应,软骨细胞形态无异常(图 3、4)。
3 讨论与结论
组织工程是修复器官或组织损伤的理想方案[7]。组织工程器官和组织已成功用于动物和临床试验,为器官和组织的修复与替代提供了广阔空间[8-9]。脱细胞组织具有构建适宜组织和气管支架的潜质,而制备气管支架是构建气管替代物的重要步骤。细胞外基质是结构和功能蛋白的复杂混合物[10],对组织再生及细胞分化具有重要意义,可为组织再生重建提供合适的细胞信号[11],因此选择合适的脱细胞方法至关重要。目前制备气管移植物的主要方法为基于Triton X-100的TPM与基于脱氧胆酸钠的DEM。这两种方法可有效去除器官或组织的细胞成分,且可最低限度或不改变脱细胞基质的生物活性及成分,从而制备出具有与原生气管相似的低免疫原性气管替代物。

图1 原生气管及京尼平交联脱细胞气管基质的扫描电镜图(×600)
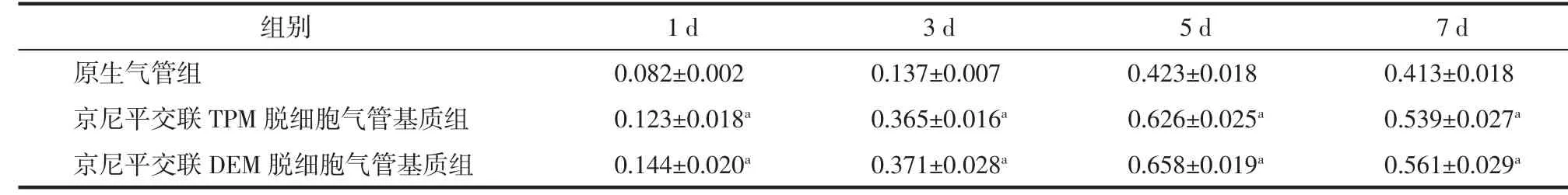
表2 原生气管及京尼平交联脱细胞气管基质与骨髓间充质干细胞贴附4 h后培养不同时间的A450值(Mean±SD,n=3)

图2 兔气管异体移植前后各组气管样本的大体观察结果

图3 兔气管异体移植后30 d各组气管样本的苏木精-伊红染色结果(×200)

图4 兔气管异体移植后30 d各组气管样本的CD68分子免疫组化染色结果(×200)
Yu等[12]研究发现,与TPM相比,DEM可保持心脏瓣膜脱细胞支架的结构,并可更彻底地剥离细胞成分。目前DEM已广泛应用于各个领域,如咽喉[13]和血管[14]等。大鼠[15]和猪[16]的脱细胞气管基质制备已经实现,进一步证实了DEM为理想的脱细胞方法。DEM可去除上皮细胞成分,制备的脱细胞支架基质结构与天然样品相似[17]。本研究中细胞接触毒性实验结果显示,经DEM处理的脱细胞气管基质的细胞增殖与黏附状况更接近原生气管。但能完全去除细胞成分并保留细胞外基质结构和生物力学特性的最佳方法仍未被发现。Sun等[18]的研究结果表明,脱细胞材料的力学性能远低于原生气管,不足以用于后续研究。因此,本研究在制备脱细胞气管支架时应用京尼平进行交联处理,以提高其结构稳定性和生物相容性。
应用交联剂的目的在于提高脱细胞气管支架的稳定性,使其在植入体内形成稳定支撑性能前不被降解酶破坏[19]。与戊二醛等传统化学交联剂相比,京尼平的细胞毒性较低。已有研究结果证明,京尼平交联的脱细胞气管基质对细胞基本无毒性[20]。京尼平可与氨基酸链或蛋白质自发反应,从而诱导胶原纤维分子内和分子间交联形成环状化合物结构,在一定程度上提升了组织工程支架的机械稳定性。传统的戊二醛交联剂主要存在毒性较大、植入后钙化等问题,而京尼平为天然衍生物交联剂,毒性小,且在降低生物材料体外细胞毒性方面与戊二醛一样有效,因此京尼平在组织工程气管中的使用前景更加广阔[21]。此外,京尼平还具有抗炎、抗血栓和抗氧化活性,可抑制血管和内皮细胞的炎性活化[22]。笔者采用京尼平对脱细胞气管基质进行交联,发现交联处理后,脱细胞气管基质的管腔状结构仍然保留且结构完整,细胞外基质纤维微观结构更加致密,并可诱导血管再生。本研究中体外实验结果显示,京尼平交联DEM脱细胞气管基质外表面形成了网孔状纤维结构,有利于细胞的增殖与黏附[23]。
气管基质的软骨细胞在合成和分泌胶原纤维和软骨基质中具有重要作用,而完整的软骨结构对于保持气道通畅至关重要,且脱细胞处理的目的在于尽可能减少免疫原性细胞[24]。因此笔者进行体内埋植实验和组织学染色实验,以验证京尼平交联脱细胞气管基质的免疫原性。结果显示,京尼平交联DEM脱细胞气管基质的管腔结构完好,炎症反应较低,无明显局部排斥反应,气管基质外表面有新生血管生成,表明京尼平交联未改变气管基质的血管生成性能,且有利于血管再生及血运重建。
综上所述,京尼平可在不引起体内炎症反应的基础上改善脱细胞气管基质的超微结构,且京尼平交联DEM脱细胞气管基质拥有更好的生物相容性与更低的免疫原性,适合用于组织工程气管替代。
利益冲突 所有作者均声明不存在利益冲突

