NO供体型咖啡酸酯类衍生物的合成及其抗肿瘤活性研究
陈维珍
黄山职业技术学院医学系,安徽黄山,245000
咖啡酸,又名3,4-二羟基肉桂酸,是广泛分布于植物中的一种酚性芳香酸类化合物,具有抗氧化、抗炎、抗神经损伤、抑菌抗病毒、改善糖尿病、抗肝纤维化等多种生理活性[1-3],一些天然的咖啡酸类化合物能抑制多种肿瘤细胞生长、分化、增殖,促肿瘤细胞凋亡,降低抗癌药物不良反应,防止和逆转化学物致癌作用[4-6],如蜂胶中的咖啡酸苯乙酯(CAPE)、迷迭香酸、丹参素、阿魏酸、丹酚酸B[7-9]等;杨叶等[10]发现咖啡酸可通过影响microRNA调控网络以起到抗癌的作用,另一方面, 咖啡酸又能通过上调肿瘤细胞内线粒体活性氧水平,诱导肿瘤细胞凋亡。在抗肿瘤方面,咖啡酸不仅自身作用极大,还可与其他药物产生协同作用。咖啡酸毒性低,安全性高,但由于其水溶性强,亲脂性差,对其代谢动力学产生不良影响,这在一定程度上限制了它的开发和利用。咖啡酸分子结构独特而简单,易于进行结构修饰并能方便地引入各种功能基团,为研发高效、低毒、具有靶向性的咖啡酸类抗肿瘤药物提供了良好的结构基础。因此,运用现代药物开发的一些理念和手段将咖啡酸作为先导化合物进行进一步的研究、开发是必要且可行的。
研究发现,咖啡酸经过羧基酯化后脂溶性提高,穿透生物膜的能力增强,抗肿瘤活性将增强,一些具有高生物活性或具有临床治疗作用的咖啡酰基结构修饰及改造物已见报道[11-13](见图1)。
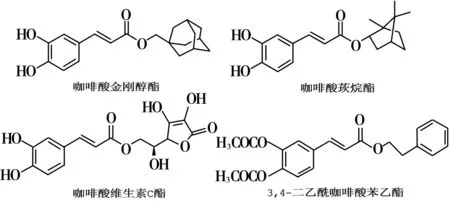
图1 咖啡酸结构修饰和改造物
NO是体内重要的信使分子,参与许多重要的生理过程。高浓度的NO可诱导肿瘤细胞凋亡,抑制肿瘤的扩散和转移[14]。呋咱氮氧化物是重要的NO供体之一,在体内可释放高浓度NO,抑制肿瘤生长[15]。研究表明,将具有一定抗肿瘤活性的化合物与呋咱氮氧化物偶联,得到的偶联物可发挥协同效应,增强抗肿瘤活性[16-17]。为此,本文拟以咖啡酸为先导化合物,将其用不同的连接臂与呋咱氮氧化物相结合,设计、合成NO供体型咖啡酸酯类衍生物,并采用MTT法对其抗肿瘤活性进行研究。
1 仪器与试剂
Nicolet Avatar 370DTGS 型红外光谱仪,Bruker AVNCE-400 MHz 超导核磁共振仪,Agilent 1100 series LC-MSD 液质联用仪。薄层硅胶G板(合肥森瑞有限公司),柱色谱用硅胶(青岛海洋化工有限公司),咖啡酸(含量>98%,成都德思特生物技术有限公司);苯硫酚、二氯甲烷(CH2Cl2)、氯乙酸、发烟硝酸、30%双氧水(H2O2),冰醋酸、三乙胺(Et3N)、氯化亚砜(SOCl2)、二氧六环乙二醇、1,3-丙二醇、1,4-丁二醇、1,5-戊二醇、1,6-己二醇等均为分析纯,由中国医药集团提供;噻唑蓝(MTT)试剂(阿拉丁试剂)、胰蛋白酶消化液(上海雅心生物技术有限公司)、10%胎牛血清(滁州仕诺达生物科技有限公司); 人结肠癌SW620和人乳腺癌MDA-MB-231细胞株来自安徽科技学院药理课题组。
2 方 法
2.1 合成路线的设计
NO供体型咖啡酸酯类衍生物的合成参照文献[18],先合成苯磺酰呋咱氮氧化物4,再将其与不同的二醇化合物进行反应合成不同碳链的呋咱二醇化合物5a~5e。将咖啡酸羧基进行酰氯化,提高其酰化活性,在三乙胺为缚酸剂的作用下,将其与不同连接臂的呋咱氮氧化物5a~5e进行酯化,合成目标化合物7a~7e,见图2。
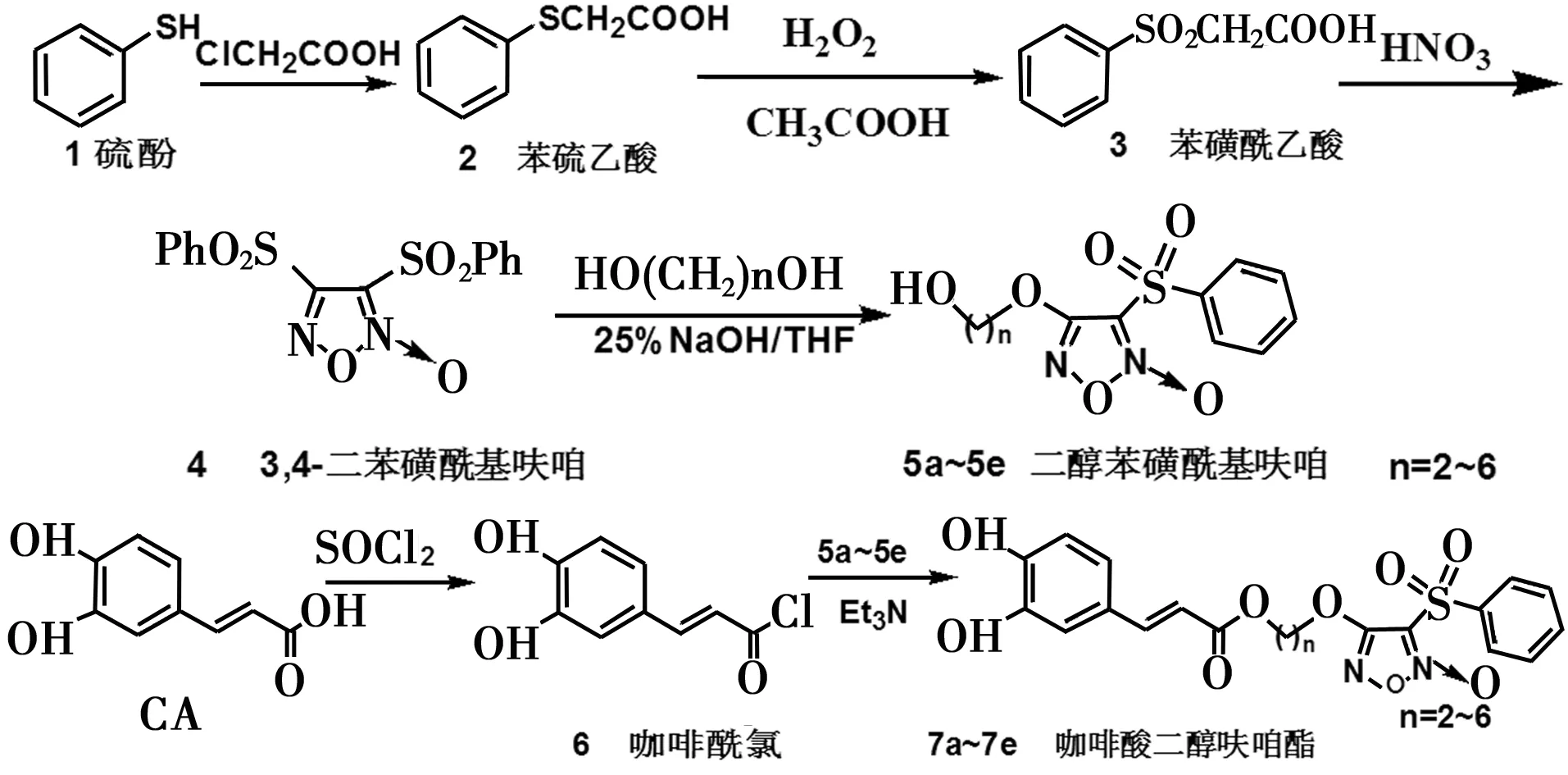
图2 目标化合物的合成路线
2.2 实验步骤
2.2.1 苯硫乙酸(2)的合成
取22.0 g(0.20 mol)硫酚和8.0 g(0.20 mol)氢氧化钠溶于100 mL 95 %乙醇中 ,加入到18.9 g(0.20 mol)氯乙酸和 12.7 g(0.12 mol)碳酸钠配成的200 mL水溶液中,室温搅拌3 h后,再回流 1 h,冷却至室温后,减压除去乙醇,用6 mol/ L盐酸调pH至2,有白色沉淀生成,过滤,干燥得白色晶体25.9 g,收率77%。
2.2.2 3,4-二苯磺酰基呋咱(4)的合成
取16.8 g(0.10 mol)化合物1溶于装有80 mL冰醋酸的圆底烧瓶中,缓慢滴加20 mL 30%H2O2,室温搅拌3 h后缓慢滴加 40 mL发烟硝酸,控制内温不超过40 ℃。滴毕升温至100 ℃反应 。反应4 h后冷却至室温,析出白色针状结晶。过滤,干燥得14.6 g,收率80%。
2.2.3 二醇苯磺酰基呋咱化合物(5a~5e)的合成
将1 g(2.7mmol)化合物3溶于10 mL四氢呋喃中 ,搅拌下加入不同二醇化合物(10.0 mmol),滴加0.5 mL(3 mmol)25%氢氧化钠水溶液,室温下搅拌反应2 h,TLC检测进程,原料反应完全后,将反应液倾入20 mL水中,乙酸乙酯萃取(20 mL ×3),合并有机相后加饱和食盐水洗涤,无水硫酸钠干燥。过滤后滤液浓缩。硅胶柱色谱分离∶V(乙酸乙酯)∶V(石油醚)=1∶4 ,得白色固体,产率55%~78%。
2.2.4 咖啡酰氯(6)的合成
严格控制好无水条件操作。准确称取1.8 g咖啡酸(10.0 mmol) 装于100 mL圆底烧瓶,加入二氧六环20 mL使之溶解,5~7滴DMF,室温下缓慢加入SOCl2约4 mL,安装好氯化钙干燥装置和尾气吸收装置,回流反应约2 h后,常温减压回收溶剂及未反应的SOCl2得白色结晶1.7 g,收率85.8%。
2.2.5 目标化合物NO供体型咖啡酸酯类衍生物(7a~7e)的合成通法
取前步制得的化合物(6)1.0 g(约5.0 mmol)溶于二氯甲烷中,冰浴条件下滴加到二醇呋咱(5a~5e)和三乙胺的二氯甲烷溶液中,滴加完毕,升至室温搅拌反应,TLC跟踪反应进程。反应结束后,将反应液倒入100 mL水中,二氯甲烷萃取(50×3),合并有机相,无水硫酸钠干燥。过滤,滤液减压浓缩,柱层析(流动相为 EA∶PE=1∶4,V∶V)得目标化合物7a~7d。
2.2.6 细胞毒活性测试
以阿霉素为阳性对照,咖啡酸为原型药对照组,以人结肠癌细胞SW620、人乳腺癌细胞MDA-MB-231为受试细胞株,用MTT比色法对合成的化合物7a~7e进行体外细胞增殖活性实验。方法:取对数生长期的细胞,用胰酶消化细胞,离心后用含10%胎牛血清的细胞培养基将其制成单细胞悬液,以8×104个/mL 的密度接种于96 孔板,每孔100 μL,置37 ℃恒温培养箱培养24 h换液。按浓度梯度(2.5 μg/mL,5 μg/mL,10 μg/mL,20 μg/mL,40 μg/mL)加入待测药物,各浓度设3个复孔,每孔100 μL,置37 ℃恒温培养箱中分别培养48 h。细胞离心,吸去孔内培养上清液,每孔各加入新鲜的细胞培养基100 μL和MTT(5 mg/mL)20 μL,恒温培养箱中继续孵育4 h。离心10 min 后吸去孔内培养上清液,每孔加150 μL DMSO,摇床振摇7~8 min。之后,用酶标仪在波长为490 nm 处测出各孔的吸光度值(OD值)。按如下公式计算对细胞生长的影响:细胞生长抑制率(%)=[(OD试验-OD空白)/(OD对照-OD空白)]×100。并通过计算软件算出不同药物对不同肿瘤细胞株的半数抑制浓度(IC50)。
3 结果与讨论
3.1 目标化合物的实验数据
化合物咖啡酸乙二醇呋咱酯(7a):淡黄色粉末1.16 g, 收率52 %,H-NMR(500MHz,DMSO)δ:4.45(t,2H ,-OCH2-),5.22(t,2H,-OCH2-),6.30(d,1H,J=16 Hz ,-CH=CH-),6.76(d,J=8.33 Hz,1H,Ar-H),7.02 (dd,J=8.24,1.85 Hz,1H,Ar-H),7.06(d,J=1.85 Hz,1H,Ar-H),7.55(d,1H,J=16 Hz,-CH=CH-),7.50~ 7.88(m,5H ,ArH),8.90(s,1H,OH),9.57(s,1H,OH)。ESI-MS,m/z(%):449.21[M+H],其质谱图如图3。
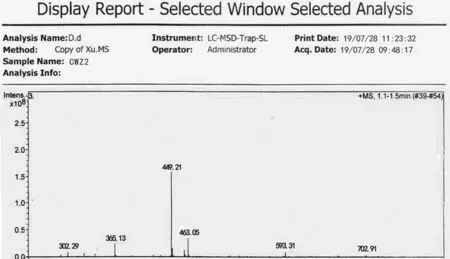
图3 目标化物7a的MS图谱
化合物咖啡酸丙二醇呋咱酯(7b):淡黄色粉末1.29 g, 收率56%,H-NMR(500 MHz,DMSO)δ:2.25(m,2H,CH2)4.43(t,2H,-OCH2-),5.20(t,2H,-OCH2-),6.30(d,1H,J=16 Hz,-CH=CH-),6.75(d,J=8.33 Hz,1H,Ar-H),7.01(dd,J=8.24,1.85 Hz,1H,Ar-H),7.07(d,J=1.85 Hz,1H,Ar-H),7.55(d ,1H,J=16 Hz ,-CH=CH-),7.48~7.86(m,5H ,Ar-H),8.90(s,1H,OH),9.54(s,1H,OH)。ESI-MS,m/z(%):463.09[M+H]
化合物咖啡酸丁二醇呋咱酯(7c):淡黄色粉末1.62 g, 收率68 %,H-NMR(500 MHz,DMSO)δ:1.77(m,2H,CH2),2.10(m,2H,CH2),4.45(t,2H,-OCH2-),5.22(t,2H,-OCH2-),6.30(d ,1H,J=16 Hz,-CH=CH-),6.75(d,J=8.33 Hz,1H,Ar-H),7.02(dd,J=8.24,1.85 Hz,1H,Ar-H),7.07(d,J=1.85 Hz,1H,Ar-H),7.54(d ,1H,J=16 Hz,-CH=CH-),7.48~7.92(m,5H,Ar-H),8.91(s,1H,OH),9.55(s,1H,OH)。ESI-MS,m/z(%):476.89[M+H]
化合物咖啡酸戊二醇呋咱酯(7d):淡黄色粉末1.42 g,收率58%,H-NMR(500 MHz,DMSO)δ:1.59(m,2H,CH2),1.77(m,2H,CH2),2.10(m,2H,CH2),4.45(t,2H,-OCH2-),4.51(t,2H,-OCH2-),5.22(t,2H,-OCH2-),5.28(m,1H,-OCH -),6.32(d,1H,J=16 Hz,-CH=CH-),6.76(d,J=8.33 Hz,1H,Ar-H),7.06(d,J=1.85 Hz,1H,Ar-H),7.02(dd,J=8.24,1.85 Hz,1H,Ar-H),7.55(d,1H,J=16 Hz ,-CH=CH-),7.45~7.80(m,5H,ArH),8.88(s,1H,OH),9.56(s,1H,OH)。ESI-MS,m/z(%):491.30[M+H]
化合物咖啡酸己二醇呋咱酯(7e):淡黄色粉末1.33 g,收率53%,H-NMR(500 MHz,DMSO)δ:1.39(m,2H,CH2),1.58(m,2H,CH2),1.77(m,2H,CH2),2.15(m,2H,CH2),4.44(t,2H,-OCH2-),4.53(t,2H,-OCH2-),5.25(t,2H,-OCH2-),5.32(m,1H,-OCH-),6.30(d ,1H,J=16 Hz,-CH=CH-),6.76(d,J=8.33 Hz,1H,Ar-H),7.06(dd,J=8.24,1.85 Hz,1H,Ar-H),7.14(d,J=1.85 Hz,1H,Ar-H),7.45(d,1H,J=16 Hz,-CH=CH-),7.56~ 7.92(m,5H,ArH),8.99(s,1H,OH),9.67(s,1H,OH)。ESI-MS,m/z(%):504.99[M+H]
3.2 细胞毒活性结果
采用MTT 法,以人结肠癌细胞SW620、人乳腺癌细胞MDA-MB-231为模型,以阿霉素和咖啡酸为对照药,测定5 个NO供体型咖啡酸衍生物体外对肿瘤细胞生长抑制作用,实验结果见表1。
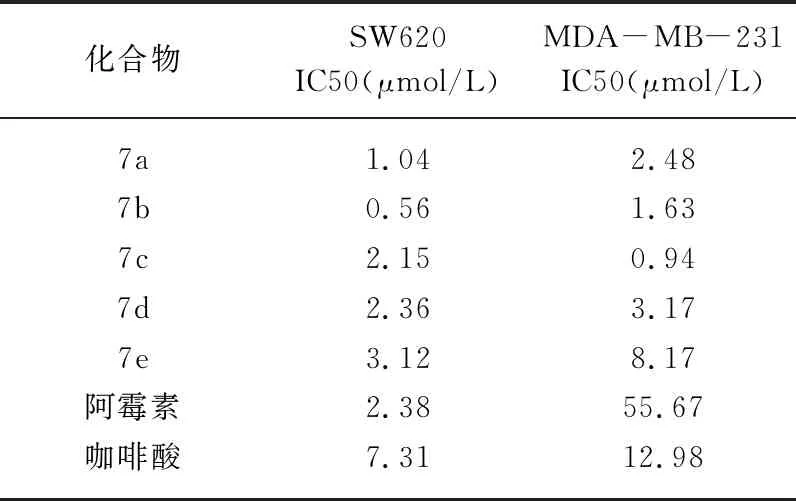
表1 目标化合物对肿瘤细胞的生长抑制情况
从表1可知,目标化合物7a~7e均有较强的抗肿瘤活性。其对人结肠癌细胞SW620、人乳腺癌细胞MDA-MB-231细胞株的IC50值均达较低水平,强于对照药咖啡酸。部分化合物活性强于阳性对照药阿霉素。其中化合物7b对结肠癌SW620细胞株增殖抑制活性最强,化合物7c对乳腺癌MDA-MB-231细胞株增殖抑制活性最强。
4 结 论
研究表明,将咖啡酸与NO供体呋咱氮氧化物通过不同连接臂偶联制成酯衍生物,可使两者发挥协同作用,提高抗肿瘤能力。当连接臂为2个碳时,对结肠癌SW620增殖活性抑制最强,当连接臂为3个碳时,对乳腺癌MDA-MB-231的增殖活性最佳。7b和7c为未见文献报道的新化合物,有进一步深入研究的价值。

