基因筛选克隆表达原花青素降解酶及其酶解条件优化的初步研究
苏惠娟 刘 丹 闫 堃 张 超 王文雅,2 袁其朋*
(1.北京化工大学 生命科学与技术学院, 北京 100029; 2.北京化工大学 厦门北化生物产业研究院, 厦门 361000;3.济南市济阳区综合检验检测中心, 济南 251400)
引 言
葡萄籽是葡萄酒和葡萄汁工业的主要副产物,含有多种活性物质。来源于葡萄籽的多酚——原花青素,具有很好的药理学功能,如抗氧化性、抗菌性、抗炎性等[1],因此葡萄籽原花青素在食品、制药、医疗保健等领域应用广泛。葡萄籽中的原花青素主要由单体儿茶素(C)/表儿茶素(EC)及其二聚体,三聚体和高聚体组成,最高可达十五聚体[2-3]。研究发现葡萄籽中65%的原花青素聚合度n大于5[3],即由5个以上的单体聚合而成,然而关于原花青素生物利用率的研究显示,只有聚合度小于5的原花青素才能被人体吸收利用[4-7]。故虽然原花青素有很好的生物活性,但多数大分子原花青素不能被人体吸收利用,因此将高聚原花青素(n≥5)转化为能被人吸收的低聚原花青素(n<5)或单体是提高其吸收率和推动葡萄籽高附加值利用的重要途径之一。目前,国内外常用的原花青素解聚方法主要有弱酸法[3]、单体链断裂剂法[8]、酸式盐法[9]、催化剂加氢裂解法[10]、碱裂解法[11]等。上述方法由于普遍存在生产成本高、对设备要求苛刻,或者有毒性气体产生等问题,不适用于食品生产过程。酸碱水解法是目前使用较多的原花青素解聚方法,但是由于其潜在的环保问题和较多的副产物,也亟须改进和提升。利用酶蛋白降解高聚物具有条件温和、底物特异性强、副产物少等特点,如果能利用生物酶解聚高聚原花青素制备低聚原花青素,将对原花青素的解聚和葡萄籽的高附加值利用产生巨大的推动作用。对于降解原花青素的酶目前尚未有文献报道,因此本文的研究目的即是从已有的生物信息学数据库中寻找和挖掘能够降解原花青素的酶,并对其降解能力进行表征,为酶法解聚原花青素提供研究方法和基础数据。
1 材料与方法
1.1 实验原料
大肠杆菌购自北京全式金生物技术有限公司;质粒载体(pETDuet- 1/pMAL/pZE)为本实验室保存;金黄色葡萄球菌购自中国科学院微生物研究中心。
限制性内切酶和T4连接酶,赛默飞世尔科技(中国)有限公司;DNA聚合酶及其他PCR反应相关试剂,宝生物工程(大连)有限公司;DNA Marker和蛋白Marker,北京博迈德生物技术有限公司;涉及的DNA电泳试剂,Biomatik公司;异丙基-β-D-硫代吡喃半乳糖苷(IPTG),纯度大于98%,上海赛百胜公司;蛋白SDS- PAGE电泳相关试剂,Amresco公司。
纯度大于95%的原花青素,天津市尖峰天然产物研究开发有限公司;纯度大于98%的表儿茶素、儿茶素、原花青素二聚体 B1和原花青素二聚体 B2,成都曼思特生物科技有限公司;其他相关化学试剂购买自北京化学试剂公司。
1.2 仪器与设备
V- 5100B紫外分光光度计,上海元析仪器有限公司;LC- 20AT液相色谱仪(RP- HPLC),日本岛津公司;2- 16KL冷冻离心机,德国Sigma公司;WS600+蛋白电泳仪,河北万生博朗电子有限公司;01C714超声波细胞破碎仪,宁波新芝生物科技有限公司;EPS- 100核酸电泳仪,上海天能科技有限公司。
1.3 实验方法
1.3.1高聚原花青素提取
参照文献[12]中的方法并略作改动,提取制备原花青素样品中聚合度较高的组分。用超纯水溶解葡萄籽原花青素样品,于容量瓶中定容,随后在分液漏斗中用乙酸乙酯反复萃取3次,收集水相并旋干得粗品。用甲醇将粗品溶解后,加入氯仿充分混合静置,然后离心收集固体,加少量甲醇重新溶解后,将溶液转移至鸡心瓶中45 ℃旋干,得到的固体即为高聚原花青素样品。
1.3.2酶解体系
酶解体系参照Devenish等[13]的方法并稍作改动。将200 mmol/L磷酸缓冲液、酶液与适量的原花青素或精制高聚原花青素固体充分混匀后,在摇床中震荡反应一段时间,其中反应体系的总体积为1 mL。反应结束后,检测反应体系中的单体和二聚体原花青素含量。
1.3.3原花青素中单体和二聚体含量测定
本文用来表征原花青素酶解后单体和二聚体含量变化的两种单体标品分别是儿茶素和表儿茶素,两种二聚体标品分别为原花青素B1、B2。采用LC- 20AT液相色谱仪,测定条件如下:流动相为乙腈(A)和0.5%磷酸水溶液(B),按照表1所示的条件进行梯度混合洗脱;色谱柱为 Diamonsil- C18 色谱柱(250 mm×4.6 mm,5 μm),柱温设为35 ℃,流速采用0.7 mL/min,上样量20 μL,使用二极管阵列检测器,检测波长280 nm。

表1 RP- HPLC的梯度洗脱条件Table 1 The RP- HPLC gradient elution conditions
1.3.4基因工程菌构建
基因工程菌构建过程中所涉及的工程菌的培养转化、重组酶蛋白的提取等分子生物学方法均参照Sambrook等[14]的研究方法,其中载体构建用到的引物如表2和表3所示。
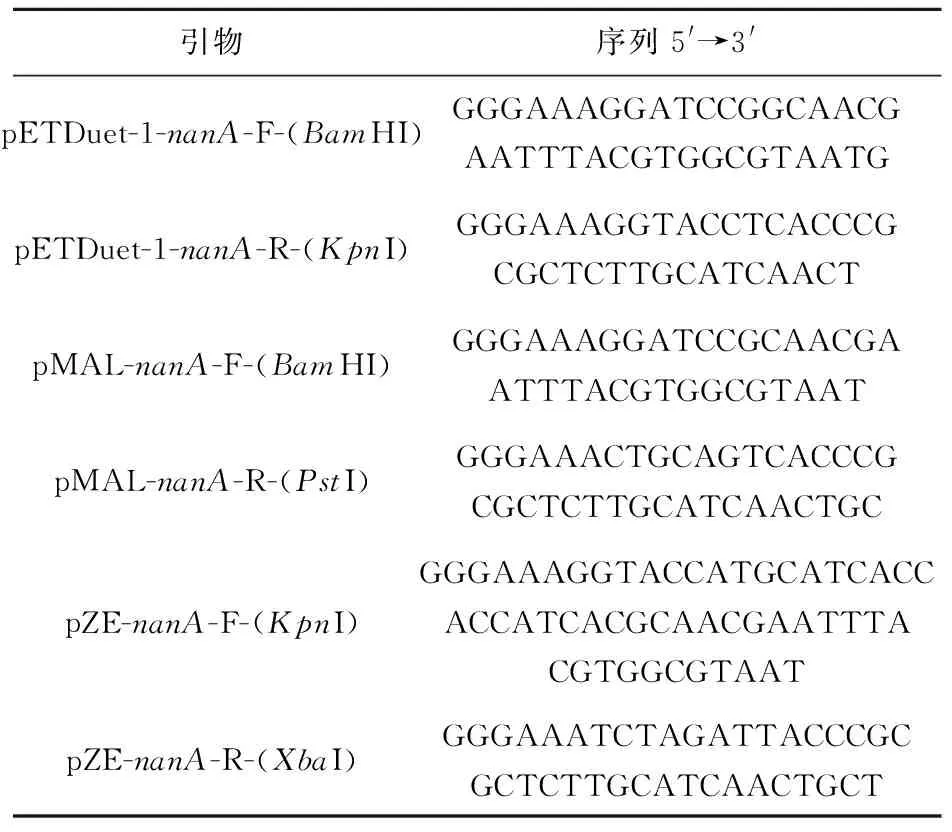
表2 扩增大肠杆菌来源nanA基因所用引物Table 2 Primers for amplifying the nanA gene from Escherichia coli
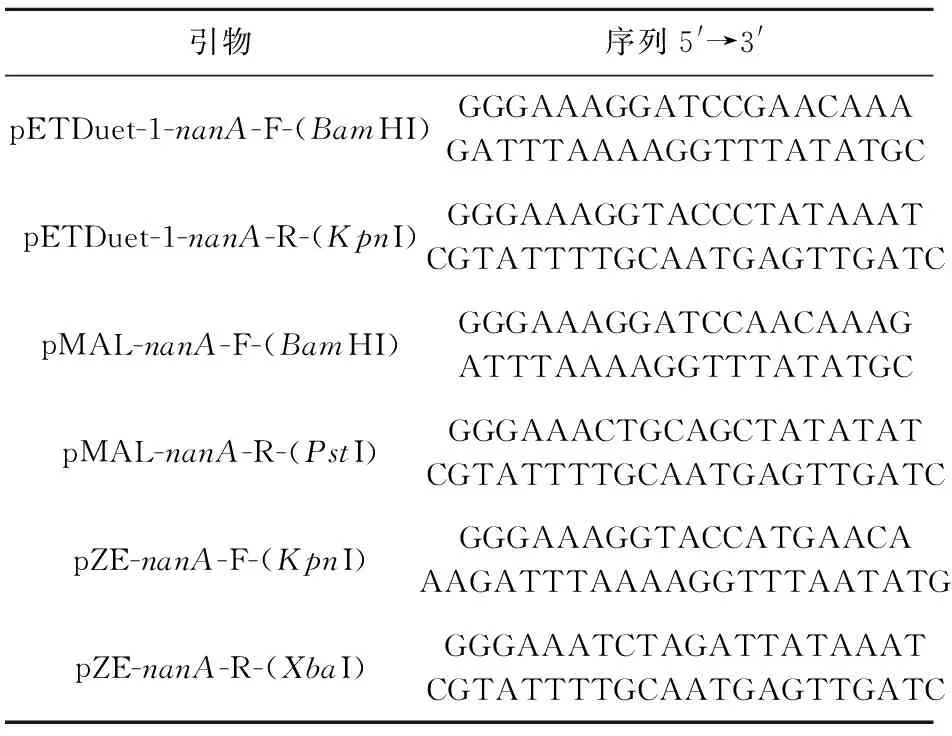
表3 扩增金黄色葡萄球菌来源nanA基因所用引物Table 3 Primers for amplifying the nanA gene from Staphylococcus aureus
1.3.5数据分析
所有实验重复3次,利用Origin 2017对实验数据进行分析,数据结果采用平均值±标准差的形式表示。
2 结果与分析
2.1 降解酶的基因筛选
原花青素各单元间主要由C4→C8和C4→C6两种连接方式连接(图1),而高聚原花青素降解为低聚原花青素的过程也主要依靠聚合物单体间连接键的断裂。因此通过在酶学数据库中寻找底物与原花青素结构类似的裂解酶,就有可能挖掘筛选到原花青素降解酶。裂解酶是国际酶学委员会(IEC)划分的六大类酶中的一类,在Enzyme Database- BRENDA数据库搜索,发现能够断裂C—C键的酶很多,达上千个。将底物结构类似、来源于原核生物、有文献报告该酶已经被成功重组表达等因素作为进一步筛选的条件,最终筛选到了N-乙酰神经氨酸裂解酶(N-acetylneuraminate lyase, NAL)。NAL能将1分子的N-乙酰神经氨酸降解为两个低分子量的产物[15];同时,N-乙酰神经氨酸与原花青素的结构类似,具有相似的官能团(图1),在六元环结构中都含有一个环氧基团,NAL裂解N-乙酰神经氨酸的位置在环氧基团附近,这与高聚原花青素降解过程中单体之间C—C连接键断裂的原理类似。鉴于上述这些相似性,选择来源于大肠杆菌和金黄色葡萄球菌的N-乙酰神经氨酸裂解酶作为进一步研究原花青素降解的目标酶。
2.2 N-乙酰神经氨酸裂解酶的重组表达
将来源于金黄色葡萄球菌和大肠杆菌的NAL基因分别命名为SananA和EcnanA,它们的基因全序列可以从美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)中检索获得,基因编号分别为NC_007795(SananA)和NC_000913(EcnanA)。据文献报道这两种酶在大肠杆菌中已表达,因此大肠杆菌被选作宿主来表达NAL。图2为重组质粒载体的构建过程,pETDuet- 1、pMAL和pZE分别对应高拷贝质粒、中拷贝质粒和弱启动子质粒,由金黄色葡萄球菌及大肠杆菌的基因组PCR扩增得到SananA和EcnanA基因片段,而后将两种片段分别整合至上述3种不同的质粒中,得到6种重组质粒,通过优化质粒的构建达到高表达可溶性蛋白的目的。
从图3可以看出,SananA和EcnanA在3种不同的质粒中均获得了较高水平的表达,其中SananA和EcnanA在pETDuet- 1质粒中可溶性表达量最大,SananA- pETDuet- 1重组质粒表达出的蛋白量最多。尽管在SananA- pETDuet- 1重组质粒的细胞破碎液沉淀中也存在着大量不溶性的目标蛋白,但是其可溶性蛋白的表达量是最大的。进一步将SananA- pETDuet- 1和EcnanA- pETDuet- 1质粒表达的蛋白进行纯化,图4表明纯化后获得了大量纯度较高的SnNAL(SananA对应的NAL蛋白)和EcNAL(EcnanA对应的NAL蛋白)。
2.3 NAL降解原花青素的性能
2.3.1NAL粗酶液降解原花青素的效果
用2.2节构建的6种重组质粒表达的蛋白制备粗酶液进行原花青素降解试验,尝试使用文献[13]的反应条件,设置温度为50 ℃,pH=8.0,反应1 h,反应过程中进行氮气保护,以避免降解产物被氧化。鉴于低聚原花青素非常不稳定,此处利用含有单体和二体的原花青素(未经处理的粗品)作为酶的底物,以期达到更为有效的筛选酶的目的,利用酶处理前后原花青素单体和二聚体含量的差值(积累量)来评价体系中酶的降解效率。结果如图5所示,与原花青素初始样品相比,1号反应体系有明显的单体和二聚体积累,说明NAL具有降解高聚原花青素的能力;2~6号反应体系无明显的单体和二聚体积累,甚至还有积累量降低的情况。与7号对照组的结果进行对比分析,推测大肠杆菌菌体破碎液中可能含有降解单体和二聚体的成分,导致某些反应体系中单体和二聚体积累量比原花青素初始样品对应物含量还低。为排除大肠杆菌菌体破碎液对酶降解高聚原花青素的影响,选择纯化后SnNAL和EcNAL蛋白进行降解实验,进一步研究NAL对高聚原花青素的降解效果。
2.3.2NAL纯化产物降解高聚原花青素的效果
将SananA- pETDuet- 1和EcnanA- pETDuet- 1质粒表达的蛋白进行纯化(图4),用纯化后的SnNAL酶和EcNAL酶降解高聚原花青素。酶解过程为:配制10 mg/mL的高聚原花青素溶液,加入纯化后酶,在温度50 ℃、pH=8.0条件下反应1 h。
从表4中的结果可以看出,NAL的确能将高聚原花青素降解为单体和二聚体,而且当所用酶含量相同时,SnNAL酶和EcNAL酶降解高聚原花青素产生的单体和二聚体的量无显著差异,这说明这两种酶降解高聚原花青素的能力相似。考虑到金黄色葡萄球菌来源的SnNAL相较于大肠杆菌来源的EcNAL在SananA- pETDuet- 1质粒中可溶性蛋白表达量更多,因此接下来的优化实验选SnNAL作为高聚原花青素的降解酶。
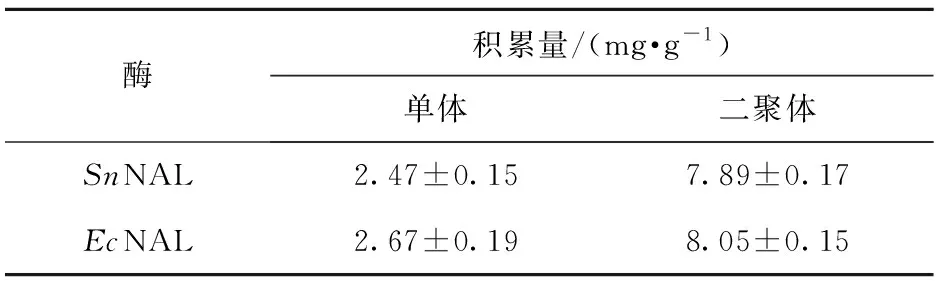
表4 纯化后SnNAL和EcNAL的降解效果Table 4 Degradation results for purified SnNAL and EcNAL
2.4 NAL降解高聚原花青素条件的优化
参照已有的研究[13],将反应温度设定在50 ℃,因为在此温度下原花青素较为稳定且溶解性好,但50 ℃时pH对NAL影响较大。因此之后的实验将pH、反应时间和NAL蛋白浓度对高聚原花青素降解的影响作为优化重点。
2.4.1pH
为研究pH对N-乙酰神经氨酸裂解酶降解原花青素的影响,设置如图6、7所示的pH范围,将含有单体和二聚体的原花青素(未经处理的粗品)作为酶的底物,在质量浓度为50 μg/mL的原花青素溶液中加入NAL,使酶质量浓度为0.17 mg/mL,反应1 h,测定在不同pH下单体和二聚体积累量的变化,同时设置不加酶的反应体系为空白对照,考察pH对原花青素降解产物稳定性的影响。
如图6、7所示,含NAL的体系在实验的pH范围内起初随着pH的升高,单体和二聚体积累量呈现逐渐增加的趋势,当pH达到10时,单体和二聚体积累量达到最大值,但是当pH大于10时,单体和二聚体积累量迅速下降,说明N-乙酰神经氨酸裂解酶的活性在高pH下被抑制,同时单体和二聚体分子稳定性差,在碱性条件下可能被降解为更小的分子。由于在极端pH条件下高聚原花青素不稳定,故将空白缓冲溶液作为对照组。由实验数据可知,对照组除了在pH为4的酸性条件下单体和二聚体有少许积累,以及在pH为11和12条件下单体和二聚体发生了降解外,其他pH下空白溶液对单体和二聚体没有太大影响,最终将pH=10确定为最优条件。
2.4.2反应时间
反应时间的优化范围设置如图8所示。在pH=10,反应温度为50 ℃的条件下,在质量浓度为10 mg/mL的高聚原花青素溶液中加入质量浓度为0.17 mg/mL的NAL进行反应,每隔一段时间取样测定单体和二聚体的含量。结果显示,反应8 h时单体积累量最高,4 h时二聚体积累量达到最高;单体和二聚体的积累量达到最高值后,进一步延长反应时间,积累量则呈现下降趋势。推测出现该现象是单体、二聚体分子不稳定降解的结果,但具体反应机制还需进一步深入研究。综合考虑降解过程中低聚原花青素的积累量,将最优反应时间设为8 h。
2.4.3NAL添加量
选择反应温度50 ℃、反应时间8 h、pH=10的酶解条件,在质量浓度为10 mg/mL的高聚原花青素溶液中添加不同量的酶(表5),测定NAL添加量对酶降解效果的影响。结果表明,在酶添加质量浓度区间为0.09~0.35 mg/mL时,随着酶浓度的提高单体和二聚体的积累量逐渐增加,当添加酶的质量浓度大于0.35 mg/mL时单体和二聚体的积累量增加不明显。因此确定最佳的酶添加质量浓度为0.35 mg/mL,在该浓度条件下可得到35.67 mg/g单体和14.49 mg/g二聚体。

表5 SnNAL蛋白浓度对单体和二聚体积累量的影响Table 5 Effect of SnNAL concentration on the yields of monomers and dimers
3 结论
本文利用生物酶法降低原花青素的聚合度,首先通过基因筛选方法,找到金黄色葡萄球菌来源的SananA和大肠杆菌来源的EcnanA基因用于酶法降解高聚原花青素的研究;然后通过构建6种不同的重组菌株来优化目标蛋白的表达,结果表明,将SananA基因构建到pETDuet- 1质粒,获得的可溶性蛋白表达量最优。随后,纯化SananA- pETDuet- 1表达的NAL酶,并对其降解原花青素的条件进行优化,确定较优的酶解反应条件为:反应温度50 ℃、pH=10、反应时间8 h、酶添加量0.35 mg/mL,在此条件下得到的单体积累量为35.67 mg/g,二聚体积累量为14.49 mg/g。
上述研究结果表明利用生物酶法降解高聚原花青素制备低聚原花青素的思路可行,且具有条件温和、底物特异性强、副产物少等特点。但从实验结果可以看出,本文筛选到的NAL的酶解效率与传统的酸碱水解法相比还有很大差距。因此,未来的研究中可以对已有酶进行定向进化以提高酶解效率,或从基因库中筛选更多的相同底物谱的酶,从而寻找出解聚原花青素效率更高的酶。

