碱处理虫胶涂层的血液相容性和细胞活性研究
任 倩,覃利娜,景凤娟,谢 东,黄 楠,冷永祥
(1. 西南交通大学 材料科学与工程学院,材料先进技术教育部重点实验室,成都 610031;2. 西南交通大学 物理科学与技术学院,成都 610031)
0 引 言
虫胶(Shellac)又称紫胶,是一种热带昆虫紫胶虫分泌的天然树脂。虫胶主要由75%~85%的紫胶树脂、4%~8%的紫胶色素和5%~6%的紫胶蜡组成,除此之外还含有少量的糖类、蛋白质、盐类等杂质[1]。紫胶树脂又分为硬树脂和软树脂,硬树脂由聚酯组成,软树脂则主要是单酯的混合物。虫胶与多种材料均具有较强的结合力,且防水、防潮、防紫外线,可塑性强,没有毒性和刺激性,具有良好的成膜性能和保护性能,因此广泛应用于食品药品领域,如用作食物添加剂、上光被膜剂和肠溶包衣等[2]。虫胶具有良好的生物相容性,研究显示,虫胶并未降低内皮细胞(EC)和平滑肌细胞(SMC)的细胞活性[3]。虫胶具有可降解性能[4]。虫胶涂层在医疗器械表面改性领域也受到关注。虫胶已被应用于药物洗脱血管支架中,通过释放抗增生的西罗莫司或普罗布考药物,减少了血管内膜增生和炎症[5]。研究者[6-7]采用基质辅助脉冲激光蒸发制备出了具有良好附着力的虫胶薄膜。但是虫胶脆性较大,限制了其在一些医疗器械表面改性领域的应用[8]。Sontaya等用氢氧化钠、氢氧化铵等对虫胶进行碱处理,发现处理后的虫胶聚酯链断裂成单酯,最大应力降低、应变增加,使其柔韧性得到了改善[9]。
目前还未见过碱处理后虫胶涂层的成分、结构、结合力、血液相容性和细胞相容性等相关报道。本研究对虫胶进行碱处理后制备涂层,研究了虫胶涂层的成分、结构、与基体的结合力、表面润湿性等,并对碱处理后的虫胶涂层的内皮细胞和平滑肌细胞活性及增殖行为、血小板粘附行为和溶血性能等进行了分析评价,以探究虫胶涂层在心血管材料与器械表面改性方面的可行性。
1 实 验
1.1 涂层制备及材料学表征方法
虫胶碱处理:依据文献[8],采用NaOH溶液对虫胶(Sigma,US)进行碱处理。具体过程如下:将10 g虫胶粉末加入0.5 mol/L的NaOH溶液中,在室温下采用磁力搅拌器搅拌30 min后,将2 mol/L HCl溶液倒入烧杯中进行中和,至碱处理虫胶以沉淀形式完全析出。用大量清水洗净碱处理后的虫胶,于50 ℃电热鼓风干燥箱中干燥24 h。
虫胶涂层制备:前期研究发现TiCu薄膜[10]具有良好的生物相容性和耐久性能,因此本研究在TiCu薄膜表面制备虫胶涂层,以改善器械的血液相容性和抑制内膜增生。其中TiCu薄膜的Cu含量为40%(原子分数), 厚度约为200 nm。制备虫胶涂层时,首先将虫胶粉末溶解于无水乙醇中,制备虫胶溶液(11.24%(质量分数))。然后将表面沉积有TiCu薄膜的硅片置于匀胶机吸片台固定,用移液枪吸取50 μL虫胶溶液滴于样品表面,使匀胶机低速500 r/min运行20 s后,高速3 500 rpm再运行40s。制备好的样品置于50 ℃电热鼓风干燥箱中干燥3~4 h取出,所得样品于室温下保存。
采用表面轮廓仪(AMBIOS XP-2,US)分析虫胶涂层的厚度。采用傅立叶红外光谱(NICOLET 5700,US)对虫胶涂层的表面官能团和结构进行分析。虫胶涂层的测试模式为衰减全反射模式(Attenuated Total Reflection,ATR),测试波长范围500~4 000 cm-1。采用X射线光电子能谱分析(ESCALAB 250Xi,US )对虫胶涂层的化学元素及价态进行分析,XPS设备阳极靶为镁靶,全谱通过能100 eV、步长为1.0 eV,窄谱30 eV、步长为0.05 eV,分析室的真空度为2×10-7Pa。采用场发射扫描电子显微镜 (JSM 7800F JEOL,Japan)分析虫胶涂层的表面形貌。采用接触角测定仪(JY-82)测量涂层的表面接触角。
采用划痕实验和弯曲实验评价虫胶涂层与基体的结合力。划痕实验中,采用多功能材料表面性能试验仪(MFT-2000,US)进行载荷划痕试验,利用一定形状的硬质针状压头以连续增加的正压力刻划涂层,直至涂层失效,通过对失效处及划痕形貌进行分析来评价薄膜和基体的结合力。其中最大载荷为30N,加载速率30 N/min,划痕长度5 mm。弯曲实验中,将虫胶溶液(11.24%质量分数)分别浸涂在镀有TiCu薄膜的316 L不锈钢丝(φ=0.1 mm)表面后,在直径为2 mm的塑料圆棒上进行绕轴弯曲和缠绕,随后采用SEM观测表面形貌以评价虫胶涂层与基体的结合状况。
1.2 内皮细胞和平滑肌细胞活性与增殖行为评价
在虫胶涂层表面分别体外培养内皮细胞和平滑肌细胞,时间为1-3天。采用细胞计数试剂盒CCK-8表征内皮细胞和平滑肌细胞的活性,采用免疫荧光染色评价其细胞形态。活性检测:在样品表面均匀接种细胞,种植密度为(内皮细胞:1×104cells/mL,平滑肌细胞:1×104cells/mL),培养1、3天后将孔板中的培养基吸尽,用生理盐水清洗3次,在避光的条件下加入300 μL 的CCK-8试剂,于孵箱中培养3~4 h。用移液枪吸取200 μL液体于96孔板中,利用酶标仪于450nm处检测其吸光度值。观测:将培养1、3天的细胞培养基吸尽,用生理盐水清洗3次,加入2.5%的戊二醛进行固定后取出用生理盐水清洗3次,在避光条件下加入50 μL罗丹明进行染色,时间为15~20 min。随后用生理盐水清洗3次后将样品吹干,于倒置荧光显微镜下进行观察。
此外,采用涂层的浸提液进行内皮细胞及平滑肌细胞培养,评价其内皮细胞和平滑肌细胞活性和增殖行为。具体方法:将样品置于孔板中,按照表面体积浸提比为1.25 cm2/mL的标准加入培养基,于37 ℃、5%的CO2孵箱中孵育24 h,得到浸提液。将内皮细胞(或平滑肌细胞)接种到24孔板中,种植密度为1×104cells/mL,培养6~8 h后细胞形态正常且贴壁生长后,将培养基吸出加入浸提液进行培养。采用上述的CCK-8方法和免疫荧光染色分别评价其内皮(或平滑肌)细胞活性与形态。
1.3 血小板粘附行为和溶血行为评价
采用血小板粘附和溶血实验评价虫胶涂层的血液相容性[11]。
血小板粘附:将健康人血离心(转速1 500 r/min、时间15 min),得到富含血小板的血浆(Plasma rich in Platelets,PRP)。将50~100 μL 的PRP加入样品表面,使样品表面完全覆盖,于37℃恒温孵箱中孵育30 min后,用生理盐水清洗3次,加入2.5%的戊二醛固定4h。用罗丹明对表面的血小板进行染色,时间为15~20 min。染色后,用生理盐水清洗3次后将样品吹干,于倒置荧光显微镜下对血小板粘附情况进行观察。样品于真空干燥箱中干燥24 h后,采用扫描电子显微镜观察和评价其表面的血小板形貌。
溶血实验:向样品中加入9.8 mL NaCl并置于37 ℃水浴锅中进行预热30 min。于4 mL的全血中加入5 mL的NaCl将新鲜血液进行稀释,混合均匀。取9.8 mL NaCl(0.9%)和RO水分别作为阴性对照和阳性对照。取0.2 mL稀释后的全血分别加入阴性对照、阳性对照和实验组,于37 ℃孵箱中孵育1h。将孵育后的液体加入新的离心管中进行离心(转速3 000 rpm、时间5 min)。取离心后的上清液加入96孔板中(每孔150 μL)。用酶标仪测量其在540 nm波长处的吸光度值。按照公式(1),计算出每个样品的溶血率。

(1)
2 结果与讨论
2.1 碱处理虫胶涂层的厚度、成分结构、表面形貌及表面润湿性等分析
通过表面轮廓仪对涂层的厚度分析后显示,碱处理后虫胶涂层的厚度约为1 122.5 nm。
采用傅里叶变换红外光谱仪(FTIR)检测了碱处理后的虫胶涂层的表面官能团和表面结构。图1(a)的红外图谱显示,3 429 cm-1处为典型羟基-OH的伸缩振动吸收峰; 在2 934 cm-1和2 860 cm-1处有两个尖锐的峰,是甲基或亚甲基的C-H振动峰; 1 716 cm-1处为酸和酯中羰基的伸缩振动吸收峰[12];1 633 cm-1处为壳脑酸与羧基共轭的C=C双键的伸缩振动吸收峰[8];1 465 cm-1为紫胶桐酸中-CH2的变形振动吸收峰[13];1 416 cm-1为羧酸O-H键变形振动吸收峰。未观察到COO-Na在1 540~1 600 cm-1处[14]的特征吸收峰。
采用XPS对碱处理后虫胶涂层的表面化学键合状态进行了分析。图1(b)为虫胶涂层的C1S 图谱,结果显示 284.8 eV处为C-C/C-H的峰,285.7和286.7 eV处的峰分别为C-O-C羟基醚和O-C=O/C-O羰基峰,289.1 eV处的峰为COOH羧基峰。
采用SEM观察了碱处理后的虫胶涂层的表面形貌。图1(c)结果显示涂层表面较为平滑,在较高倍数下可看到虫胶涂层干燥时形成的微裂纹。
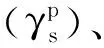
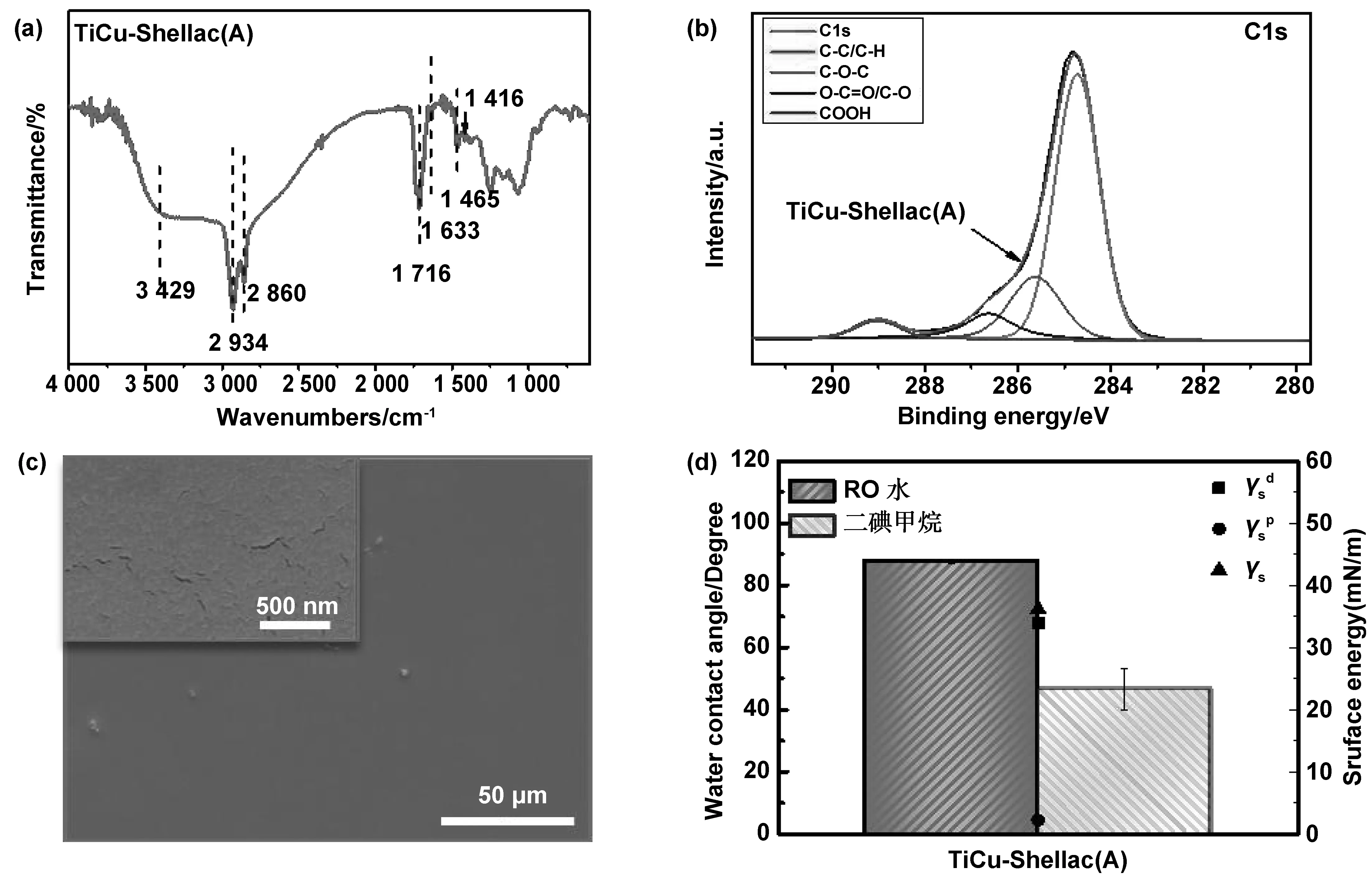
图1 碱处理虫胶涂层的(a)全反射傅立叶红外光谱(ATR-FTIR)图谱;(b)XPS C1s高分辨图谱;(c) SEM观察到的表面形貌;(d)水接触角和极性分量色散分量和表面能(γs)Fig 1 ATR-FTIR spectrum, XPS C1s spectrum, SEM image, and water contact angle and surface energy (γs ) and their polar and dispersive components ) of the alkali-treated shellac coatings
2.2 涂层与基底的结合力
2.2.1 划痕实验
涂层与基底之间的结合力对涂层的质量有着重要影响,韧性好、与基底结合强度高的涂层抵抗界面裂纹产生和扩展能力更强,其服役寿命更长[16]。本文采用划痕实验评价碱处理后涂层的结合力,采用碱处理前的虫胶涂层作为对照样(厚度约为1119.0 nm,与碱处理后接近)。图2的划痕形貌显示,当力加载到碱处理前的虫胶涂层表面时,涂层随即产生褶皱,随着加载力不断增大,至15N左右时(a2),涂层边缘开始发生结合力失效,失效范围逐渐扩大,至30 N力完全加载上去时(a3),涂层发生了大面积的失效,并且末尾有涂层碎屑堆积。而碱处理后的虫胶涂层中,随着加载力不断增大,虫胶涂层的头部、中部和尾部均没有发生边缘涂层失效的情况,说明碱处理提高了虫胶涂层与基体的结合力。虫胶碱处理后软树脂的含量增多,最大应力降低、应变增大、柔韧性增加[9],有利于改善虫胶涂层与基体结合力。
2.2.2 弯曲实验
采用弯曲实验进一步评价虫胶涂层与基体的结合力。弯曲试验是检测涂层抗拉强度、耐冲击性和与基底之间附着力的综合实验[17]。具体方法:将镀有TiCu薄膜的不锈钢丝浸没于碱处理后的虫胶溶液(11.24%(质量分数),溶剂为乙醇)中1 min后取出,在真空干燥箱中干燥24 h,然后在轴棒(φ=2mm)上弯曲,采用SEM对弯曲后的样品表面进行分析。图3的结果显示,所有弯曲后的虫胶涂层均未发生碎裂和脱落现象,显示了较好的结合力。

图2 (a)碱处理前和(b)碱处理后的虫胶涂层的划痕形貌Fig 2 Surface morphology of the untreated shellac coatings and alkali-treated shellac coatings after scratching tests

图3 采用浸涂法在镀有TiCu薄膜的不锈钢丝表面制备虫胶涂层,然后绕轴(φ=2 mm)弯曲后进行观察。(a)采用照相机获得的形貌;(b、c)采用SEM观察到的碱处理后虫胶涂层的表面形貌Fig 3 The alkali-treated shellac coatings were prepared on the surfaces of TiCu- coated stainless steel wires using dip coating method, and then bent around the axis of the plastic stick with diameter of 2 mm: the surface morphology observed by camera and the surface morphologies evaluated by SEM
2.3 涂层的血小板粘附行为和溶血行为
理想的心血管材料与器械涂层应具有良好的血液相容性,对血液成分无损害、不凝血、不溶血、不形成血栓等[18]。目前还未见到虫胶涂层血液相容性的相关研究。本文评价了碱处理后虫胶涂层的体外血小板粘附行为和溶血性能。图4(a)和(b) 的荧光镜显微镜和血小板的统计数量显示,虫胶涂层表面粘附的血小板数量比不锈钢表面明显减少,但与TiCu表面没有明显区别。图4(c)的扫描电子显微镜结果显示,316L SS表面的血小板呈现出有较多伪足的树枝状铺展形态,而在TiCu和TiCu-Shellac(A)表面血小板呈现出无伪足的圆形和仅有部分伪足伸出的树枝状形态。根据血小板粘附过程形态变化分析[19], TiCu薄膜和TiCu-Shellac(A)样品表面的血小板激活程度较低。以上结果显示,碱处理后虫胶涂层TiCu-Shellac(A)具有较好的抑制血小板粘附和激活的能力。

图4 不锈钢(SS)、TiCu 薄膜(TiCu)、碱处理虫胶涂层(TiCu-Shellac(A))样品表面的(a)血小板荧光染色显微镜图像;(b)血小板粘附量统计结果;(c)血小板形态扫描电镜图像Fig 4 The fluorescence staining images, the statistical results and SEM images of adhered platelet number on the surfaces of SS, TiCu and Ticu-shellac (A) samples
溶血实验用来评价材料的体外急性溶血性能。当材料植入人体后与血液接触时,其中的有毒成分将导致红细胞破裂,引起血红蛋白释放,称为溶血现象。溶血还会引起毒性反应和血小板聚集,溶血释放的磷脂将进一步促进血栓的形成[20]。测试材料与血液接触过程中血红蛋白的释放量,可以测得材料的溶血率,按照医学标准规定的要求,当材料溶血率小于5%时,认为材料符合植入条件。图5(a)为样品与血液接触1h后,将孵育后的液体离心得到的红细胞沉淀情况。阳性对照RO水离心后试管中溶液呈红色,管底无红细胞残留,为完全溶血状态。阴性对照样品NaCl离心后,上清液无色澄明,红细胞全部沉淀,为不溶血状态。SS、TiCu、TiCu-Shellac(A)与阴性对照样品离心后的状态接近,上清液澄明且有红细胞沉淀。通过测量上清液中血红蛋白含量,得到各样品的溶血率,如图5(b)所示,SS、TiCu、TiCu-Shellac(A)的溶血率分别为0.12%、0.79%、0.53%,均低于5%。研究结果表明SS、TiCu 和TiCu-Shellac(A)涂层具有较低的溶血率,符合安全条件。

图5 阳性对照(RO)、阴性对照(NaCl)、不锈钢(SS)、TiCu 薄膜(TiCu)和碱处理虫胶涂层(TiCu-Shellac(A))样品与血液接触1h后,将孵育后的液体离心,(a)离心后试管中的液体形貌;(b)检测上清液后获得不同样品的溶血率Fig 5 The samples were incubated in blood at 37℃for 1 h, and then the incubated solution were centrifugated at 3000 rpm for 5 min and the supernatants were used for the determination of the hemolysis rate: the erythrocytes precipitation in the tube after centrifugation, and the hemolysis rate for the samples of negative control RO water, positive control NaCl and the samples of SS, TiCu, and TiCu-shellac (A)
2.4 涂层的平滑肌细胞活性与增殖行为
平滑肌细胞过度增殖和迁移会导致血管内膜增生,从而导致心血管器械如血管支架内再狭窄和植入失败,也会增加静脉血栓滤器的取出难度[21-22]。因此,这些材料与器械表面应具有抑制平滑肌细胞的活性与增殖的能力。本文通过CCK-8试剂盒评价了虫胶涂层对平滑肌细胞活性和增殖的影响。图6(a)是在样品表面培养平滑肌细胞1天和3天后平滑肌细胞的CCK-8活性结果。结果显示,培养1天时虫胶涂层样品TiCu-Shellac(A)与316L SS相比,平滑肌细胞活性受到抑制。至3天时,虫胶涂层样品TiCu-Shellac(A)表面的平滑肌细胞活性受到显著抑制,且与1天相比平滑肌细胞活性几乎无增长,说明其平滑肌细胞增殖受到了明显的抑制。图6(b)是所有样品表面荧光染色后的结果,结果显示,在316L SS 和TiCu薄膜表面,平滑肌细胞形态正常,均为长梭形。在虫胶涂层TiCu-Shellac(A)样品表面,未发现明显的平滑肌细胞。说明虫胶涂层TiCu-Shellac(A)能够明显抑制平滑肌细胞的活性和增殖。

图6 平滑肌细胞在不锈钢(SS)、TiCu 薄膜(TiCu)、碱处理虫胶涂层(TiCu-Shellac(A))、无细胞的空白组(Blank control)的样品表面培养1天和3天后,其细胞活性检测结果(a)和荧光染色显微图像(b);平滑肌细胞在不锈钢(SS)、TiCu 薄膜(TiCu)、碱处理虫胶涂层(TiCu-Shellac(A))、无材料的空白组(Medium)的浸提液(100%、50%)中培养1天后,其细胞活性检测结果(c)和荧光染色显微图像(d)(* P<0.05, ** P<0.01,***P<0.001)Fig 6 Viability and fluorescence staining microscopic images of SMCs cultured on the surfaces of SS, TiCu, TiCu-shellac(A) samples and cell-free medium(blank control)for 1 and 3 days. Viability and fluorescence staining microscopic images of SMCs cultured in the leaching solution with varied concentration (100%, 50%) for the SS, TiCu, TiCu-shellac(A) samples and material-free medium (medium) for 1 day. (*p<0.05, **p<0.01, ***p<0.001)
为了分析虫胶涂层的浸提液对平滑肌细胞活性和增殖行为的影响,取各样品在培养基中浸泡1天后获得浸提液(100%),将其稀释一半后获得50%的浸提液。对这两种浸提液分别进行平滑肌细胞体外静态培养。图6(c)和(d)分别是浸提液(100%、50%)中的平滑肌细胞活性和荧光染色的形貌。由图6(c)可见,经过1天的培养后,与SS和TiCu样品相比较,TiCu-Shellac(A)样品的两种浸提液(100%、50%)的平滑肌细胞活性均明显被抑制,但是50%浸提液的平滑肌细胞活性比100%浸提液有明显提高。图6(d)的平滑肌细胞形貌显示在SS和TiCu浸提液的样品表面为长梭形,但虫胶涂层的两种浸提液中的细胞未见明显铺展状态,表明细胞有所损伤。涂层表面和浸提液的细胞培养结果表明,虫胶涂层通过培养过程中发生降解进入浸提液,抑制了平滑肌细胞的活性和增殖,但是当浸提液浓度下降后其抑制程度有所减弱。
2.5 涂层的内皮细胞活性与增殖行为
植入心血管器械如血管支架表面的内皮细胞化可以降低再狭窄的风险[23]。但对于一些心血管器械如静脉血栓滤器来说,内皮细胞过度生长将使静脉滤器支撑杆与腔静脉内膜粘连,增加了滤器取出的难度[24,25],因此要降低其内皮化程度。图7 (a)和(b)是在样品表面培养内皮细胞1天和3天后内皮细胞活性和相关的荧光染色后的表面形貌。从图7(a)可以看出,在培养1天后虫胶涂层样品TiCu-Shellac(A)与SS相比,呈现出较好的内皮细胞活性。但是培养至第3天时,TiCu-Shellac(A)样品的内皮细胞活性受到明显抑制,并且与1天相比内皮细胞活性无明显增加,未显示细胞增殖行为。图7(b)显示在培养1天后的样品表面呈现正常内皮细胞的椭圆形和铺路石状,但在培养3天后的表面未观察到明显的内皮细胞。
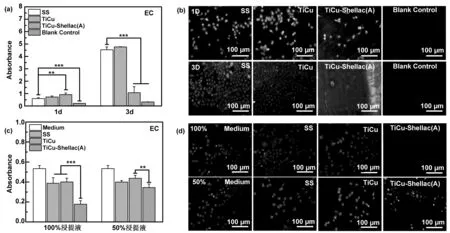
图7 内皮细胞在不锈钢(SS)、TiCu 薄膜(TiCu)、碱处理虫胶涂层(TiCu-Shellac(A))样品、无细胞的空白组(Blank control)表面培养1天和3天后,其内皮细胞活性检测结果(a)和荧光染色显微图像(b);内皮细胞在不锈钢(SS)、TiCu 薄膜(TiCu)、碱处理虫胶涂层(TiCu-Shellac(A)) 、无材料的空白组(Medium)的浸提液(100%、50%)中培养1天后,其细胞活性检测结果(c)和荧光染色显微图像(d)(*P<0.05, **P<0.01,***P< 0.001)Fig 7 Viability and fluorescence staining microscopic images of ECs cultured on the surfaces of SS, TiCu and TiCu-shellac samples, and cell-free medium(blank control)for 1 and 3 days. Viability and fluorescence staining microscopic images of ECs cultured in the leaching solution with varied concentration (100%, 50%) for the SS, TiCu, TiCu-shellac(A) samples and material-free medium (medium) for 1 day. (*p<0.05, **p<0.01, ***p<0.001)
同样,为了分析虫胶涂层的浸提液对内皮细胞活性和增殖行为的影响,分别在浓度为100%和50%的浸提液中培养1天,评价涂层浸提液的内皮细胞活性。图7(c)和(d)分别是浸提液(100%、50%)中的内皮细胞活性和荧光染色的形貌。图7(c)的CCK-8结果显示,虫胶涂层样品TiCu-Shellac(A)与SS相比,内皮细胞活性受到明显抑制,在将浸提液的浓度降低了一半后,内皮细胞活性明显增加。由图7(d)的浸提液的形貌也显示出同样的结果。因此,虫胶涂层通过降解在浸提液中抑制了内皮细胞活性,但通过降低虫胶降解浸提产物的浓度能够一定程度上提高内皮细胞活性。
本研究中的碱处理虫胶涂层能够明显抑制平滑肌细胞和内皮细胞的活性,不溶血,能够在一定程度抑制血小板的粘附和激活,有望借鉴并应用在心血管器械如静脉血栓滤器等表面改性领域。下一步将通过控制虫胶涂层的结构和厚度等,改变其降解浸提液的浓度,研究其对细胞行为的影响。
3 结 论
研究采用旋涂方法成功制备出碱处理的虫胶涂层并对其成分、结构、结合力和生物相容性等进行了评价。结果显示,该涂层为亲水性涂层,表面较为平滑。与未碱处理的虫胶涂层相比较,碱处理虫胶涂层与基体的结合力明显改善。与不锈钢相比较,虫胶涂层可以明显抑制血小板的粘附与激活。虫胶涂层溶血率小于5%。相对于不锈钢和TiCu薄膜,碱处理后的虫胶涂层能够明细抑制平滑肌细胞和内皮细胞活性和增殖,有望借鉴并应用在与血液接触的器械如静脉血栓滤器等表面改性领域。

