NLR 联合MLR 对乙型肝炎病毒相关慢加急性肝衰竭患者人工肝治疗短期预后的预测价值*
黄振华,何关,许丽霞,岳周倩,余静,王韦
(广西壮族自治区民族医院 血液净化科,广西 南宁 530001)
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是指在慢性肝病基础上发生的短期内出现急性肝功能失代偿的一种综合征。ACLF 患者具有非常高的短期病死率,据文献报道在肝移植之前ACLF的病死率高达30% ~70%[1]。 在中国乙型肝炎病毒(hepatitis B virus, HBV) 感染是引起ACLF 的主要原因[2]。大量临床研究证明,人工肝治疗可以降低乙型肝炎病毒相关慢加急性肝衰竭(hepatitis B virus related acute-on-chronic liver failure, HBV-ACLF)患者的病死率并改善这些患者的临床预后[3-4]。然而,目前如何预测HBV-ACLF 患者人工肝治疗的短期病死率仍存在一定的困难。近年来研究发现,过度的全身炎症反应与ACLF 的疾病进展和临床预后密切相关[5-6]。研究表明,肝细胞坏死引起大量炎症因子释放,激活了体内的免疫反应,导致大量的粒细胞从骨髓迁移到外周血中,淋巴细胞的数量明显下降[7-8]。新近研究发现,中性粒细胞- 淋巴细胞比例(neutrophil-lymphocyte ratio, NLR)和单核细胞- 淋巴细胞比例(monocyte-lymphocyte ratio, MLR)与HBV-ACLF 的恶化及未进行人工肝治疗的HBV-ACLF 患者的短期死亡的风险密切相关[9-10]。然而,NLR 联合MLR 能否在临床上用于预测HBV-ACLF 患者人工肝治疗的预后目前仍未清楚。因此,本研究的目的是探讨NLR 联合MLR 预测HBV-ACLF 患者人工肝治疗短期预后的价值。
1 资料与方法
1.1 一般资料
回顾性分析2016 年1 月—2019 年6 月广西壮族自治区民族医院住院并第一次行人工肝治疗的HBVACLF 患者81 例。其诊断标准符合2012 年版《肝衰竭诊疗指南》[11]。排除标准:感染人类免疫缺陷病毒,感染甲、丙、丁、戊型肝炎病毒或酒精性肝病,自身免疫性肝炎,药物相关性肝炎,肝癌,及有活动性感染(如肺炎、腹膜炎、尿路感染等)的患者。记录所有患者入院时性别、年龄、血压、有无肝硬化、有无腹水、有无上消化道出血、有无肝性脑病[12]、有无肝肾综合征。电话随访至入院后90 d,记录第90 天所有患者的生存情况。将HBV-ACLF 患者81 例作为人工肝治疗组,根据患者入院后90 d 是否生存,又将患者分为生存组63 例和死亡组18 例,同期选取健康体检者40 例作为对照组。
1.2 治疗方法
1.2.1 常规内科治疗患者入院后给予常规内科基础治疗,包括补充能量、抗病毒治疗(拉米夫定、恩替卡韦或联合阿德福韦酯抗病毒治疗)、护肝治疗(静滴甘草酸二铵、促肝细胞生长素等)、治疗并发症(肝性脑病、肝肾综合征、电解质紊乱等)。
1.2.2 人工肝血浆置换治疗所有入组患者在常规内科治疗的基础上均接受人工肝血浆置换治疗。采用右股静脉穿刺径路,血浆置换术使用TQS-88 血液净化机器(日本东丽株式会社)及P2 血浆过滤器(江苏费森尤斯医药成品有限公司)。采用单针双腔导管通过右侧股静脉置管建立体外循环。常规使用普通肝素抗凝,并根据剂量个体化原则。血流速度为(100±20)ml/min,每次血浆置换液量为同型冰冻血浆2500 ~3000ml。每周进行2 或3 次血浆置换治疗。停止人工肝治疗的指征:患者临床症状得到明显改善,无恶心呕吐症状,无肝性脑病表现;肝功能得到明显改善,血清总胆红素(TBIL)<140µmol/L,INR<1.6 或凝血酶原活动度(PTA)>40%。
1.3 观察指标及计算方法
观察所有入组患者入院当天的血常规、肝肾功能、凝血常规、血氨、甲胎蛋白(AFP)、乙型肝炎病毒DNA(HBV-DNA)、C 反应蛋白(CRP),并进行终末期肝病模型(MELD) 评分[13]:MELD 评分=9.57×ln 肌 酐(mg/dl)+3.78×ln 胆 红 素(mg/dl)+11.20×ln INR+6.43。NLR 计算方法 :NLR= 中性粒细胞(N)/ 淋巴细胞(L)×100%。MLR 计算方法:MLR= 单核细胞(N)/ 淋巴细胞(L)×100%。
1.4 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数± 标准差(±s)表示,比较用t检验;计数资料以构成比或例(%)表示,比较用χ2检验;绘制ROC 曲线,影响因素的分析采用多因素Logistic 回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 对照组与人工肝治疗组人口学资料及临床检测指标的比较
两组性别构成比、年龄比较,差异无统计学意义(P>0.05);两组TBIL、ALT、AST、INR、PTA、CRP、NLR 和MLR 比较,差异有统计学意义(P<0.05)。见表1。
2.2 经人工肝治疗的生存组和死亡组人口学资料及临床指标的比较
经人工肝治疗的生存组和死亡组入院时性别构成比、年龄、ALT、AST、AFP、HBV-DNA、血氨、血红蛋白及合并肝硬化、腹水、上消化道出血、肝性脑病(分级≥2)和肝肾综合征发生率比较,差异无统计学意义(P>0.05)。两组患者的TBIL、肌酐、INR、PTA、MELD 评分、NLR、MLR 及CRP 比较,差异有统计学意义(P<0.05),死亡组的TBIL、肌酐、INR、MELD 评分、NLR、MLR、CRP 高于生存组,PTA 低于生存组(P<0.05)。见表2。
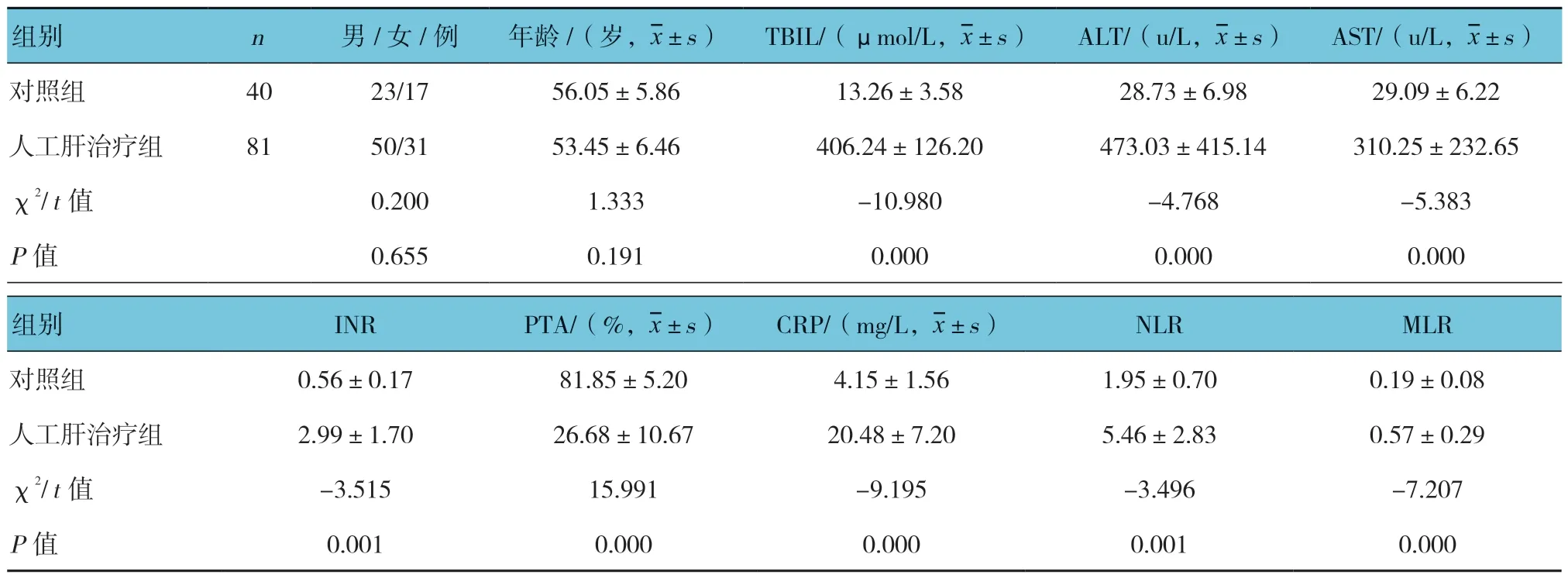
表1 对照组与人工肝治疗组人口学资料及临床检测指标的比较

表2 生存组与死亡组入院时人口学资料及临床指标的比较

续表2
2.3 HBV-ACLF 患者人工肝治疗短期预后的多因素Logistic 回归分析
对HBV-ACLF 患者人工肝治疗90 d 短期预后的影响因素进行多因素Logistic 回归分析,将TBIL、肌酐、INR、PTA、MELD 评 分、NLR、MLR 和CRP 8个指标引入多因素Logistic 回归模型。结果显示: 预测HBV-ACLF 患者人工肝治疗90 d 短期预后的危险因素为NLR [O^R=3.719(95% CI :3.525,3.942)] 和MLR [O^R=2.335(95% CI :2.161,2.596)], 而PTA[O^R=0.729(95% CI :0.550,0.967)] 为 预 测HBVACLF 患者人工肝治疗90 d 短期预后的保护因素。见表3。

表3 人工干治疗效果影响因素的多因素Logistic 回归分析参数
2.4 PTA、NLR、MLR 及NLR 联合MLR 对短期预后的预测效果
PTA 诊断人工肝治疗的HBV-ACLF 患者短期预后的AUC 为0.475(95% CI :0.373,0.577),最佳截断值为34.00,其敏感性为73.0%(95% CI :0.683,0.778), 特 异 性 为68.0%(95%CI :0.631,0.726);NLR 诊断HBV-ACLF 患者人工肝治疗短期预后的AUC 为0.870(95% CI :0.811,0.930),最佳截断值为4.88,其敏感性为80.0%(95% CI :0.775,0.842),特异性为80.0%(95% CI :0.769,0.838);MLR 诊断HBV-ACLF 患者人工肝治疗短期预后的AUC 为0.787(95% CI :0.709,0.865),最佳截断值为0.53,其敏感性为53.0%(95% CI :0.481,0.576),特异性为85.0%(95% CI :0.806,0.898)。NLR 和MLR 两者联合诊断HBV-ACLF 患者人工肝治疗短期预后的AUC 最高,为0.921(95% CI :0.876,0.966),其敏感性为76.0%(95% CI :0.723,0.806),特异性为92.0%(95% CI :0.882,0.957)。见图1。

图1 ROC 曲线
3 讨论
HBV-ACLF 是一种病情进展迅速、短期病死率极高的临床综合征。因此,早期准确判断该疾病的预后可为实施及时有效的治疗和改善患者预后提供指导依据。目前临床上常用于评估HBV-ACLF 预后的模型有MELD 及其相关衍生评分(MELD-Na、iMELD)、Child-Turcotte-Pugh 评分(CTP)、慢性肝衰竭联盟-序贯器官衰竭评分(CLIF-SOFA)等,这些预后评分模型已被研究证实对ACLF 的预后有一定的预测价值[14-16]。但这些评分模型存在计算复杂、准确性欠佳等一系列问题,并且这些评分模型是建立在以酒精性肝病和慢性丙型肝炎为主的西方人群基础上的,而我国HBV-ACLF 的病因主要是HBV 感染,这些评分模型在中国人群中的预测评估价值仍不明确[17]。因此,仍需进一步寻找评估HBV-ACLF 患者预后的更好的方法。
本研究结果表明,外周血的系统性炎症指标——NLR和MLR均是预测HBV-ACLF患者人工肝治疗90 d短期预后的危险因素,其测定值越高,患者死亡风险越高;PTA 为预测HBV-ACLF 患者人工肝治疗90 d短期预后的保护因素,其测定值越高,患者死亡风险就越低。PTA 和系统性炎症指标(NLR、MLR)与人工肝治疗的HBV-ACLF 患者的短期预后密切相关。
HBV 感染人体后引起ACLF 的发病机制与病毒在肝细胞内复制激活,中性粒细胞、单核细胞等免疫细胞在肝脏内浸润导致免疫损伤和炎症破坏,同时使大量炎症因子释放入血,包括白细胞介素-6 与白细胞介素-17、肿瘤坏死因子-α 等促炎症因子,其中白细胞介素-17 是中性粒细胞的趋化因子,可以促进大量中性粒细胞从肝血窦和骨髓中释放入外周血,从而引起外周血中性粒细胞的绝对值增加[18-19]。外周血的中性粒细胞增多是反映损伤或感染引起急性骨髓细胞生成的直接征象。而在本研究中,由于排除所有活动性感染(肺炎、腹膜炎、尿路感染等)的患者在外,即排除了感染对NLR 值的影响。本研究中人工肝治疗组的NLR 值明显高于对照组,且人工肝治疗死亡组的NLR 值明显高于人工肝治疗生存组,考虑NLR 值的升高是由于HBV-ACLF 患者肝脏内存在大量损伤和坏死的肝细胞,释放大量损伤相关模式分子,如HMGB-1 并诱发无菌性炎症,从而引起HBVACLF 患者体内的急性骨髓细胞生成和大量中性粒细胞释放到外周血中[20]。中性粒细胞和淋巴细胞是组成人体免疫系统2 种主要的细胞成分。中性粒细胞通过释放一系列的炎症因子(白细胞介素-1 和白细胞介素-8)和大量颗粒包含酶(如髓过氧化物酶、蛋白酶和胶原酶)引起肝脏组织的炎症和氧化应激损伤以及细胞结构的破坏降解[21]。淋巴细胞在疾病进展过程中引起的系统性炎症反应起到调节作用。研究表明,HBV-ACLF 疾病进展过程中引起的系统性炎症导致了外周血中淋巴细胞的耗竭[10]。外周血中性粒细胞的增多和淋巴细胞数量的减少引起人工肝治疗组患者NLR 值的升高。已有大量的研究表明,NLR 不仅是预测HBV-ACLF 患者,也是预测失代偿性肝硬化及肝癌患者病情恶化和死亡风险的独立危险因素,这可能与增长的NLR 值反映了肝脏损伤后继发的急性系统性炎症的严重程度有关[10,23]。
本研究中人工肝治疗组的MLR 值明显高于对照组,且人工肝治疗死亡组的MLR 值明显高于人工肝治疗生存组,考虑与HBV-ACLF 患者外周血中单核细胞数量增加和淋巴数量减少有关。炎症反应可以促进骨髓中的单核细胞释放到外周血中并分化为组织巨噬细胞[24]。在脂肪性肝炎和病毒性肝炎等病理条件下,骨髓来源的单核细胞可以分化为肝巨噬细胞(即Kupffer 细胞)并清除前炎症状态下的细胞碎片和病原体并促进受损肝组织的修复。Kupffer 细胞不仅可以源源不断地由外周血单核细胞补充,而且通过释放白细胞介素-1、白细胞介素-6、白细胞介素-8、肿瘤坏死因子α 等前炎症因子使体内炎症反应持续存在[25]。过度的炎症反应可以促进单核细胞从骨髓释放到外周血中并浸润到存在炎症的肝脏中,由此形成一个恶性循环。外周的免疫系统的紊乱与肝脏的衰竭和患者死亡密切相关。因此,本研究中,MLR 成为预测HBV-ACLF 患者人工肝治疗90 d 短期预后的危险因素,可能与其反映人工肝治疗的HBV-ACLF 患者持续进展的炎症反应有关。另外,CRP 也是反应系统性炎症严重程度的指标之一。本研究发现,虽然人工肝治疗死亡组血浆的CRP 水平明显高于生存组,但是多因素分析结果表明,CRP 并不是HBV-ACLF 患者人工肝治疗90 d 短期预后的独立影响因素,与既往研究结果相一致[26]。这可能与本研究排除存在细菌感染的患者,而CRP 对预测ACLF 患者是否存在细菌感染具有较高的诊断价值,而对预测仅存在无菌性炎症的ACLF 患者的预后缺乏敏感性和特异性有关[27]。另外,本研究结果发现,人工肝治疗生存组的PTA 明显高于死亡组,而且PTA 为预测HBV-ACLF 患者人工肝治疗短期预后的保护因素,这与既往文献报道相一致[28]。
根据ROC 曲线对HBV-ACLF 患者人工肝治疗90 d 短期预后的预测分析表明,单独PTA 的AUC 为0.475,与CHEN 等[28]报道的相近。单独NLR 的AUC值为0.870,与另一研究[29]AUC 为0.820 非常接近。单独的MLR 的AUC 值为0.787,与既往文献报道结果非常接近[30]。NLR 单独预测HBV-ACLF 患者人工肝治疗90 d 短期预后的AUC 为0.870,敏感性为80.0%,特异性为80.0%;而MLR 单独预测HBV-ACLF 患者人工肝治疗90 d 短期预后的AUC 为0.787,敏感性为53.0%,特异性为85.0%。NLR 联合MLR 预测HBV-ACLF 患者人工肝治疗90 d 短期预后的AUC 为0.921,大于单独NLR 或MLR 的AUC 值,且敏感性为76.0%,特异性为92.0%,提示NLR 联合MLR 可提高预测准确度。
综上所述,本研究结果表明,NLR 联合MLR 对HBV-ACLF 患者人工肝治疗短期预后具有更好的预测价值。而且,NLR 和MLR 值通过血常规检测结果计算即可得到,临床可操作性和重复性强,具有一定临床应用价值。但因本研究的样本量较小,随访时间短,尚需扩大研究样本量进一步探讨HBV-ACLF 患者人工肝治疗短期及长期预后的更有效的评估模型,从而提高对HBV-ACLF 患者人工肝治疗预后的预测判断能力。

