急性淋巴细胞白血病患儿MTHFR C677T基因多态性与大剂量甲氨蝶呤治疗后肝功能异常的相关性
刘林娜,李涛,葛寒宇,陈占国,余坚,郑晓群
(温州医科大学附属第二医院育英儿童医院 医学检验中心,浙江 温州 325027)
急性淋巴细胞白血病(acute lymphoblastic leukaemia,ALL)是来源于B/T系淋巴细胞的恶性肿瘤,细胞分化异常而停滞于早期阶段,导致发热、贫血、中性粒细胞减少、血小板减少等临床表现及实验室检查异常,尤其当异常增殖的肿瘤细胞浸润髓外组织时可致中枢神经系统白血病或睾丸白血病等[1]。甲氨蝶呤(methotrexate,MTX)属于抗叶酸类的抗肿瘤药,通过竞争性抑制细胞内二氢叶酸还原酶的活性,从而抑制肿瘤细胞的异常增殖[2]。大剂量甲氨蝶呤(high-dose methotrexate,HD-MTX)可通过血脑和血睾屏障,是ALL患儿巩固治疗阶段的主要化疗药物,对预后有十分重要的意义,但HD-MTX诱导的不良反应常常导致化疗的中断[3]。亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase,MTHFR)基因位于染色体1p36.3,编码叶酸代谢通路中的限速酶,使5,10-亚甲基四氢叶酸转化为具有生物学活性的5-甲基四氢叶酸,也是MTX发挥药理作用的关键酶之一[4]。C677T是目前国内外研究较多的位点之一,突变后胸腺嘧啶(T)替代了第677位碱基胞嘧啶(C),使编码的丙氨酸变成了缬氨酸,而使酶活性发生变化,并且已有研究报道该变化与多种疾病相关,其中包括对ALL化疗的不良反应[5], 但此结论尚存争议。因此,本研究将探讨ALL患儿MTHFR C677T基因多态性与HD-MTX治疗后肝功能异常的相关性,以及对肝功能各指标和功能的影响,为患者的个体化用药提供可靠的参考依据。
1 资料和方法
1.1 一般资料 收集2017年10月至2020年3月就诊于温州医科大学附属第二医院育英儿童医院儿童血液科ALL患儿66例,年龄1~12岁,诊断标准按照《儿童急性淋巴细胞白血病诊疗建议》(第四次修订)[6],入选标准:①按照细胞形态学-免疫学-细胞遗传学-分子生物学(Morphology-Immunology-Cytogenetics-Molecular biology,MICM)诊断与分型标准;②骨髓形态学:原始及幼稚淋巴细胞≥20%,若不足20%必须经分子诊断确定存在ALL致病基因,如ETV6-RUNX1。所有患者经VDLD方案诱导化疗、CAM或CAML方案早期强化治疗后休疗2周左右[6],在使用HD-MTX前均无明显骨髓抑制、胃肠道反应、口腔黏膜损害及肝肾功能异常等。本研究经温州医科大学附属第二医院育英儿童医院伦理委员会审批,征得患儿父母或其法定监护人的知情同意并签署知情同意书。
1.2 仪器与试剂 advia2400 全自动生化分析仪(德国西门子公司),ABI7500实时荧光定量PCR仪(美国应用生物系统公司),安捷伦1290高效液相系统和6420系列三重四极串联质谱仪(美国Agilent公司),ZORBAX Eclipse Plus C18 column色谱柱(美国Agilent公司)。前白蛋白(prealbumin,PA)测定试剂盒(上海复星长征医学科学有限公司),谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)、乳酸脱氢酶(lactate dehydrogenase,LDH)、谷氨酰转移酶(γ-glutamyl transpeptidase,GGT)、总胆红素(total bilirubin,TBIL)以及胆碱酯酶(cholinesterase,CHE)测定试剂盒(德国西门子公司),人MTHFR基因检测试剂盒(武汉友芝友医疗科技股份有限公司),MTX标准品(纯度>98%,美国Sigma-Aldrich公司),甲醇、乙腈(色谱纯,德国Merck Millipore公司),甲酸(色谱纯,美国Sigma-Aldrich公司)。
1.3 方法
1.3.1 HD-MTX化疗方案:所有ALL患儿1/6总量(不超过0.5 g)在1 h内静脉滴注,剩余部分匀速滴注维持23 h,每10~14天1次,共4次。HD-MTX用药后36 h四氢叶酸钙解救,并根据MTX血药浓度予以调整。6-巯基嘌呤50 mg/(m2·d),每疗程不超过7 d,根据白细胞数调整剂量。并给予腰椎穿刺+鞘内注射、水化碱化、速尿利尿及血药浓度监测。
1.3.2 实验室检查:采用实时荧光定量PCR-探针法检测MTHFR C677T基因多态性;根据《儿童急性淋巴细胞白血病诊疗规范(2018年版)》[7]于患儿静脉滴注HD-MTX后48 h抽取静脉血,分别检测血常规、肝肾功能,并采用高效液相色谱法检测HD-MTX血药浓度,此后每24 h检测1次,直至血药浓度≤0.25 μmol/L。
1.3.3 不良反应评价:ALL患儿HD-MTX治疗后不良反应评价标准参照WHO抗癌药物不良反应表现与分级标准,在HD-MTX使用后48 h开始监测血常规、ALT、血尿素氮(blood urea nitrogen,BUN)、是否恶心呕吐以及口腔黏膜损伤情况等,每位患者的每种不良反应仅记录1次。
1.4 统计学处理方法 采用SPSS24.0 软件进行统计学分析,采用logistic回归模型分析MTHFR C677T基因型与HD-MTX各不良反应的关系,2组间计量资料的比较采用独立样本t检验或者秩和检验,2组间计数资料的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 ALL患儿临床特征 将MTHFR C677T基因CC型归为野生型,共34例,CT+TT型归为突变型,共32例,2组患儿的年龄、性别、免疫分型、核型、融合基因和危险分层差异均无统计学意义(P>0.05)。见表1。
2.2 MTHFR C677T基因分型结果及Hardy-Weinbery平衡检验 FQ-PCR基因分型结果如图1所示,66例患儿中野生型(CC)34例,占51.5%,杂合突变型(CT)25例,占37.9%,纯合突变型(TT)仅7例,占10.6%。对MTHFR C677T进行Hardy-Weinbery平衡检验后P=0.46(P>0.05),证明该基因型频率符合Hardy-Weinbery 定律,即本研究样本对于总体有一定的代表性。
2.3 MTHFR C677T不同基因型与HD-MTX不良反应的关系 为了校正剂量因素对不良反应发生率的影响,采用logistic回归分析,以MTHFR C677T不同基因型为自变量,不良反应发生率为因变量进行统计分析,结果显示:野生型与突变型相比较,骨髓抑制、口腔黏膜损害和胃肠道反应发生率差异无统计学意义(P>0.05),而肝功能异常发生率差异有统计学意义(P<0.05),突变型发生肝功能异常的风险更高,见表2。
2.4 MTHFR C677T不同基因型与肝功能各指标的关系 与野生型相比,突变型血清ALT、AST、CHE含量异常的患儿比例显著升高(P<0.05),而其他肝功能指标PA、TP、ALB、LDH、GGT以及TBIL差异无统计学意义(P>0.05),见表3。野生型和突变型ALT或AST异常患儿的AST/ALT比值分别为0.89±0.45和0.71±0.30,差异无统计学意义(P>0.05)。
2.5 MTHFR C677T不同基因型患儿HD-MTX血药浓度的差异 为进一步探讨不同基因型患儿肝功能异常发生率不同的原因,分别比较不同基因型患儿滴注HD-MTX后48 h、72 h血药浓度的差异,结果显示突变型患儿48 h、72 h血药浓度均高于野生型患儿 (P<0.05)。见图2。

表1 66例ALL患儿临床特征
图1 MTHFR C677TFQ-PCR基因分型结果
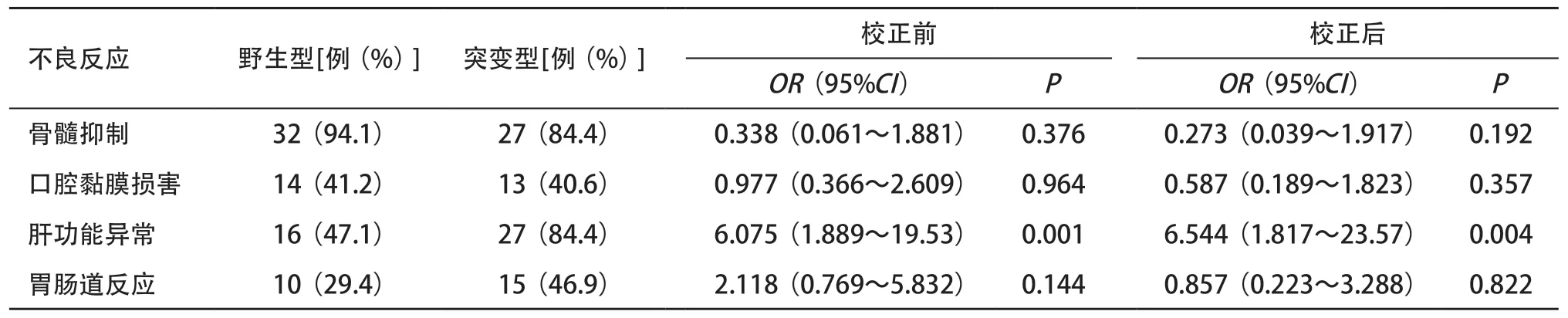
表2 MTHFR C677T不同基因型和HD-MTX不良反应的关系

表3 MTHFR C677T不同基因型与肝功能各指标的关系(例)

图2 MTHFR C677T不同基因型患儿滴注HD-MTX 48 h、72 h血药浓度的比较
3 讨论
HD-MTX常用于ALL患儿化疗的巩固治疗阶段,但由于其选择性较差,部分患儿在使用期间会发生不同程度的肝功能异常,发生率和严重程度均存在明显的个体差异,无法用传统的药代动力学和药效学解释[8]。研究发现,药物反应会受不同的遗传背景影响,其中单核苷酸多态性(single nucleotide polymorphism,SNP)是药物基因组学中影响药物反应的主要原因[9]。迄今为止,研究与药物反应和毒性相关的遗传变异仍然是癌症化疗中的巨大挑战。近年来,国内外众多学者对MTHFR C677T基因多态性与HD-MTX治疗后肝功能异常的相关性进行分析,但对具体肝功能各指标和功能的影响研究甚少。
由于本研究纳入的纯合突变型(TT)病例数较少,仅7例,且经过统计发现CT型和TT型各毒副反应发生率以及肝功能各指标的差异无统计学意义,因此根据显现模型将CC型作为野生型,CT+TT型作为突变型,通过校正剂量因素的影响后,发现突变型发生肝功能异常的风险更高,与HAGLEITNER等[10]的Meta分析结果一致,说明T等位基因会增加HDMTX治疗后的肝毒性,可能机制为突变后MTHFR热稳定性和活性较野生型均有所降低,导致催化5,10-亚甲基四氢叶酸还原为5-甲基四氢叶酸的功能障碍,间接引起体内甲基化水平降低、MTX代谢减慢,进而导致发生肝功能异常的风险升高。进一步分析不同基因型与肝功能各指标的关系发现,突变型较野生型血清ALT、AST、CHE含量异常的患儿比例显著升高,其他相关指标差异无统计学意义,说明不同基因型患儿肝实质损害发生率有差异,而肝脏合成功能、储备功能、胆红素代谢功能差异无统计学意义。针对ALT或AST异常的患儿,突变型与野生型患儿AST/ALT比值差异无统计学意义,且均值都小于1,表明HD-MTX虽对肝细胞有损害,但对肝细胞线粒体损伤较轻,使得存在细胞质内的ALT大量释放入血,ALT升高程度大于AST。本研究发现突变型患儿48 h、72 h血药浓度均显著高于野生型,与XU 等[11]的研究结论一致。究其原因可能为突变后MTHFR酶活性降低,导致血药代谢、叶酸代谢以及细胞修复减慢。因此,针对突变患儿应避免HD-MTX与其他有肝损的药物同用,且在用药前后应检查肝功能,对异常者需及时积极治疗。
相关研究认为,埃及、亚洲人群中MTHFR C677T基因多态性与肝脏毒性的风险增加相关[12],而另一项研究证实在土耳其和欧洲人群中结论则完全相反[13],说明该基因多态性在不同人种中的表现存在差异。有研究报道,除HD-MTX诱导的肝功能异常,MTHFR C677T多态性可能对ALL易感性、预后等存在影响,JUSTER-SWITLYK等[14]观察到MTHFR C677T多态性与MTX引起的脊髓病相关,而ROY等[15]也发现MTHFR C677T突变的儿童叶酸缺乏现象更常见以及在诱导治疗期间更易发生败血症引起的死亡。综上分析,MTHFR C677T在疾病发生发展中的作用依然有待深入研究和探讨。除MTHFR C677T位点,MTHFR A1298C、TPMT A719G以及TPMT G460A与HD-MTX血药浓度、各不良反应的相关性研究较多,然而各学者研究结论不一[16],总体而言,尚不能成为预测HDMTX治疗时肝功能异常的良好指标。
综上所述,MTHFR C677T基因分型有望成为ALL患儿HD-MTX治疗时降低肝毒性和改善治疗结果的有效检测手段。然而本次研究来自单中心,病例数有限,且单个SNP可提供的信息量较少,需扩大病例数在更多人群中进行验证,以期为ALL患儿提供更有价值的个体化用药指导。

