一种改良的去细胞皮瓣制备方法
冯雨露,周乐斌,2,薛向阳,梅劲,3
(1.温州医科大学 基础医学院 解剖教研室,浙江 温州 325035;2.乐清市人民医院 急诊科,浙江 温州 325600;3.宁波市第一医院 科研中心,浙江 宁波 315000)
随着基于以肝、心、肺、肾和神经[1-5]等重要器官的去细胞器官为支架在体外重建获得阶段性进展,去细胞皮瓣也逐渐吸引修复重建外科领域 研究者们的注意[6]。然而,皮瓣为不均质组织,常规去细胞的过程存在耗时长、流程复杂、条件苛刻等缺点,仅在制备阶段就遇到了比实质器官更大的挑战。本研究的目的是建立一个简便可靠的去细胞方法来制备更具灵活性及临床适用性的去细胞皮瓣。
1 材料和方法
1.1 去细胞皮瓣支架的制备 本研究尝试了一种制作去细胞皮瓣的新方案,利用磁力搅拌器产生的不均匀力场来对冲非均质的皮瓣组织,以尽量保持皮瓣各组织层的完整性。取健康成年SD大鼠[温州医科大学实验动物中心,许可证号:SYXK(浙)2019-0009;雌雄各10只,体质量300~320 g],5%水合氯醛麻醉,沿腹正中线从下至上切开,对称向背侧剪开,保留3 cm×4 cm大小的皮瓣(图1A方框处示意为取材部位),暴露股动静脉。进行股动脉置管(24号留置针),结扎小动脉分支并剪开股静脉后,注射0.05%的肝素生理盐水约20 mL,至肉眼观察到小血管变白。取下去血后的皮瓣,四角束缚于平皿中,表皮层朝向磁珠。平皿内含有0.05%肝素钠生理盐水,开启磁力搅拌器低档旋转。然后依次灌注并震荡0.05%肝素钠溶液0.5 h,1% Triton 1~2 h,0.08% SDS 10~12 h,去离子水12 h。
1.2 去细胞皮瓣支架检测
1.2.1 HE及DAPI染色:将皮瓣用OCT包埋后,切成7 μm厚的冰冻切片。0.02% PBS冲洗3次,每次 5 min。分别进行HE、DAPI染色后显微镜下观察组织内结构和残留细胞情况。
1.2.2 DNA总量的测量:将对照组皮瓣与去细胞皮瓣真空冷冻干燥24 h后,称重,剪碎,按每0.1 g 组织添加1 mL DNA裂解液(100 mmol/L pH 8.0 Tris-HCl、25 mmol/L pH 8.0 EDTA、500 mmol/L NaCl、1% SDS)及2 μL的蛋白酶K,55 ℃水浴过夜。12 000×g室温离心10 min,取上清液加入等体积异丙醇混匀,冰浴10 min。再次离心,弃上清液, 42 ℃烘箱烘干后用加30 μL双蒸水溶解DNA沉淀,于微量紫外分光光度计上测定吸光度,并结合重量换算DNA总含量。
1.2.3 残留十二烷基硫酸钠(SDS)的测量:SDS和亚甲基蓝在酸性条件下产生蓝色化合物。用二氯甲烷萃取蓝色化合物后,通过比色法测定SDS含量。用蛋白酶K消化组织后,将上清液加到亚甲蓝溶液(每100 mL亚甲基蓝水溶液含250 mg亚甲基蓝,50 g 无水硫酸钠和10 mL浓硫酸)中,将混合物充分混合并用二氯甲烷萃取,弃去上层溶液。向每个试管中加入无水硫酸钠,混合并离心。吸出试管中的澄清溶液,在651 nm的波长下测量吸光度。通过测量具有已知SDS浓度的8种溶液的吸光度产生SDS对照标准曲线,并计算结果。
1.2.4 扫描电镜检查:对照组及去细胞组皮瓣,分别切成1.0 mm3大小的组织块,4 ℃ 2.5%戊二醛固定过夜,经PBS冲洗,锇酸处理后固定,醋酸铀染色后丙酮梯度脱水,环氧树脂包埋剂浸透,包埋,制作超薄切片,扫描电镜下观察。
1.2.5 血管造影:根据文献[7]进行操作。
1.3 皮下植入实验
1.3.1 动物分组:共计32只2月龄SD大鼠(体质量约250 g),其中雌性16只,雄性16只。用5%水合氯醛麻醉后,固定,背部备皮,75%乙醇消毒,于脊背中线切开皮肤全层至深筋膜,打开四个间距约1 cm的小孔,分离皮下组织,制备皮下囊。对照组(16只大鼠,雌雄各半)皮下包埋4块未去细胞皮瓣;实验组(16只大鼠,雌雄各半)皮下包埋4块去细胞皮瓣,所用皮瓣约1 cm×1 cm,包埋前将皮瓣于0.1%青链霉素抗生素浸泡24 h。术后给足粮食和水,不提供任何抗生素治疗,定时观察切口有无红肿、感染。术后第1和第2周,实验组和对照组分别随机取8只大鼠中的移植物(雌雄各半)进行新生血管数目统计。
1.3.2 移植物血管计数:取术后第1周和第2周的移植物,制备厚度为10 μm的冠状面冰冻切片并进行HE染色于光学显微镜下观察。平均新生血管数目统计结果来自每张切片的10个高倍镜(100倍放大)视野。
1.3.3 外周血淋巴细胞比例:术后第1、第3、第7和第14天,从大鼠尾静脉采集外周血样品,样品在4 ℃下用肝素钠抗凝血保存。血液样品用红细胞裂解缓冲液(R1010,北京索莱宝科技有限公司)并按照说明书处理后,将0.5 μL一抗(CD25-PEcy7,25-8484-80,CD4-FITC,11-0040-82,北京eBioscience公司)加入每个细胞管中。每管细胞在4 ℃下避光孵育1 h后,用PBS洗涤细胞3次,重悬细胞后使用BD FACSCanto II检测。使用Flow Jo 6.0软件进行数据分析。
1.4 统计学处理方法 采用SPSS17.0 统计软件和Microsoft Excel进行统计学分析。计量资料用±s表示,2 组间比较用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 去细胞皮瓣支架大体观察 制备完成的去细胞皮瓣具有白色不透明的外观,见图1B;腹主动脉血管造影显示血管形态完整,分支清晰可见,见图1C;扫描电镜显示较连续的蛋白纤维,见图1D。
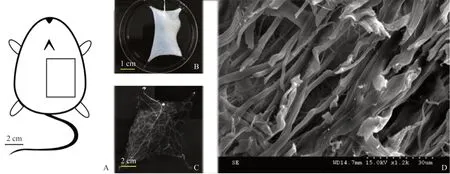
图1 获取的去细胞皮瓣表征
2.2 基因组DNA含量检测 组织基因组DNA(gDNA)含量显示实验组DNA的总量比对照组显著减少95%以上,差异有统计学意义(P<0.05),见图2。

图2 DNA定量检测结果

图3 收获的去细胞皮瓣核染色结果

图4 SDS在651 nm处吸光度的标准曲线
2.3 组织学观察 DAPI核染色观察不到明显的细胞核,HE染色仅可见红色的细胞外基质,见图3。
2.4 残留SDS的检测 根据该标准曲线换算得,去细胞皮瓣中残余SDS约(28±4)mg/g,远处于生物安全水平(133.3 mg/g[4])之下,见图4。
2.5 再生血管计数 包埋术后第1 周,实验组支架材料与周围组织界限清楚,包埋支架内部见少量炎性细胞浸润,包埋支架边缘可见少量新生血管长入;包埋术后第2周,支架组织内部见大量新生血管,无明显炎性细胞浸润。第1周和第2周,实验组新生血管数明显多于对照组,差异有统计学意义(P<0.05),且炎症反应明显小于对照组。见图5。
2.6 外周血中调节性T淋巴细胞的比例 术后第1天2组动物的调节性T淋巴细胞较标准对照均大幅下降;但实验组在第3、第7和第14天调节性T淋巴细胞群比例均高于对照组(P<0.05)。提示实验组大鼠整体的免疫排斥反应比对照组弱。见图6。
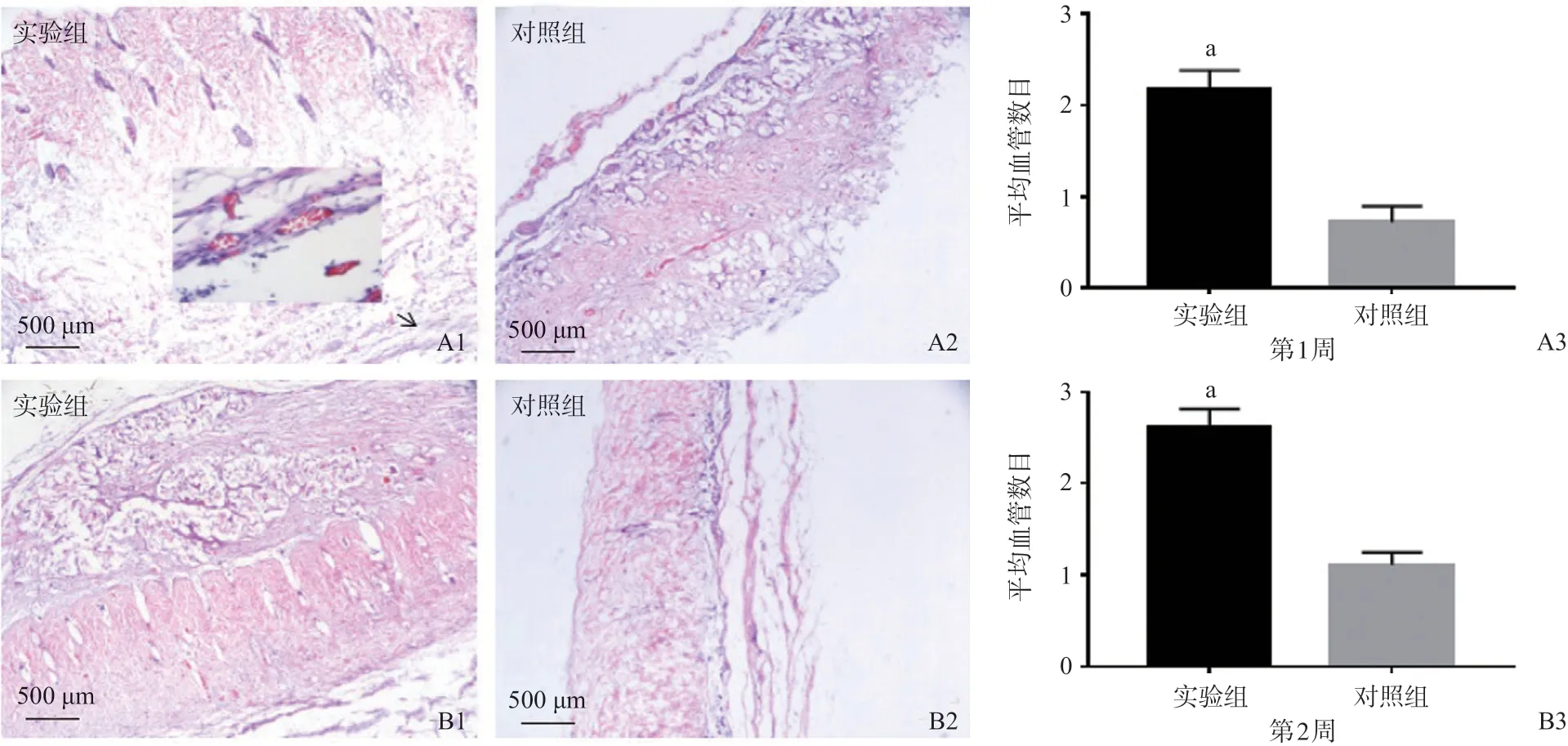
图5 2组血管再生结果

图6 去细胞皮瓣移植后外周血调节性T淋巴细胞比例变化
3 讨论
与合成材料相比,去细胞支架不仅保留了较完整的原组织3D结构,还能保存大部分的胶原蛋白、黏连蛋白及纤连蛋白等,能够调控细胞生长分化的细胞外基质成分[8],本课题组此前报道证明,去细胞肾脏支架能有效促进肾脏的再生[4]。
随着去细胞材料的广泛应用,去细胞支架的制备方法也逐渐形成体系,包括灌注法和振荡法[9-10]。 结合我们过去的尝试以及对已发表文献实验结果的分析,我们发现单纯使用灌注法进行皮瓣组织的去细胞难以获得理想结果,原因可能是皮瓣属于非均质组织,真皮部位疏松而表皮组织致密导致单纯使用振荡法进行去细胞很困难。因此我们对原有方法进行改进,使用磁力搅拌器进行辅助震荡。方案改进后,皮瓣的表皮层可以受到垂直方向和水平方向的两种力量,而同时真皮层只接受水平方向的一种力量,所以新方案可以在不影响去细胞速度的同时有效地去除皮肤和脂肪组织中的细胞和油脂成分。
通过该方法制备完成的去细胞皮瓣仅具有微量核碎片,不影响支架发挥其优秀的生物材料性质。血管造影术证实,去细胞皮瓣维持着主要的血管蒂和微循环网络。这些结果表明,皮肤和脂肪组织ECM的天然3D结构和生化特性不仅在去细胞支架中得到了很好的维护,还能为细胞播种和组织工程提供地图线索。
在动物实验结果中,我们发现实验组外周血调节性T淋巴细胞比例增高。结合文献报道,移植术后该群细胞比例增高程度与宿主对移植物的排斥程度成反比关系[3],所以使用该方法制备完成的去细胞皮瓣能产生低排斥的免疫环境。
使用磁力搅拌器辅助法制备的去细胞皮瓣,不仅能较完全地去除细胞核,还能保留完整的血管网络。另外,皮下包埋结果证实该支架排斥反应低,生物相容性好,且能促进血管再生。本方法有助于为类似不均质组织的去细胞支架制备提供参考。

