镉耐性固定细菌的筛选及其对不同品种小麦镉吸收的阻控效应
孙乐妮,郭迎雪,侯雪婷,庄杰,杨章泽,陈兆进,田伟
(1.安徽农业大学生命科学学院,合肥230036;2.南阳师范学院农业工程学院,河南 南阳473061;3.生态环境部南京环境科学研究所,南京210042)
由于化肥、农药的大量施用,工业废水污染、矿山开采以及重金属大气沉降增加,我国土壤重金属污染日趋严重[1]。据2014年《全国土壤污染状况调查公报》显示,我国土壤污染以镉(Cd)污染为主,Cd点位超标率高达7.0%[2]。土壤中的Cd不仅破坏农田生态系统,还会积累于植物体内,威胁粮食和食品安全,最终严重危害人体健康。在我国人均耕地资源有限的情况下,可实现“边生产边修复”的重金属污染土壤原位钝化修复技术已成为适合我国大面积中低污染土壤修复的最理想技术[3]。一些天然矿物材料、金属及金属氧化物、磷酸盐类等人工材料在原位钝化土壤重金属中起到一定效果[4]。但继续探寻能改善土壤生态环境、环境友好的新型生物类钝化剂,对于修复重金属污染土壤、保障农产品安全生产具有重要意义。
重金属固定细菌是一类可通过吸附、富集、沉淀、氧化还原等多种机制降低土壤中重金属的生物有效性,减少其在土壤中迁移的微生物[5-6]。某些根际细菌细胞壁含有的羧基、羟基、氨基、磷酸基团等官能团能与金属离子配位络合,这有利于吸附重金属阳离子,降低土壤中重金属的迁移和转化[7-9]。关于重金属吸附固定微生物的筛选及其固定重金属、阻控作物吸收的研究已逐渐引起关注[10-13],在盆栽条件下应用重金属固定微生物阻控辣椒[12]、水稻[13]、芥菜[14]、青菜[15]等对重金属的吸收研究已见报道,但仍需继续加强对重金属吸附固定微生物的筛选,用来阻控多种植物吸收积累重金属,以实现在中低污染土壤中安全生产农作物。
小麦是我国三大粮食作物之一,许多研究表明,Cd极易在小麦中积累,对小麦生长产生毒害作用,并使籽粒中Cd含量超标[16-18]。重金属胁迫下接种细菌对小麦耐受重金属、吸收重金属能力的研究已备受关注[19-21]。此外,Wang等[22]还发现接菌Ralstonia eutrophaQ2-8和Exiguobacterium aurantiacumQ3-11在Cd、As复合污染土壤中能够降低小麦籽粒Cd含量12%~32%和As含量9%~29%。韩辉等[23]筛选出的重金属固定细菌巨大芽孢杆菌N3和液质沙雷氏菌H12,在水培条件下能显著降低小麦根和地上部Cd、Pb含量。但目前关于重金属固定细菌在土壤环境下阻控小麦籽粒吸收Cd的研究还甚少,此外缺少不同小麦品种和不同污染程度对细菌阻控小麦吸收重金属效果的研究。因此,本研究从农田根际土壤分离筛选Cd固定细菌,探究菌株在不同污染环境下阻控两种低积累型小麦Cd转运及吸收积累Cd的效应,为利用重金属污染农田安全生产小麦提供重要菌种资源和技术途径。
1 材料与方法
1.1 试验材料
根际土壤样品采自安徽省合肥市肥东县电镀工业园附近农田(31°49′47.17″N,117°23′54.60″E)的玉米根际土壤,将采集的土壤样品装入无菌袋中,于4℃冰箱保存,并在24 h内用于Cd抗性细菌的分离。
小麦品种为文献报道的Cd低积累型小麦品种扬麦158(红麦)和西农979(白麦)[24-25],购自安徽春泽种业有限公司。
盆栽供试土壤为安徽省合肥市安徽农业大学农萃园区土壤,基本理化性质为:速效钾0.23 mg·kg-1,有效磷38.86 mg·kg-1,铵态氮10.30 mg·kg-1,水溶态Cd 0.02 mg·kg-1,总Cd 0.28 mg·kg-1。
LB培养基(g·L-1):蛋白胨10.0 g,酵母粉5.0 g,琼脂20.0 g,NaCl 10.0 g,pH 7.0,121℃高压灭菌25 min。固体培养基需加2.0%的琼脂后灭菌。
1.2 Cd耐性固定细菌菌株的分离筛选
称取10 g土壤样品,无菌操作下于已灭菌的100 mL生理盐水三角瓶中制备成土壤悬液,150 r·min-1、28℃摇床振荡2 h后,将土壤悬液稀释成10-1、10-2、10-3、10-4不同浓度。吸取100µL土壤悬液涂布在含100 mg·L-1Cd2+(CdCl2·2.5H2O)的LB固体培养基上,28℃培养3 d,挑取单菌落划线接种到LB平板上,直至获得纯菌株。菌株用40%甘油保存于-20℃冰箱中备用。
将分离菌株接种于LB培养液(pH 7.2)培养至对数期后,按5%接种量接入含50 mg·L-1Cd2+的LB培养基,28℃摇床150 r·min-1培养3 d[10]。同时设置不接菌处理作为对照,每个处理3次重复。收集样品于8 000 r·min-1离心10 min,上清液过0.22µm滤膜后,测定溶液残余Cd2+浓度。Cd2+去除率(R):

式中:C0为未接菌处理上清液Cd2+浓度,mg·L-1;Ce为接菌处理上清液Cd2+浓度,mg·L-1。
将菌株划线接种到含不同浓度Cd2+(100、175、200、225、300 mg·L-1)的固体培养基上,28℃培养3~5 d,观察菌株能否生长,以判断菌株对Cd2+的耐受性。
1.3 菌株鉴定
参照《生工细菌基因组DNA快速抽提试剂盒》方法提取细菌总DNA。采用细菌通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-TACGGCTACCTTGTTACGACTT-3′PCR扩增细菌16S rDNA片段。PCR体系及扩增方法参考Sun等[26]方法进行。PCR扩增产物经上海生工生物工程有限公司测序,用Genbank数据库中的模式菌株16SrDNA序列进行相似性比对分析,并用软件Clustal X和MEGA6.0构建系统发育树。
1.4 细菌YM4对Cd的吸附及其重金属分布
将分离菌株接种于LB培养液(pH 7.0)中培养至对数期后,按5%接种量接入含不同浓度Cd2+(Cd2+终浓度为50、75、100 mg·L-1)的LB培养基中,28℃摇床150 r·min-1培养3 d。同时设置不接菌处理作为对照组,每个处理3次重复。细胞体内积累和表面吸附的重金属含量参照文献[27-28]方法进行。将菌液转移到50 mL离心管中,10 000 r·min-1离心10 min取上清。向离心的菌体样品中加入2.5 mL 0.5 mol·L-1的EDTA洗脱液,混匀后,10 000 r·min-1离心10 min取上清,反复用EDTA洗涤菌体细胞3次,合并的上清液中Cd2+即为菌体胞外吸附。将菌体重悬浮在稀HNO3和0.1%TritonX-100中,95℃水浴2 h,待细胞裂解完全,溶液变澄清后,12 000 r·min-1离心10 min取上清,上清液中Cd2+即为菌体胞内富集。洗脱样品与消解液用去离子水定容后用原子吸收分光光度仪测定Cd2+含量。每个处理设置3次重复。
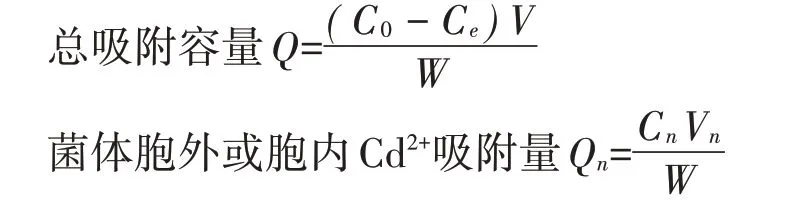
式中:C0为未接菌处理上清液Cd2+浓度,mg·L-1;Ce为接菌处理上清液Cd2+浓度,mg·L-1;V为离心培养液的体积,L;W为离心菌体的干质量,g;Cn为EDTA洗脱液或消解液中Cd2+浓度,mg·L-1;Vn为EDTA洗脱液或消解液体积,L。
1.5 傅里叶红外光谱分析
将LB培养基中培养至对数期的菌液,分别以5%接种量接入含不同浓度Cd2+(0、50、75、100 mg·L-1,分别记作Cd0、Cd50、Cd75和Cd100)的LB培养基,28℃、150 r·min-1摇床培养3 d后,离心收集菌体。将不同处理的菌体进行真空冷冻干燥,以1∶99的质量比与干燥的KBr混合研磨,利用磨具将其压成薄片,用傅里叶红外光谱分析仪进行检测,并参考Huang等[9]和林晓燕等[29]的方法分析菌体吸附Cd2+过程中参与的细胞表面官能团。
1.6 YM4对小麦各组织Cd吸收与转运的影响
将供试盆栽土壤自然风干,过筛,混合均匀后按每盆4.5 kg分装于盆钵中。参考《土壤环境质量农用地土壤污染风险管控标准(试行)》(GB 15618—2018),外源添加Cd2+(CdCl2·2.5H2O)分别设置0、0.3、0.6 mg·kg-13个水平(记作Cd0、Cd0.3、Cd0.6),土壤陈化1个月。将培养至对数期的菌体细胞离心收集,洗涤2次后重悬于生理盐水中制备成1×108CFU·mL-1菌悬液。挑选颗粒饱满、催芽效果一致的露白种子置于菌悬液中浸种2 h后,每盆种植4粒,且将5 mL菌悬液滴加到每盆种子上。以浸种生理盐水及接种生理盐水作为对照处理。小麦生长至返青期时每盆再接种5 mL菌悬液,浇灌于小麦根部土壤。所有处理均设置3次重复。定期对盆栽小麦施加等量水肥,保持水分含量至田间持水量的70%左右,于次年成熟期收获。小麦生长时间为10月下旬至次年5月中旬。
将小麦从盆中整株取出,根、茎叶、麦穗分别采集,用去离子水将根部冲洗干净。麦穗脱壳后,麦粒自然晒干至恒质量,根、茎叶和壳烘干至恒质量。将干燥的根、茎叶、麦壳和麦粒分别用粉碎机粉碎,经HNO3∶HClO4(优级纯,V∶V=87∶13)混合酸液浸泡,XT-9916微波消解仪消解后,用原子吸收仪测定Cd含量。根据样品质量换算出小麦各组织Cd含量。
Cd富集系数、转移系数计算方法如下:
富集系数(BF)=各组织Cd含量(mg·kg-1)/土壤Cd含量(mg·kg-1)
转移系数(TF)=地上部各组织Cd含量(mg·kg-1)/根部Cd含量(mg·kg-1)
1.7 数据处理
实验数据均用Excel 2007、SPSS17.0进行处理和分析。采用SPSS17.0进行单因素方差分析(ANOVA)和Duncan法进行多重比较分析(P<0.05)。
2 结果与分析
2.1 Cd耐性固定细菌菌株筛选及鉴定
采用稀释涂布平板法于Cd抗性平板中共筛选出Cd抗性菌株8株,其对Cd的吸附能力见图1。8株菌对Cd的去除能力不同,去除率在17.6%~58.9%。这些细菌对Cd的去除可能涉及到络合反应、物理吸附或胞内扩散等。菌株YM4具有最强的Cd去除能力,去除率达58.9%,耐Cd2+浓度达到225 mg·L-1。YM4菌落外观呈圆形,边缘光滑,淡黄色。对16SrDNA序列进行PCR扩增,获得1 405 bp的扩增产物,测序结果提交至GenBank,登录号为MK355633。经序列比对,选取13株模式菌株序列采用N-J(Neighbor-Joining)法构建系统发育树。由图2可知,YM4与假单胞菌属(Pseudomonas)细菌相似性较高,其中与Pseudomonasprotegens同源性高达99.8%。因此,可确定菌株YM4为假单胞菌(Pseudomonassp.)。

图1菌株在溶液中对Cd的去除效果Figure 1 The removal effect of Cd by strains in solution
2.2 细菌YM4对Cd的生物积累能力及其重金属分布
以未接菌处理作为对照,研究细菌YM4在生长过程中对Cd的生物积累能力。由图3可知,在50、75、100 mg·L-1Cd2+浓度下,YM4的总吸附量分别为9.03、14.10、26.48 mg·g-1,胞外吸附量分别为6.93、10.46、20.82 mg·g-1,占总吸附量的74.22%~78.63%。胞内积累量相对较少,仅占总吸附量的21.37%~25.78%。随着初始重金属浓度的增加,YM4总吸附量、胞外吸附量都会显著升高,而胞内积累量也会有一定增多。YM4对Cd的去除依靠胞外吸附和胞内积累的共同作用,但以胞外吸附为主,这可能是细菌主要将Cd吸附在细胞表面,阻止或减少其向细胞内的吸收转运,是细菌自身保护的一种解毒机制。

图3不同Cd2+浓度下YM4对Cd2+的生物积累能力Figure 3 Bioaccumulation capacity of Cd2+by YM4 at different concentrations of Cd2+

图2基于菌株YM4 16SrRNA基因序列构建的系统发育树Figure 2 Phylogenetic tree of strain YM4 based on 16SrRNA gene sequences
2.3 吸附Cd2+前后YM4的傅里叶红外光谱分析
采用傅里叶红外光谱分析细菌YM4吸附Cd2+前后细胞表面官能团变化(图4)。YM4在吸附Cd2+后主要有多个位置吸收峰发生偏移,其中在多个Cd2+浓度处理下,代表缔合羟基(─OH)或─NH的吸收带由3 407.60 cm-1向高波长处(3 409.53 cm-1)偏移;代表烷基中的─CH吸收峰由2 925.48 cm-1向低频偏移;代表羧基、酰胺I带C═O伸缩振动的吸收峰向高波数1 654.62 cm-1偏移;代表—NH伸缩的吸收峰由1 544.70 cm-1向1 540.85 cm-1偏移;代表磷酸基团的吸收峰由1 081.87 cm-1向高位发生偏移。此外,代表醚类C─O─C伸缩和─M─O或O─M─O(M为金属离子)和P─H键的吸收带也发生不同程度上的偏移。因此,我们推测YM4细胞表面的─OH、─NH、─CH、C═O、羧基及磷酸基团、─M─O等是吸附Cd的主要功能位点。
2.4 YM4对小麦Cd含量的影响
通过盆栽试验研究接菌YM4对红麦、白麦两个小麦品种根、茎叶、麦壳以及籽粒Cd含量的影响。由图5可知,在Cd0和Cd0.3处理下,接菌YM4使两种小麦茎叶、麦壳、籽粒Cd含量均显著下降(P<0.05),其中,红麦Cd含量降幅分别为16.48%~17.79%、14.24%~35.52%、26.79%~62.24%,白麦Cd含量降幅分 别 为20.00%~46.05%、24.44%~42.22%、26.33%~28.99%;在Cd0.6处理下,与对照组相比,接菌YM4均显著降低小麦植株各部位对Cd的吸收(P<0.05),接菌处理使根、茎叶、麦壳、籽粒的Cd含量分别显著降低20.26%、11.31%、10.12%、45.31%(红 麦)和21.28%、32.04%、34.50%、25.27%(白麦)。特别注意的是,接菌YM4能使白麦和红麦中Cd超标处理的籽粒Cd含量低于或接近《食品安全国家标准食品中污染物限量》(GB 2762—2017)规定的Cd限量标准(0.1 mg·kg-1)。由此可见,与未接菌对照相比,接菌YM4可显著降低两种小麦地上部Cd含量,推测可能是接种YM4能影响Cd从小麦地下向地上部的转运。
由图5可知,随着土壤中Cd浓度的增加,两种小麦对Cd的积累呈递增趋势。在不接菌处理组,Cd0.3和Cd0.6处理组根、茎叶、麦壳和籽粒中Cd浓度均比Cd0处理显著增多(P<0.05),其中Cd0.6处理组比Cd0处理组分别增加90.97%、95.15%、56.67%、75.06%(白麦)和95.65%、82.63%、63.37%、115.40%(红麦)。在接菌处理组,Cd0.3和Cd0.6处理组根、茎叶和麦壳Cd浓度均比Cd0处理显著增多(P<0.05),Cd 0.6处理组白麦和红麦籽粒Cd浓度比Cd0处理分别显著增加78.39%和61.23%(P<0.05)。
两种小麦体内Cd含量因品种差异有所不同。根部是富集积累Cd的主要部位,白麦根部Cd积累量大于红麦,且在Cd0.6处理时达显著差异,说明在较高浓度Cd污染下,白麦根部更易吸收积累Cd。在不接菌和接菌处理组,红麦茎叶和籽粒Cd含量均显著高于白麦,其中红麦籽粒Cd含量比白麦增加45.85%~187.28%,表明红麦可能对Cd具有更强的向地上部转运的能力。接菌处理使红麦籽粒Cd含量较对照下降26.79%~62.24%,下降幅度远高于白麦(25.27%~28.99%)。因此,为了保障小麦的安全生产,在无钝化剂施用情况下,红麦(扬麦158)更适合种植于无污染土壤。

图4 YM4吸收Cd2+前后的红外光谱图Figure 4 FTIRspectrumof YM4 before and after adsorption of Cd2+

图5 YM4对小麦根部、茎叶、麦壳和籽粒中Cd含量的影响Figure 5 Effects of YM4 on Cd content in roots,straws,hulls and grains
综上所述,接菌YM4可显著降低白麦和红麦地上部Cd含量,使红麦籽粒Cd含量下降幅度大于白麦,但红麦籽粒Cd积累能力仍高于白麦。在农用地土壤污染风险筛选值(0.6 mg·kg-1)以下,接种YM4对阻控白麦和红麦吸收Cd,保障小麦安全生产具有潜在应用价值。但高于污染筛选值时,YM4则不适用于红麦。接种功能微生物和选择适宜低积累型品种,是较高污染土壤原位修复的重要措施。
2.5 YM4对小麦Cd富集系数与转移系数的影响
通过表1可知,小麦根、麦壳、茎叶部Cd富集系数分别随着外源添加Cd2+浓度的增加而显著降低,而小麦各部位Cd转移系数没有呈现规律性变化。小麦根部Cd富集系数最高,其次为茎叶,籽粒或麦壳富集系数较低。在未接菌对照组中比较两种小麦,发现白麦茎叶、籽粒Cd富集系数分别比红麦显著降低8.00%~15.91%和37.14%~64.71%(P<0.05)。白麦茎叶、麦壳、籽粒中Cd转移系数分别比红麦显著降低12.33%~18.57%、14.73%~31.25%和41.74%~66.97%(P<0.05),表明白麦对Cd的富集及转运能力小于红麦,属于低积累型品种。接种YM4后,在3种不同浓度Cd2+处理下,接菌处理均能显著降低两种小麦茎叶、籽粒和麦壳富集系数(P<0.05),以及降低白麦茎叶、籽粒和麦壳Cd转移系数和红麦籽粒Cd转移系数(P<0.05),且在0、0.3 mg·kg-1Cd2+处理时,接菌处理也显著降低红麦茎叶和麦壳转移系数(P<0.05)。总之,白麦籽粒对Cd的富集、转运能力低于红麦,接菌处理能降低籽粒对Cd的富集、转运能力。

表1 YM4对土壤-小麦体系中Cd富集系数与转移系数的影响Table 1 Effects of YM4 on Cd bioaccumulation factor and transfer factor in soil-wheat system
3 讨论
原位钝化修复技术是适合重金属中低污染土壤的理想修复技术。新兴的微生物钝化修复材料已引起广大研究者的关注。目前已发现的能吸附固定重金属的微生物主要有芽孢杆菌属(Bacillus)[12]、无色杆菌属(Achromobacter)、假单胞菌属(Pseudomonas)[10]、沙雷氏菌属(Serratia)[23]、肠杆菌属(Enterobacter)[30]、寡养单胞菌属(Stenotrophomonas)[31]。这些微生物能够在高浓度的重金属环境中生存,并通过吸附、沉淀、吸收等多种方式固定重金属,对重金属污染土壤的修复起重要作用。一些微生物可以通过细胞表面的阴离子基团或胞外分泌物来吸附固定重金属[7,9-10,30]。张旭辉等[10]分离到的一株Pseudomonassp.ZXH23在含Cd2+50 mg·L-1LB培养基中对Cd的去除率为33.7%。Xu等[30]研究发现,Enterobacter cloacaeTU在Cd浓度大于20 mg·L-1时,对Cd的去除方式以胞外吸附为主,且随Cd浓度增加,胞外吸附量逐渐增加,但胞内积累量几乎不变。Huang等[32]研究发现,Bacillus cereusRC-1在重金属浓度大于20 mg·L-1时,去除方式也以胞外吸附为主,但除胞外吸附量外,胞内积累量也随Zn、Pb和Cd浓度增加有一定的增加。本研究筛选到的菌株Pseudomonassp.YM4在含Cd 50 mg·L-1LB培养基中对Cd的去除率为58.9%,该菌以胞外吸附为主要方式,随Cd浓度增加,胞外吸附和胞内吸收积累量均会增加。细菌的胞外吸附和胞内积累会受不同微生物种类、重金属种类及离子浓度的影响[10,28]。
小麦重金属食品安全已备受关注[17-18,33]。研究者们曾采取多种化学钝化剂降低小麦重金属含量并取得一定效果[34-35]。但化学钝化剂的长期过量施用可能会引起土壤二次污染,改变土壤理化性质,导致土壤生态系统恶化[36]。近年来基于重金属固定细菌的生物钝化修复技术已引起关注。Rajkumar等[14]筛选的Ni耐性固定细菌BacillusmegateriumSR28C使芥菜根部和地上部Ni含量降低了52%和15%。Han等[15]分离到的重金属固定细菌Bacillus megateriumN3和Serratia liquefaciensH12使青菜叶部Cd含量降低76.5%~79.7%,Pb含量降低76.3%~83.5%。本研究筛选到的重金属固定细菌Pseudomonassp.YM4使两种小麦籽粒Cd含量、富集系数、转移系数降低,且Cd超标处理的籽粒Cd含量低于或接近小麦食品安全的限量标准。结合前人研究,本研究也进一步证实重金属固定细菌的筛选是一种快速获得阻控作物吸收重金属的功能菌株方式。重金属固定细菌能阻控植物对重金属的吸收转运,一方面与细菌通过细胞壁吸附重金属、胞外分泌物络合、沉淀等吸附固定重金属,降低有效态重金属含量有关[6,14],另一方面微生物与植物之间发生复杂的互作作用,微生物能正面或负面调控植物体内某些功能基因的表达,从而改变重金属在植物体内的转运,增强植物的抗逆性[37-38]。Khanna等[39]研究发现番茄接种根际细菌假单胞菌和伯克霍尔德菌降低了Cd转运相关基因表达,减少了对Cd的吸收积累。加强功能菌与小麦的互作研究,研究细菌对小麦Cd转运相关功能基因表达的影响,有望阐明微生物阻控小麦吸收Cd的分子机理,为保障粮食作物安全生产提供重要理论基础。
近年来针对小麦不同积累能力品种的筛选研究备受关注[40]。艾金华等[25]及李乐乐等[41]在Cd污染土壤种植多个小麦品种,通过对小麦籽粒Cd富集能力及Cd吸收能力分析,筛选出西农979属于低Cd累积品种。刘艳阳等[24]采用水培方法以地上部Cd积累量为筛选指标,将25个小麦品种划分为Cd高、中、低3种积累型,其中扬麦158被认定为Cd低积累型品种。本研究以前人报道的低积累型小麦品种西农979和扬麦158为供试材料,研究发现在同一Cd浓度下,不论接菌组或不接菌对照组,白麦(西农979)籽粒的Cd含量、转移系数和富集系数均明显低于红麦(扬麦158),进一步证实白麦(西农979)为低Cd积累型小麦品种。本研究中红麦籽粒Cd积累能力明显较高,这与刘艳阳等[24]筛选扬麦158为Cd低积累型的结论不同,分析可能原因是其采用水培试验,仅依靠地上部Cd含量,而不是籽粒Cd含量作为筛选依据。建议对植物品种不同积累型的筛选应该以可食用部位重金属含量作为标准。YM4接种红麦Cd富集量下降幅度大于白麦,但并未使红麦籽粒Cd含量达到限量标准,说明白麦和红麦两种小麦对细菌接种的反应效果不尽相同,一方面不同基因型品种决定了植物对重金属的吸收能力,此外,这可能与功能菌与不同基因型品种的复杂互作关系有关,这种现象也在Neiverth等[42]对小麦的研究中发现。因此建议在研究微生物对作物应用效果研究时,应扩大供试品种量,充分考虑到不同作物品种对菌株的反应,以明确菌株的适宜匹配品种。
张静静等[43]研究发现1%褐煤和1%生物炭处理能有效阻控郑麦379籽粒对Cd的积累,降幅达56.47%和38.89%。姜洋等[44]发现钙镁磷肥配施石灰处理能有效钝化土壤Cd,降低小麦籽粒Cd含量。本研究中白麦接种细菌YM4后Cd超标处理的籽粒Cd含量下降到0.1 mg·kg-1以下,达到食品安全限量标准。但对于红麦品种,在0.6 mg·kg-1处理时接菌处理虽显著降低了籽粒Cd含量,降幅高达45.31%,但并未使Cd含量低于《食品安全国家标准食品中污染物限量》(GB 2762—2017)小麦的限量标准(0.1 mg·kg-1)。因此,进一步开展功能细菌与某些化学钝化剂联合施用的研究,配合选用低积累型小麦品种,有望获得比单一菌剂或钝化剂更好的阻控效果,对阻控小麦吸收重金属及粮食安全生产具有潜在应用价值。
4 结论
(1)筛选到的Cd耐性固定菌株Pseudomonassp.YM4可通过胞外吸附和胞内积累作用去除Cd,且以胞外吸附为主要方式。
(2)接种YM4在3种Cd浓度下都能阻控两个小麦品种体内Cd的转运,显著降低小麦籽粒Cd含量至低于或接近食品安全国家限量标准。
(3)YM4接种使两个小麦品种Cd含量下降幅度不同,接种YM4使红麦(扬麦158)籽粒Cd含量下降幅度更大,但白麦(西农979)籽粒Cd富集量、富集系数和转移系数明显低于红麦。
(4)随着土壤Cd浓度增加,接菌YM4与不接菌处理组,两个品种小麦吸收Cd含量增多。

