碳酸钙和根际作用对酸性红壤解磷微生物丰度的影响①
郑曼曼,王 超,沈仁芳
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049)
在中国,酸性土壤(pH<5.5)总面积约2.18 亿km2,主要分布在南方热带和亚热带地区[1]。酸性土壤中,磷缺乏是限制农业发展的主要因素之一,在酸性红壤区尤为明显[2]。尽管土壤中存在大量的磷,但是植物能够吸收利用的有效磷比例却很低[3],主要归因于酸性土壤中磷极易与Fe3+和Al3+结合形成难溶态磷酸盐,以及被固定到有机物中[4]。提高土壤磷库中难溶性磷素的活化利用是节约磷肥资源和提高酸性土壤生产潜力的重要途径。解磷微生物作为土壤生态系统中的重要组成部分,是土壤难溶性磷活化和形态转化的主要驱动者[5-6]。发挥解磷微生物功能是缓解土壤缺磷的一个有效途径[3]。通过分泌磷酸酶,降解植酸盐、磷脂等含磷有机化合物,释放可溶性磷酸盐是土壤解磷微生物的一个重要功能[7]。磷酸酶活性是反映土壤有机磷矿化潜力的一个重要指标,根据其最适pH 分为酸性磷酸酶(ACP)和碱性磷酸酶(ALP)[8]。ACP 和ALP 是非特异性磷酸水解酶,能够水解许多正磷酸单酯(植酸除外)以获取正磷酸盐[9]。目前已经克隆出了编码ACP 的基因phoC[10]和编码ALP 的基因phoD[11]。这些解磷微生物功能基因的克隆为检测环境中解磷菌种类、丰度、分布状况和群落结构组成提供了有效手段。
一些农艺措施,比如碳酸钙广泛应用于酸性土壤改良[12]。施用碳酸钙能够显著降低土壤酸度[13],增加作物产量[14]。Wang 等[13]研究表明,酸性土壤中添加碳酸钙能够显著增加细菌16S rRNA 基因丰度,主要原因是碳酸钙降低了土壤酸毒害和铝毒害水平。Acosta-Martínez 和Tabatabai[15]指出碳酸钙施用可增加微生物数量和多样性及土壤酶活性。在土壤-植物系统中,碳酸钙还通过改善植物生长和根际环境,间接影响根际微生物。植物根际环境变化可影响微生物功能、丰度和群落组成[16]。然而,碳酸钙添加对酸性土壤中解磷微生物,特别是对作物根际解磷微生物的影响还关注较少。
鉴于解磷微生物在土壤磷转化和有效性方面的重要作用,本研究通过设置碳酸钙添加试验,分析酸性土壤中玉米根际和非根际磷酸酶活性及phoC和phoD基因丰度,并探究它们与土壤理化性质的相关性,以期阐明碳酸钙和根际作用对酸性红壤磷酸酶活性和解磷微生物丰度的影响。
1 材料方法
1.1 试验材料和设计
盆栽试验所用酸性红壤采自江西省鹰潭市农田,土壤基本理化性质为pH 4.38,有机质 16.79 g/kg,全氮 0.58 g/kg,全磷 0.39 g/kg,全钾 10.62 g/kg,有效磷 6.37 mg/kg。试验时每盆装土1.50 kg,并施用0.20 g/kg磷酸二氢钾和0.50 g/kg硫酸铵作为基肥。试验设置了不添加碳酸钙(CK)、每千克土添加0.3 g碳酸钙(Ca-0.3)和0.5 g 碳酸钙(Ca-0.5)3 个碳酸钙水平处理,同时设置了各处理未种植物的对照(作为非根际土壤)。每个处理设置3 个重复。试验在人工气候生长室进行,光照 14 h(30℃),光照强度为400 μmol/(m2·s),黑暗10 h(25℃),相对湿度为65%。玉米品种郑单958 为试验材料,种植植物处理每盆播种10 粒玉米种子,土壤含水量保持在20%(w/w)。玉米地上部长到1 cm 时间苗,每盆定植3 棵幼苗。自间苗之日起,进行为期3 周的培养。
1.2 植物样品采集和元素测定
收获时测量玉米株高,玉米样品分别收集根系和地上部,用蒸馏水冲洗后于105℃杀青,随后70℃烘干至恒重,称重。地上部样品粉碎,经H2SO4-H2O2消煮后用凯氏定氮仪(Hanon K9860)测定氮含量;经HNO3消煮后,用ICP-AES(IRIS-Advantage,Thermo Elemental,MA,USA)检测磷、钾和钙元素含量。
1.3 土壤样品采集和土壤理化性质测定
采用抖根法收集根际土壤,未种植玉米的土壤为非根际土。土壤样品采集后分3 份保存:用于提取DNA 的土壤样品放置于 -20℃ 冰箱;用于测定土壤磷酸酶活性的土壤放置于4℃冰箱;其余土壤经风干、研磨后用于测定土壤理化性质。土壤pH 按照土水质量比1∶2.5 振荡后,用pH 计测定;土壤全碳(TC)和全氮(TN)采用CNS 元素分析仪测定;土壤铵态氮(NH-N)和硝态氮(NO-N)采用氯化钾浸提-流动分析仪法测定;土壤中全磷(TP)、全钾(TK)、有效磷(AP)、速效钾(AK)、交换性钙(ECa)测定方法详见《土壤农业化学分析方法》[17]。土壤酸性磷酸酶(ACP)和碱性磷酸酶(ALP)活性测定参照Tabatabai[18]描述的方法。
1.4 土壤DNA 提取和基因丰度测定
采用DNA 试剂盒(FastDNA SPIN Kit for soil)提取土壤DNA。解磷微生物功能基因phoC和phoD扩增的通用引物分别为phoc-A-F1(5′-CGGCTCCT ATCCGTCCGG-3′)/phoc-A-R1(5′-CAACATCGCTTT GCCAGTG-3′)[10]和ALPS-F730(5′-CAGTGGGACGA CCACGAGGT-3′)/ALPS-R1101(5′-GAGGCCGATCG GCATGTCG-3′)[11]。基因丰度采用LightCycler 480 实时PCR 系统(Roche Diagnostics,Mannheim,Germany)测定。实时荧光定量PCR(qPCR)反应体系为10 μl,包含1 μl DNA 溶液、0.4 μl 正向引物、0.4 μl反向引物、5 μl SYBR Premix ExTaq(Takara Bio,Inc.,Janpan)和3.2 μl 灭菌水。反应条件如下:95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,40 个循环。为了获得标准曲线,目的基因phoC和phoD片段分别连接到pMD19-T 载体(Takara,Dalian,China)上,并用Escherichia coliDH5α 完成转化。经筛选、测序验证后,采用质粒提取试剂盒(Takara,Dalian,China)提取质粒。将质粒用ddH2O 进行10 倍梯度稀释,用于制备标准曲线。基因phoC和phoD的PCR 扩增效率分别为98.2%(R2= 0.99)和105.5%(R2= 0.98)。
1.5 数据处理与统计分析
数据处理采用Microsoft Excel 2007,统计分析使用软件 SPSS20.0。根际与非根际之间显著性差异采用T 检验;不同处理之间显著性差异采用Duncan 检验;相关性分析采用Pearson 分析。作图使用软件SigmaPlot 10.0。
2 结果
2.1 碳酸钙对玉米生长和土壤理化性质的影响
Ca-0.3 和Ca-0.5 处理下玉米株高和生物量均显著高于CK,并显著增加了地上部氮、磷、钾和钙的吸收量(表1)。碳酸钙添加显著提高非根际土壤pH和NO-N、AP、ECa 含量,但降低NH-N 含量(表2)。碳酸钙添加显著提高根际土壤NO-N、AP、ECa含量,但显著降低NH-N 和AK 含量。根际土壤中TC 和NO-N 含量显著高于非根际土壤,但土壤pH和NH-N、AK、ECa 含量显著低于非根际土壤。

表1 碳酸钙处理下玉米生长性状及地上部元素含量Table 1 Maize growth characteristics and N, P, K, Ca contents in maize shoots under CaCO3 treatments

表2 碳酸钙处理下根际和非根际土壤理化性质Table 2 Physicochemical properties of non-rhizosphere and rhizosphere soils under CaCO3 treatments
2.2 酸性磷酸酶和碱性磷酸酶活性
在CK、Ca-0.3 和Ca-0.5 处理样品中非根际土壤ACP 活性(单位:pNP,mg/(kg·h))分别为63.79 ± 4.42、63.05 ± 4.87 和57.09 ± 3.69,明显低于根际土壤(分别为81.46 ± 3.50、80.73 ± 7.58 和71.01 ± 9.09),且在CK 和Ca-0.3 处理中差异达显著水平(P<0.01 或P<0.05)(图1A)。然而,非根际或根际土壤ACP 活性在不同碳酸钙处理间均无显著差异(图1A)。非根际土壤ALP 活性随碳酸钙用量的增加而增加,且Ca-0.5 处理显著高于前两个碳酸钙处理(图1B),但在根际土壤中各碳酸钙处理间无显著影响。各碳酸钙处理根际土壤ALP 活性均显著高于非根际土壤(P<0.01 或P<0.05)(图1B)。
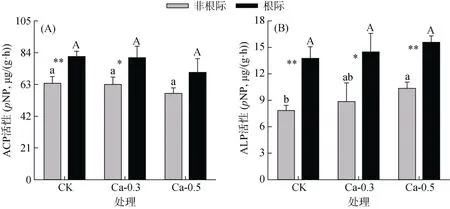
图1 碳酸钙处理下根际和非根际土壤ACP(A)和ALP(B)活性Fig. 1 Activities of ACP (A) and ALP (B) of non-rhizosphere and rhizosphere soils under CaCO3 treatments
2.3 解磷微生物功能基因phoC 和phoD 拷贝数
碳酸钙添加未显著影响根际和非根际土壤phoC基因拷贝数(图 2A)。虽然根际作用增加了phoC基因拷贝数,但是统计上差异未达到显著水平。图2B 显示,phoD基因拷贝数随碳酸钙用量的增加而增加,Ca-0.5 处理显著高于CK。3 个碳酸钙处理根际土壤phoD基因拷贝数均显著高于非根际土壤(P<0.01)。线性回归分析表明,ACP 活性与phoC基因拷贝数在非根际(P<0.01)和根际(P<0.05)土壤中均呈显著正相关(图3A)。ALP 活性与phoD基因拷贝数相关性在根际土壤中达到显著水平(P<0.05)(图3B)。

图2 碳酸钙处理下非根际和根际土壤phoC(A)和phoD(B)基因拷贝数Fig. 2 phoC (A) and phoD (B) gene copy numbers of non-rhizosphere and rhizosphere soils under CaCO3 treatments

图3 土壤磷酸酶活性与phoC(A)和phoD(B)基因拷贝数相关性Fig. 3 Correlations between soil phosphate activities and phoC (A) and phoD (B) genes copy numbers
2.4 土壤磷酸酶活性和基因拷贝数与土壤理化性质的相关性
非根际土壤中,ACP 活性与TK 呈显著负相关,而phoC基因拷贝数与NH-N、TP 含量呈显著正相关;ALP 活性与土壤pH、ECa 含量呈显著正相关,与NH-N 含量呈显著负相关,而phoD基因拷贝数与NO-N、ECa 含量呈显著正相关(表3)。根际土壤中,phoC基因拷贝数与NO-N 含量呈显著负相关,phoD基因拷贝数与pH 及AP、ECa 含量均呈显著正相关,而与NH-N 含量呈显著负相关(表3)。

表3 土壤中磷酸酶活性、phoC 和phoD 基因拷贝数与土壤理化性质的Pearson 相关分析Table 3 Pearson correlations between phosphate activities, phoC, phoD gene copy numbers and soil physicochemical properties
3 讨论
土壤酶参与养分循环,并反映土壤微生物活动[8]。解磷微生物能够通过分泌磷酸酶参与土壤有机磷矿化,提高土壤磷素有效性。Acosta-Martínez 和Tabatabai[15]研究表明碳酸钙施用显著增加土壤pH 和ALP 活性,但是降低ACP 活性。类似地,本研究中碳酸钙添加显著提高土壤ALP 活性和phoD基因拷贝数,表现出降低ACP 活性和phoC基因拷贝数的趋势(图1 和图2),这可能与碳酸钙对土壤pH 的提高作用有关。两种磷酸酶产生主要取决于外界环境pH,ACP 在酸性土壤中较多,而中性或碱性土壤中ALP 较为常见[19]。非根际土壤ACP 和ALP 活性分别与pH 呈负相关和正相关(表3),充分证明这个结果。与Dick 等[8]研究一致,酸性土壤ACP 活性显著高于ALP(图1),表明酸性土壤中ACP 在矿化有机磷方面起主导作用。
土壤酶活性对土壤管理引起的土壤理化性质变化很敏感,并且不同类型酶的敏感程度存在明显差异[20]。本研究中,碳酸钙添加显著影响非根际土壤ALP 及非根际和根际土壤phoD基因拷贝数(图1B 和2B),但对ACP 活性和phoC基因拷贝数影响不显著(图1A 和2A)。Acosta-Martínez 和Tabatabai[15]发现土壤ALP 活性相较于ACP 更易受碳酸钙的影响。磷酸酶活性和基因拷贝数与土壤理化性质间相关分析也表明,ALP 活性与phoD基因拷贝数更易受土壤理化因子的影响(表3),因此,ACP 和ALP 对碳酸钙的响应差异也支持了先前研究。磷酸酶是一类诱导酶,磷缺乏能够诱导植物根系和微生物分泌磷酸酶和促进磷酸酶活性增加,而磷酸酶的形态又与土壤pH 密切相关[8-9]。ALP 对碳酸钙响应强于ACP,证明碳酸钙能够促进土壤微生物生长,尤其是phoD基因相关的微生物种类。这可能归因于ALP 并不来自于植物,仅由微生物分泌[9]。此外,杨艳菊等[21]报道土壤中钙离子含量显著影响解磷微生物的生长。本研究发现非根际ALP 活性和phoD基因拷贝数与ECa 含量呈显著正相关,这也部分解释了ALP 活性与phoD基因拷贝数对碳酸钙响应强于ACP 活性和phoC基因拷贝数。此外,Zaheer 等[22]研究表明,钙离子能够激发ALP 活性,添加钙离子(0.5 ~ 2.0 mmol/L)能够使ALP 活性提升约2.5 倍。钙离子的存在在很大程度上保护ALP 免受其他金属离子的抑制作用,说明磷酸酶对钙离子有较高的亲和力。
根际是植物能量和物质代谢最活跃的区域。植物根系释放的各种分泌物可以选择性地刺激微生物种群生长,因此,根际土壤形成了独特的微生物群落[23-24]。在各种环境条件下,已经广泛报道了根际土壤微生物丰度和活性远高于非根际土壤[13,25],其中解磷微生物的分布表现出强烈的根际效应[26]。植物生长引起根系分泌物增加和养分吸收增强能够刺激根际微生物的解磷功能[10,27]。在本研究所有处理中根际土壤phoC、phoD基因拷贝数和磷酸酶活性均高于非根际土壤,尤其是phoD基因拷贝数和ALP 活性(图1 和图2),表明根际土壤具有较高的解磷微生物活性,并对磷酸酶活性有促进作用。这强烈地暗示根际区域可能存在更高水平的生物解磷作用。
4 结论
综上所述,ACP 在酸性土壤有机磷矿化方面强于ALP,其活性不易受碳酸钙处理的影响。虽然碳酸钙和根际效应均影响解磷微生物功能和丰度,但是根际效应更为强烈,主要表现在增加了磷酸酶活性和phoD基因丰度。因此,调控作物生长对促进酸性土壤解磷微生物功能具有重要指导意义。

