游离氨对污水生物脱氮的影响综述
姜婷婷,李昱含,谢雨阳,林金威,孙洪伟
(兰州交通大学 环境与市政工程学院,甘肃 兰州 730070)


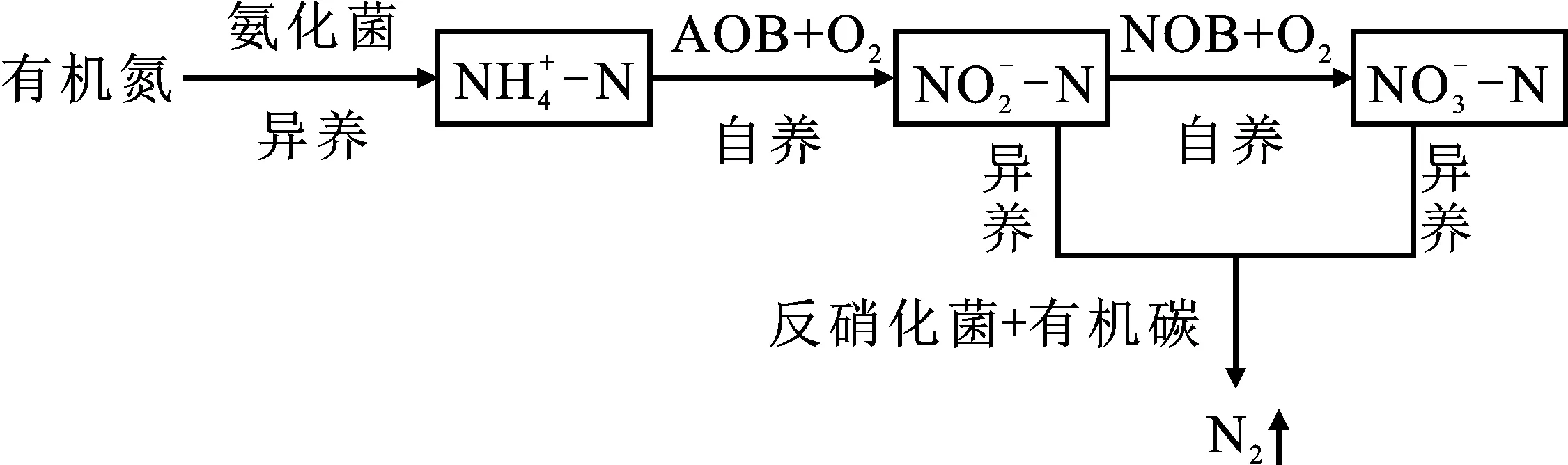
图1 传统生物脱氮基本原理Fig.1 Basic principles of traditional BNR
随着研究的进一步深入,众多研究表明FA 对污水生物脱氮能产生明显的抑制作用[1-3]。目前已经有大量关于FA对脱氮菌群(AOB、NOB和反硝化菌)影响的研究,获得以下结论:虽然FA是AOB的生长基质能使氨氧化反应速率加快,但是已有很多文献表明过高浓度的FA会对污水处理系统中的脱氮菌群产生强烈的抑制作用[13-16]。这种抑制作用主要是通过降低脱氮菌群的活性以及重组微生物群落结构从而对污水脱氮效果产生影响[17]。这种由FA引起的抑制作用涉及硝化反应、产甲烷反应[18-19]、反硝化反应[20]和颗粒污泥形成等领域[21]。
由于大量研究表明FA对污水处理系统中的脱氮菌群有抑制或致死作用,因此有必要对FA在脱氮过程中的详细抑制作用和机理进行研究,在原有模型的基础上进一步对FA抑制作用下的活性污泥动力学模型进行探索,深入理解硝化菌在不同条件下的生化反应过程,从而进一步优化废水生物脱氮工艺,提高该工艺的稳定性。国内目前的研究主要是分析在高氨氮废水中实现短程硝化时FA的抑制作用[22-23],少有涉及FA对硝化菌抑制机理和模型的研究。文中总结了有关FA在废水生物脱氮中作用研究的重要成果。其中包括FA对污水处理系统中的脱氮菌群影响的描述,对涉及的抑制阈值、抑制机理和抑制动力学模型机制的理解,以及通过FA选择性抑制来实现短程硝化。
1 FA对生物脱氮的影响
1.1 FA对硝化过程的影响
在硝化过程中,FA会对氨氧化过程和亚硝酸盐氧化过程产生一定的抑制作用。Anthonisen等最先提出FA对AOB和NOB都能产生抑制作用,只是其对二者的抑制浓度范围不同。发现当FA浓度仅为0.1~1.0 mg NH3/L时,就会使NOB开始受到抑制;当FA浓度为10~150 mg NH3/L,才使得AOB受到抑制作用[3]。Christian等认为,当FA浓度>5 mg NH3/L 时,会使得AOB会受到一定程度抑制,当FA浓度>40 mg NH3/L时,AOB会受到强烈的抑制作用,从而使得氨氮难以转化为亚硝态氮,而当游离氨浓度仅为6 mg NH3/L时,NOB将完全停止新陈代谢[24]。然而在后续的进一步研究中发现了FA对AOB和NOB不同的抑制阈值水平。Kim等的研究中发现当FA浓度仅为0.7 mg NH3/L时就可以使NOB的活性下降超过50%[13]。Balmelle等的研究中发现当FA浓度为25 mg NH3/L时,才使得AOB的活性下降了40%[25]。Vadivelu等2007年的研究表明,当FA<1 mg NH3/L时就开始对NOB产生抑制,随着FA浓度接近6 mg NH3/L时,NOB的生长完全受到抑制[14],这与Christian的结论一致。然而Vadivelu 等2006年的研究发现,当FA接近 16 mg NH3/L 时就开始对AOB产生抑制[20]。Rongsyamanont等研究表明,FA对AOB起始抑制浓度 60~120 mg NH3/L,对NOB的起始抑制浓度为0.6~60 mg NH3/L,该起始抑制浓度与上述研究有很大的不同[26]。
短程硝化是控制硝化反应处于氨氮向亚硝态氮转化阶段,而不继续转化至硝态氮。与传统的全程硝化反硝化相比,短程硝化反硝化具有节省曝气能耗和碳源的优点。同时,其在经济和技术方面均具有较高的可行性[27]。以上研究可以看出在硝化过程中,FA对亚硝酸盐氧化过程的抑制作用强于其对氨氧化过程的影响。可以利用FA对AOB和NOB的敏感性方面的差异实现亚硝酸盐积累,进而获得短程硝化,即将FA浓度调整到抑制NOB活性而AOB活性不受影响的水平,实现短程硝化[28]。目前已经有大量学者利用这种选择性抑制来实现短程硝化。例如,Chung等2005年的研究发现当FA浓度为10~20 mg NH3/L时能够实现稳定的短程硝化[29]。随后,Chung等2006年的研究更进一步研究缩小了能够实现稳定短程硝化的FA浓度范围,为 5~10 mg NH3/L[30]。吴丽娜等在FA 浓度40~70 mg NH3/L 实现了稳定的短程硝化[31]。Vlaeminck等通过将FA浓度控制在3 mg NH3/L以上,实现了有效的短程硝化,并得到了很高的总氮去除率[32]。Sui等在FA浓度为 10.61 mg NH3/L时得到了84%的亚硝积累率[33]。然而,能够实现短程硝化的FA浓度范围研究并没有形成一致的结论,这可能是由于不同的运行条件导致的(溶解氧和悬浮/附着的生长以及微生物群落结构)[34-36]。
此外目前有研究表明,FA对硝化菌群的抑制作用是可逆的,并且AOB的恢复速度比NOB快得多[37]。Sun等提出,在每个FA的初始阶段(1.0 mg NH3/L运行1~25 d,5.3 mg NH3/L 运行 26~41 d 和6.6 mg NH3/L 运行42~57 d),AOB的活性首先下降,然后在2~5 d后迅速恢复至原始值的91%~95%[37],充分证明了FA对AOB的活性有一定的抑制作用,但这种抑制作用能够恢复。宋学起认为NOB能够适应一定浓度的FA,起初当FA浓度为24 mg NH3/L时,亚硝态氮转化为硝态氮的反应完全停止,当NOB适应此FA浓度后,该反应恢复正常[38]。当FA浓度继续提高至56 mg NH3/L时,也可重新恢复亚硝态氮向硝态氮转化[39]。Vlaeminck 等的研究中亚硝态氮积累率在16 d后从0.2降低到0.1[40]。这些研究都能表明FA抑制作用的可逆性。
1.2 FA对反硝化过程的影响
目前针对FA对反硝化过程影响的研究还不多,但已有研究者表明FA对反硝化菌具有明显的抑制作用。Yang等将2 L FA浓度为16 mg NH3/L活性污泥放入污泥处理单元,运行1 d后,观察到污泥中的反硝化活性降低了36%,其中AOB和NOB活性分别降低了21%和47%。然而,将这些处理过的污泥返回10 L的主流反应器后,反应器中的硝化和反硝化性能均不受其影响[41]。这可能是因为在主流反应器中,FA浓度从16 mg NH3/L稀释至 3.2 mg NH3/L,并且随着反应器的运行,FA被持续消耗。此外,从FA处理单元释放的有机碳可被主流反应器中的反硝化器用作外部碳源。
1.3 FA对生物脱氮的总体影响
根据以上研究,FA对脱氮菌群的抑制阈值进行总结,见表1。

表1 FA对污水处理系统中脱氮菌群的抑制阈值Table 1 Inhibition threshold of FA on denitrifying bacteria in sewage treatment system
由表1可知,通过调整FA浓度,可以使得污水处理系统中的脱氮菌群受到40%~100%的抑制。结果表明,相比于NOB,AOB和反硝化菌群对FA的影响有较强的耐受性,在FA浓度超过10 mg NH3/L时,活性仅下降了40%。而对于NOB,在FA浓度为0.7 mg NH3/L时,就可以使得其被抑制50%;在FA浓度为 6 mg NH3/L时,可以使得其被抑制100%。在常规运行条件下,污水处理系统中的FA浓度为0.14~1.38 mg NH3/L[4-5]。因此,在常规条件下,FA对AOB和反硝化菌群的抑制程度远小NOB,NOB被抑制有助于实现短程硝化。
2 FA对生物脱氮的抑制机制
目前,FA对生物脱氮的抑制机制还未形成一致的认识。一般认为,FA可以直接抑制参与生化反应的酶活性,FA对酶的影响是产生抑制作用的关键。在硝化过程中,FA可以直接影响其中涉及的氧化还原酶或是影响与硝化菌的电子转移和质子传递过程中有关的酶[42],使得相关的酶失活,从而导致硝化菌的代谢活性下降。例如,当FA浓度从 0.09 mg NH3/L 增加6.87 mg NH3/L时,一些调节水解的关键酶(蛋白酶和α-葡萄糖苷酶),乙酸盐的产生(磷酸转乙酰酶和乙酸激酶)和甲烷的产生(辅酶F420)的活性降低[43]。同时研究表明FA对不同类型酶的影响是不同的。例如,FA对[FeFe]氢化酶的抑制率仅为7%,而对辅酶F420的抑制率高达97%,从而导致氢积累[44]。Yuan等的研究证明FA能够明显抑Nitrobactor的合成代谢,而对其分解代谢影响有限。FA是通过阻碍硝化菌内ATP合成来实现抑制作用[45]。然而,还需要更进一步了解FA对硝化菌的抑制机理。
3 FA抑制硝化菌的动力学模型
数学建模是了解FA产生抑制作用的潜在机制并预测FA对生物过程影响的强大工具[2]。目前的研究较少有涉及FA对硝化反应影响的数学模型。而当进水FA浓度较高时,FA会对硝化反应产生显著的影响。此时若使用传统的硝化反应模型,会使得模拟结果严重不符合真实情况[1]。因此,有必要建立FA抑制硝化菌的动力学模型,才能得到更为准确的模拟结果。FA抑制硝化菌的动力学模型包括FA抑制AOB的动力学模型和FA抑制NOB的动力学模型。
3.1 FA抑制AOB的动力学模型
FA抑制AOB的动力学模型是在酶促反应的基础上建立的,采用莫诺方程对AOB活性和底物之间的关系进行描述。在底物充足的条件下,FA对AOB的抑制作用可用非竞争性抑制模型(Non-competitive Model)来描述[46],即:
式中 μAOB——AOB的比增殖速率,d-1;

SNH3——AOB底物氨氮浓度,mg/L;
SFA——FA的质量浓度,mg/L;
KNH3——AOB底物饱和常数,mg/L;
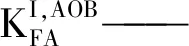
同时,FA对AOB的抑制作用也可以用Haldane模型来描述,即:
3.2 FA抑制NOB的动力学模型
当废水中FA浓度较高时,会出现亚硝酸盐累积现象,此时需要考虑FA对NOB的抑制作用,其中包括反竞争性模型和非竞争性模型[1],即:
反竞争性模型:
非竞争性模型:
式中 μNOB——NOB的比增殖速率,d-1;

SNO-2——NOB底物亚硝酸盐浓度,mg/L;
KNO-2——NOB底物饱和常数,mg/L;

也有研究者认为FA会同时影响NOB的有效底物浓度和底物亲和能力,从而采用混合性抑制模型来描述FA对NOB的抑制作用[47-48],在此基础上再引入一个抑制常数,即:
从上可以看出,FA抑制AOB和NOB的动力学模型都包括非竞争性抑制模型,Park和Bae利用下式拟合实验数据后,发现FA对NOB的抑制常数大约为46 mmol/L,远小于对AOB的抑制常数,为290~1 600 mmol/L[49]。与亚硝酸盐氧化有关的抑制常数较小,这表明NOB比AOB更容易受到FA抑制,这可能使得亚硝酸盐在硝化过程中大量积累。
式中 μ——特定底物利用率,d-1;
μmax——最大特定底物利用率,d-1;
S——底物浓度,mg/L;
SFA——FA的浓度,mg/L;

4 结论和展望
以上研究表明FA对脱氮过程中的硝化和反硝化过程会产生强烈的抑制作用。目前的研究表明,这种抑制作用主要是由FA可以对硝化过程中的氧化还原酶产生直接影响或者是对硝化菌的质子传递和电子转移过程中涉及的酶产生影响,可能会减慢特定的微生物活动,甚至重新配制微生物群落结构。目前已经提出了数学模型作为预测FA对脱氮过程影响的有力工具,这反过来将支持FA的调节作用以实现操作优化。为准确评估FA对脱氮过程影响,仍需对以下方面进行研究:
(1)FA抑制机理及抑制模型。更进一步确定FA抑制AOB和NOB的准确阈值,建立有更强适用性的数学模型,从而能更准确的模拟硝化进程。
(2)FA抑制AOB和NOB产生的适应性。可以利用AOB对FA的适应性而避免NOB出现对FA的适应性从而维持稳定的短程硝化,提高氨氮去除负荷。
(3)FA经济评估。在实际应用中需要从环境和经济角度进一步评估其应用潜力。

