嵌合性抗ROR1抗体Fab片段的制备及鉴定
殷郑娜 梅思伟 蒋秀敏 张宁芝
(阜阳市人民医院,阜阳 236000)
受体酪氨酸激酶样孤儿受体1(receptor-tyrosine-kinase-like orphan receptor 1,ROR1)在进化上具有保守性,仅在胚胎发育早期有显著表达[1,2],在正常成人组织中鲜有表达。ROR1参与细胞的增殖、分化、迁移、血管生成及代谢信号传导等多种功能,同时在细胞间相互作用以及各器官和组织胚胎发育早期发挥重要作用[1,3]。研究表明,ROR1在多种人类肿瘤组织中异常表达[4-11]。在卵巢癌和乳腺癌中,ROR1通过调节上皮-间质转化(EMT)的基因表达影响肿瘤细胞的侵袭性,导致其不良预后[12-14]。本团队前期的研究中证实卵巢癌组织中ROR1的表达量显著高于正常卵巢组织,并发现ROR1是卵巢癌的独立预后因素[8]。为探讨ROR1在卵巢癌发生发展中的作用,本研究制备了抗ROR1抗体Fab片段,并初步探讨该抗体与卵巢肿瘤细胞特异性结合能力,为进一步探究ROR1的作用机制及抗体肿瘤靶向治疗奠定基础。
1 材料与方法
1.1材料 重组人ROR1蛋白(Sino Biological Inc,中国);弗氏完全佐剂、弗氏不完全佐剂、HRP标记兔抗鼠IgG抗体、HRP标记羊抗人Fab抗体(Sigma,美国);8周龄BALB/c雌性小鼠(上海斯莱克动物实验有限责任公司,中国);骨髓瘤细胞系SP2/0(本实验室保存);DMEM 培养基 、RPMI1640 培养基 、胎牛血清(FBS)、1%青霉素/链霉素、次黄嘌呤(H)、胸腺嘧啶(T)、氨基蝶呤(A)(Gibco,美国);大肠杆菌DH5-α、E.coliBL21(南京全式金生物有限公司,中国);异丙基-β-D-硫代半乳糖苷(IPTG)(上海生工生物工程股份有限公司,中国);FITC标记羊抗人Fab抗体、商品化抗ROR1抗体(Abcam,英国);限制性核酸内切酶NdeⅠ、kpnⅠ、NcoⅠ和HindⅢ(Thermo,美国),DNA连接酶、pMD18-T Vector、逆转录试剂盒(TaKaRa,日本);pcomb3Xλ质粒及pETDUET-1原核表达载体为本实验室保存;protein L柱、AKTA蛋白纯化仪(GE,美国),10 kD超滤离心管、30 kD超滤离心管(Millipore,美国);RNA提取试剂盒(飞捷,中国);HO8910细胞购自中国科学院上海生命科学研究院细胞库。
1.2方法
1.2.1小鼠免疫及细胞融合 将重组人ROR1抗原与等体积弗氏佐剂乳化,共振30 min后皮下免疫或腹腔免疫BALB/c雌性小鼠,共免疫3次,每次间隔两周,检测小鼠体内抗ROR1抗体效价,选取抗体效价最高的小鼠,加强免疫一次,3 d后,无菌取该免疫小鼠的脾细胞与骨髓瘤细胞系SP2/0细胞融合,于HAT选择培养液培养11 d。以重组人ROR1抗原包被96孔板,ELISA法检测杂交瘤细胞分泌上清,以筛选阳性杂交瘤。初筛阳性孔经过3次亚克隆,筛选分泌抗ROR1抗体的阳性杂交瘤细胞株。
1.2.2细胞培养 37℃、5% CO2条件下,将HO8910细胞置于含有10%FBS的RPMI1640培养基中,骨髓瘤细胞系SP2/0置于含有10%FBS的DMEM培养基中,融合细胞置于HAT选择培养液中培养。
1.2.3引物设计与合成 利用本实验室设计通用引物[15]PCR扩增ROR1抗体轻链和重链可变区及恒定区,PCR结果阳性的克隆送公司测序,测序结果比对VBASE2 数据库分析,进而得到抗体可变区和恒定区的核酸及氨基酸序列,依据重叠延伸PCR原理,设计抗体轻链和重链的可变区和恒定区引物如下:VH-F:5′-CATATGCAGGTGCAGCTGGTGCA-GTCTG-3′; VH-R:5′-TGGGCCCTTGGTGGAGGCGGAGACGGTGACCAGGGTTC-3′;VL-F:5′-CCATGG-GCGAGCTCGTGATGACCCAG-3′;VL-R:5′-CAGCCTTGGGCTGACCTTTTATTTCCAACTTTGTC-3′;CH-F:5′-GAACCCTGGTCACCGTCTCCGCCTCCACCAAGG-GCCCA-3′; CH-R:5′-GGTACCTTAAGAAGCGTAG-TCCGGAAC-3′;CL-F:5′-GACAAAGTTGGAAATAAAAGGTCAGCCCAAGGCTG-3′;CL-R:5′-AAGCTTTTATGAACATTCTGTAGGGGCCACT-3′。
1.2.4原核表达系统抗ROR1抗体Fab段的构建及鉴定 将筛选分泌抗ROR1抗体的阳性杂交瘤细胞株培养至对数生长期,提取细胞总RNA,利用反转录获取单链cDNA。以cDNA为模板,利用本实验室设计通用引物分别PCR扩增得到抗ROR1抗体轻重链的可变区[15]。以pComb3Xλ质粒为模板,PCR扩增得到抗体轻重链的CL和CH1片段,将PCR产物分别经电泳回收纯化,以纯化的产物为模板,设计引物,分别合成抗体的轻链(L)和重组重链(Fd)。
合成的抗体的轻链和重组重链分别经限制性核酸内切酶NcoⅠ/HindⅢ和NdeⅠ/kpnⅠ在37℃水浴锅中酶切2 h,经电泳回收纯化后,通过DNA连接酶依次连接到表达载体pETDUET-1上,得重组表达质粒,经酶切鉴定及测序检验,证实不存在碱基突和氨基酸序列变化。
1.2.5抗ROR1抗体Fab段的表达和纯化 将重组原核表达质粒pETDUET-1转入感受态E.coliBL21中,并接种于氨苄霉素抗性的固体培养基上培养过夜,筛选阳性克隆扩大培养至对数生长期,按1∶1 000 比例加入IPTG,于16℃摇床过夜诱导表达,收菌,经超声破菌后,留取沉淀和上清,SDS-PAGE及Western blot检测蛋白表达。超声上清经0.22 μm 滤膜过滤后,通过AKTA蛋白纯化仪和protein L柱纯化[16]。收集的蛋白样品置于分子量10 kD的超滤管中,4℃下4 000 r/min离心30 min,重复3次置换洗脱液,获取浓缩蛋白,分光光度计测量蛋白浓度,保存于-80℃冰箱。
1.2.6Western blot 将纯化的抗ROR1抗体Fab段经10% SDS-PAGE电泳分离后,转至硝酸纤维素膜,3%的BSA封闭硝酸纤维素膜2 h,HRP标记的特异性羊抗人Fab抗体封闭1 h,TBST清洗3次后化学发光显影。
1.2.7抗ROR1抗体Fab段的免疫学特性分析
1.2.7.1ELISA ROR1蛋白包被96孔板,4℃冰箱过夜,3% BSA 37℃封闭2 h,PBST清洗3次,将抗ROR1抗体Fab段梯度稀释加入96孔包被板,37℃温箱孵育1 h,PBST清洗3次,加入HRP标记的特异性羊抗人Fab抗体,37℃温箱孵育1 h,PBST清洗3次,每孔加入100 μl TMB显色液,避光10 min,75 μl 2 mol/L浓硫酸终止显色后检测OD450值。商品化抗ROR1抗体作为阳性对照。
1.2.7.2流式细胞术 将HO8910细胞培养至对数生长期,细胞经消化、洗涤后分3管,分别为1号管(Blank组)、2号管(只加荧光二抗组即FITC组)及3号管(实验组即ROR1-Fab组),5% 脱脂牛奶、37℃温箱封闭1 h,PBS清洗后,1号管和 2号管加入PBS;3号管加入抗ROR1抗体Fab段,均置于37℃温箱孵育1 h,PBS清洗后1号管中加入PBS; 2号管和3号管分别加入FITC标记羊抗人Fab抗体;室温避光孵育1 h。PBS清洗后重悬细胞,流式细胞仪进行分析。
1.2.7.3免疫荧光 将HO8910细胞接种至6孔板中,分为ROR1-Fab组和对照组,待细胞密度生长至80%,用4%多聚甲醛固定,5% 脱脂牛奶封闭1 h,于ROR1-Fab组加入ROR1-Fab抗体室温孵育2 h,对照组加入等量PBS,PBS清洗后于两组加入FITC标记羊抗人Fab抗体封闭1 h,DAPI染细胞核后荧光显微镜分析。
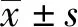
2 结果
2.1原核表达嵌合性抗ROR1抗体Fab段质粒的构建和鉴定 实验成功获得分泌抗ROR1抗体的阳性克隆细胞株,提取该细胞总RNA,经反转录得到单链cDNA。以此cDNA为模板,PCR扩增嵌合性抗ROR1抗体Fab段轻重链的可变区,大小均约为400 bp;以pcomb3Xλ质粒为模板,PCR扩增抗体轻重链的恒定区,大小分别约为350 bp和400 bp。利用重叠延伸PCR,将抗体可变区和恒定区分别连接,得到轻链L和重组重链Fd,大小分别约为750 bp和800 bp(图1)。得到的轻链L和重组重链Fd,分别经限制性核酸内切酶NcoⅠ/HindⅢ和NdeⅠ/kpnⅠ酶切后,与原核表达载体pETDUET-1连接,得重组表达质粒,即原核表达抗ROR1抗体Fab段质粒成功构建。 经酶切验证及测序检验,证实不存在碱基突变和氨基酸序列变化。酶切后进行琼脂糖凝胶电泳得到的条带与轻链和重链大小相同(图2)。
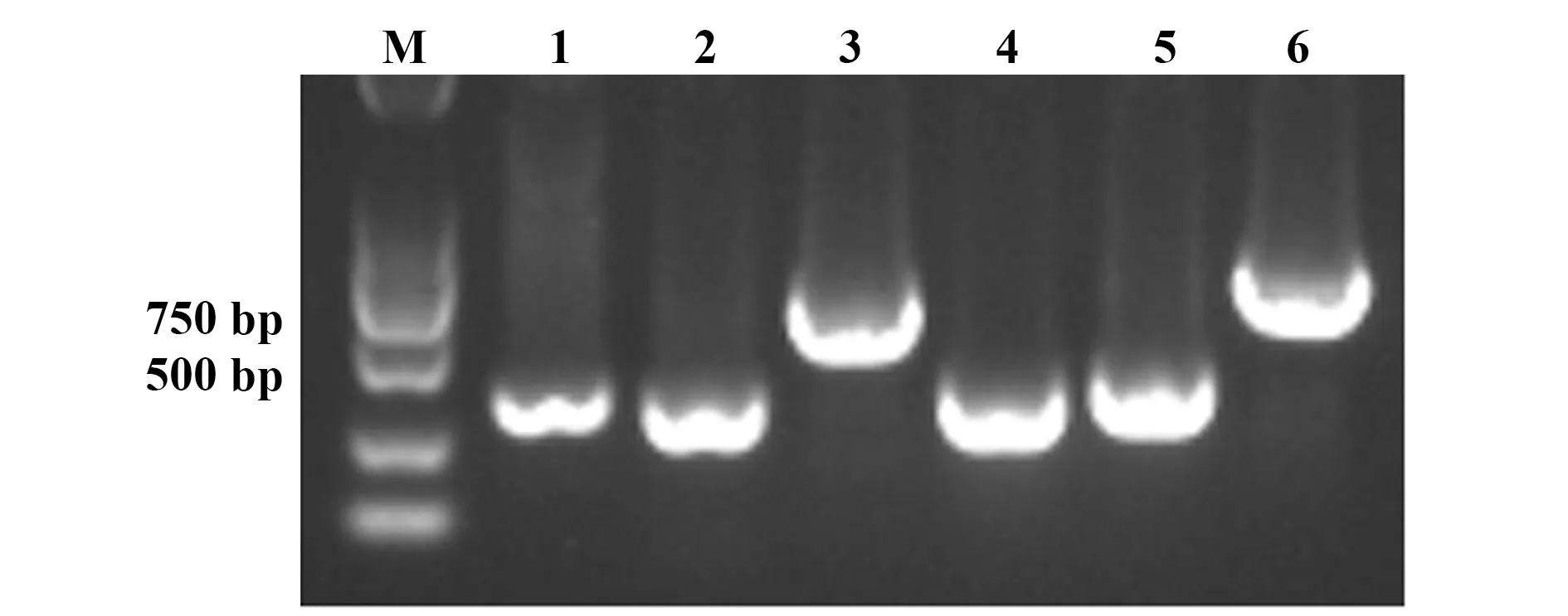
图1 PCR扩增嵌合性抗ROR1抗体Fab段轻链和重链Fig.1 PCR amplification of chimeric anti-ROR1 Fab antibody light and heavy chainsNote:M.DNA marker;1.Variable region of light chain;2.Conserved region of light chain;3.Light chain;4.Variable region of heavy chain;5.Conserved region of heavy chain;6.Heavy chain.
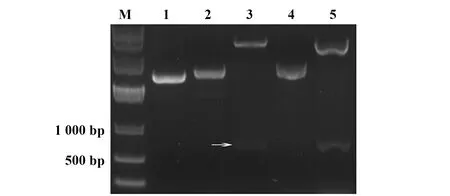
图2 原核表达嵌合性抗ROR1抗体Fab段质粒的酶切鉴定Fig.2 Identification of chimeric anti-ROR1 Fab antibody plasmids by prokaryotic expressionNote:M.DNA marker;1.Plasmid of pETDuet-1 without restriction endo-nuclease digestion;2.Plasmid of pETDuet-1 combined with the light chain (pETDuet-L);3.NcoⅠ/HindⅢ were used for double digesting the pETDuet-L plasmid;4.Plasmid of pETDuet-1 combined with the heavy and heavy chains (pETDuet-L-H);5.NdeⅠ/kpnⅠ were used for double digestion of the pETDuet-L-H plasmid.
2.2嵌合性抗ROR1抗体Fab段的表达与纯化 SDS-PAGE和Western blot结果显示,约27 kD处可见明显条带,经IPTG诱导表达菌条带明显比未用IPTG诱导表达菌亮,超声上清中条带明显比超声沉淀的亮(图3),证明蛋白主要于胞浆中表达。经数据库对比发现本实验制备抗体轻链为К型,选用protein L柱纯化,超声破菌上清经纯化、浓缩后,得抗体终浓度为0.9 mg/ml。SDS-PAGE和Western blot用于纯化抗体的验证:在约27 kD处可见明显条带,与表达抗体大小符合(图4)。
图3 嵌合性抗ROR1抗体Fab段的表达Fig.3 Expression of chimeric anti-ROR1 Fab antibodyNote:A.SDS-PAGE;B.Western blot.1.Sediment of sonicated lysate of E.coli induced by IPTG;2.Supernatant of sonicated lysate of E.coli induced by IPTG;3.Sediment of sonicated lysate of E.coli;4.Supernatant of sonicated lysate of E.coli;M.DNA marker.

图4 嵌合性抗ROR1抗体Fab段的纯化产物Fig.4 Purified product of chimeric anti-ROR1 Fab antibodyNote:A.SDS-PAGE;B.Western blot.
2.3ELISA嵌合性抗ROR1抗体Fab段能特异性结合抗原ROR1 ELISA法检测抗ROR1抗体Fab段和ROR1蛋白的结合能力,结果显示嵌合性抗ROR1抗体Fab段能特异性结合抗原ROR1,具有量效关系(图5)。
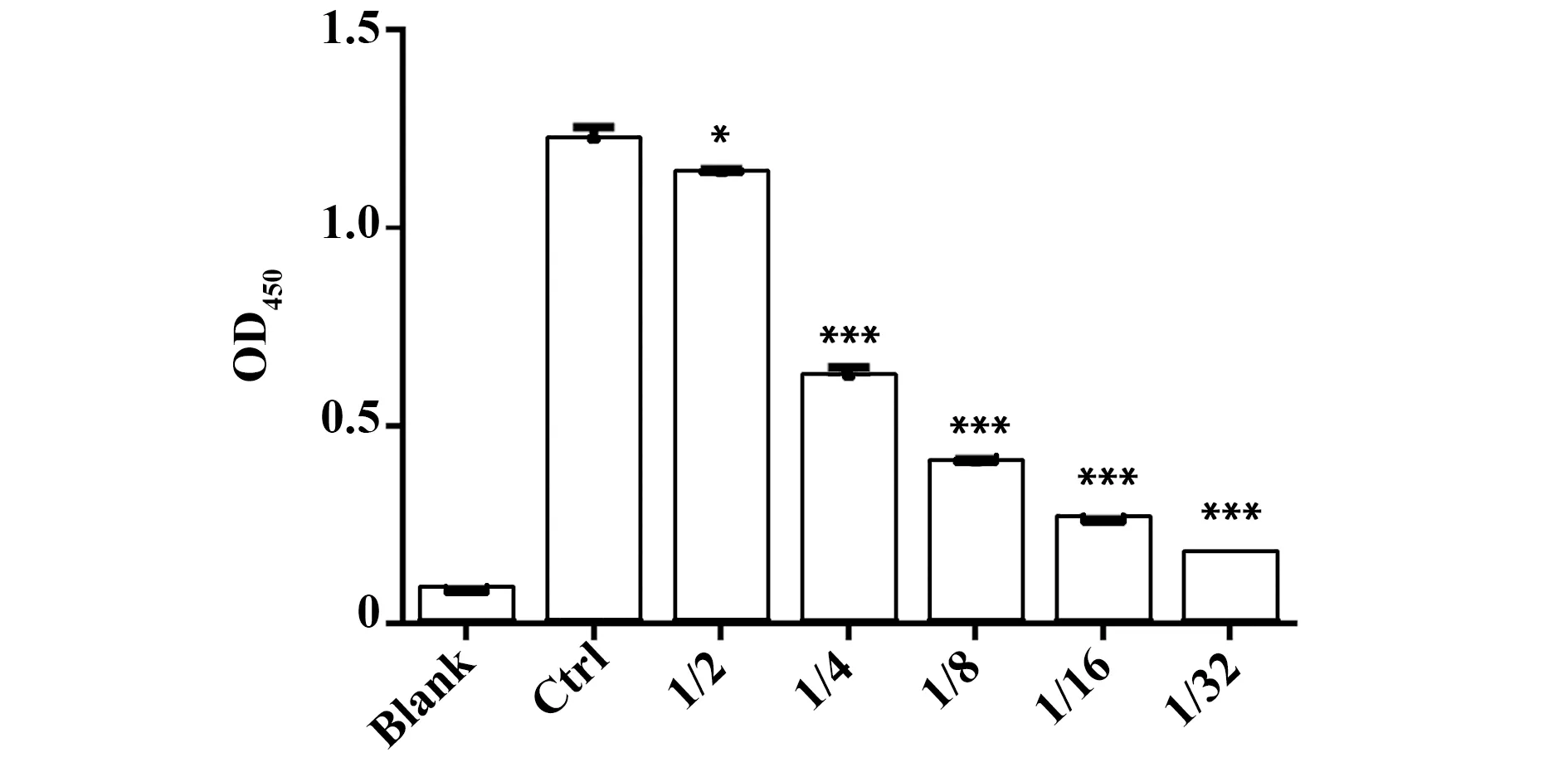
图5 ELISA检测嵌合性抗ROR1抗体Fab段与ROR1的特异性结合Fig.5 Chimeric anti-ROR1 Fab antibody specific bind ROR1 was evaluated by ELISANote:Serial dilutions of the chimeric anti-ROR1 Fab antibody were used as the first antibody for ELISA and HRP-conjugated goat anti-human antibody (Fab specific) was used as the secondary antibody.Blank.PBS;Ctrl.Commercial anti-ROR1 antibody was used as a positive control.*.P<0.05,***.P<0.001.
2.4流式细胞术验证抗ROR1抗体Fab段与卵巢癌HO8910细胞特异性结合 流式细胞术检测嵌合性抗ROR1抗体Fab段与卵巢癌HO8910细胞的结合能力,结果显示,抗ROR1抗体Fab段可特异性结合到卵巢癌HO8910细胞表面,证明卵巢癌HO8910细胞有ROR1蛋白的表达(图6)。
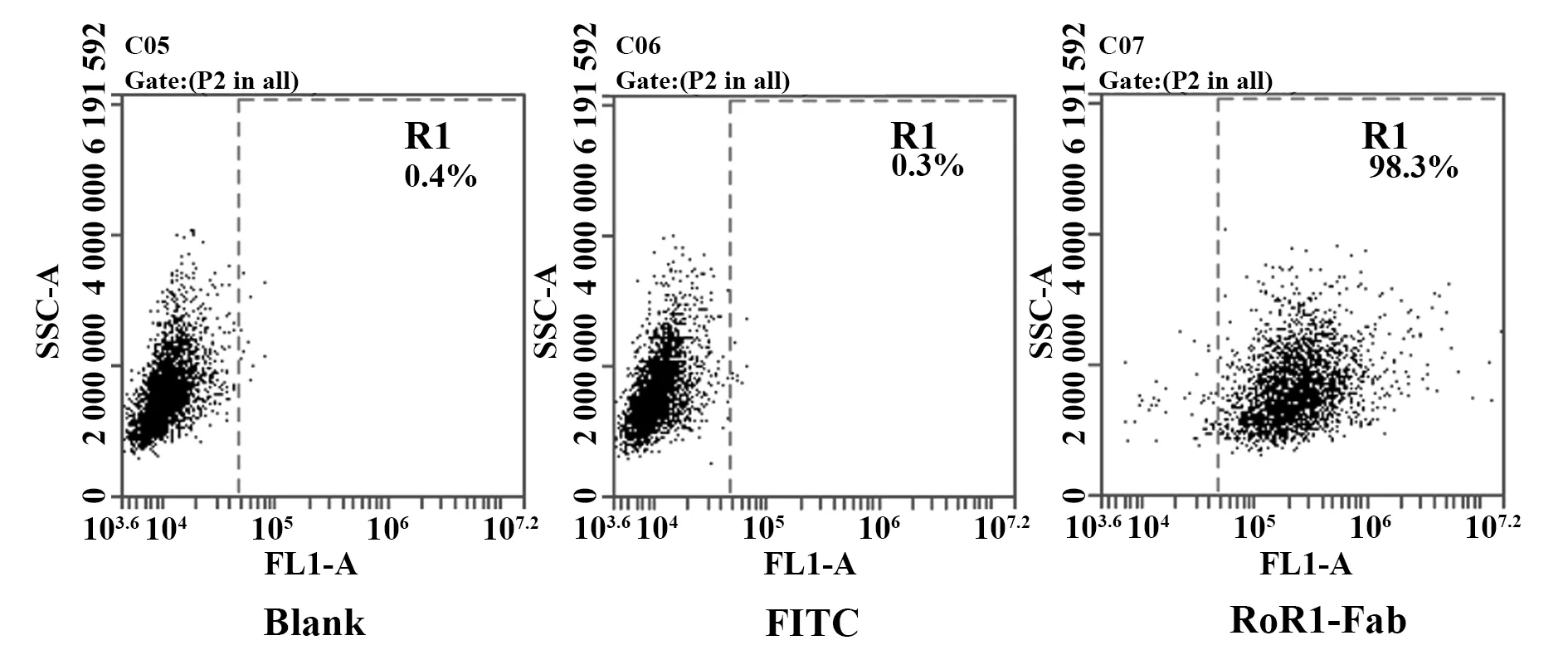
图6 流式细胞术证明抗ROR1抗体Fab段能特异性结合于卵巢癌HO8910细胞表面Fig.6 Specific binding of anti-ROR1 antibody Fab to ovarian cancer HO8910 cells by Flow cytometry
2.5免疫荧光验证抗ROR1抗体Fab段与卵巢癌HO8910细胞特异性结合 荧光显微镜观察结果显示,嵌合性抗ROR1抗体Fab可特异性结合到表达ROR1蛋白的HO8910细胞表面(图7)。
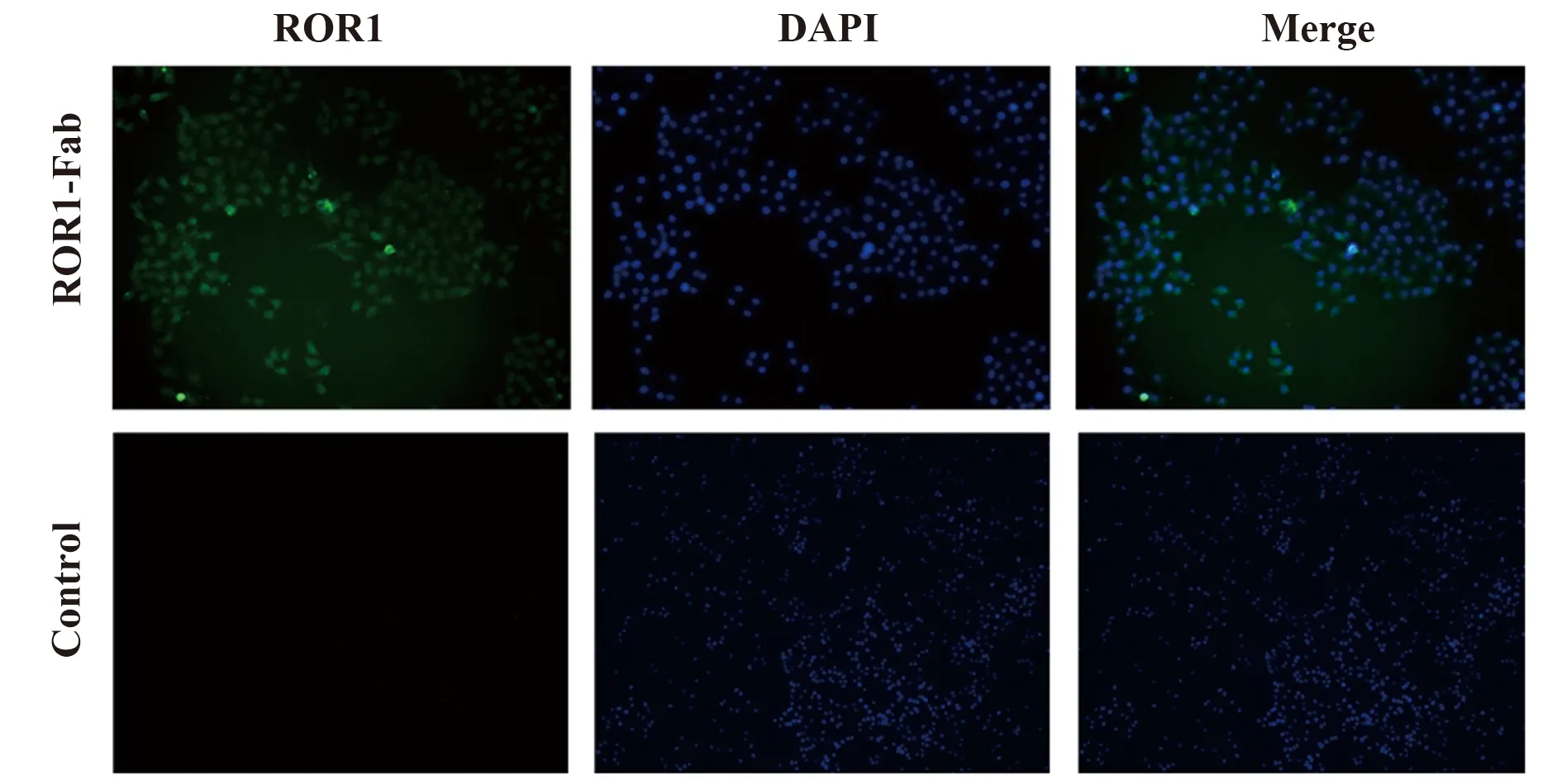
图7 免疫荧光检测抗ROR1抗体Fab段能特异性结合于卵巢癌HO8910细胞表面Fig.7 Specific binding ability of anti-ROR1 antibody Fab to ovarian cancer HO8910 cells by immunofluore-scence staining
3 讨论
通过小鼠免疫、细胞融合技术及亚克隆筛选,成功筛选出分泌抗ROR1抗体的阳性融合单细胞株,在此基础上,应用基因工程技术,将PCR扩增得到抗体的轻链可变区与恒定区连接,将重链可变区与恒定区连接,获取抗体轻链L和重链Fd,进而将L和Fd连接到原核表达载体pETDuet1上,成功构建表达抗ROR1抗体Fab段的重组质粒。通过将该重组质粒转入大肠杆菌E.coliBL21感受态中诱导表达,得到嵌合性抗ROR1抗体Fab,经纯化后-80℃保存。SDS-PAGE和Western blot结果显示表达的抗体主要存在于菌液的上清即细胞胞浆中,避免了抗体的变性和复性,有利于抗体的获取和纯化,有效保证了抗体的生物活性,分子量约为27 kD。本研究利用基因工程技术成功将人源抗体恒定区与鼠源抗体可变区相结合,将抗体人源化,在保留与抗原高亲和力和高特异性的基础上,大大减少了鼠源性成分在机体引起的免疫排斥反应[17]。
卵巢癌是最常见的女性癌症之一,尽管目前相关检查方法和治疗方案已有明显进步,但由于发病早期的无症状和有效肿瘤标志物的缺乏,多数卵巢癌患者确诊时已处于晚期阶段,预后较差。单克隆抗体现已被广泛用于肿瘤的临床诊断和治疗,分子靶向治疗作为一种新型的治疗手段,以其特异性强、副作用小的优点,广受研究者们的青睐。
本团队前期研究证实ROR1蛋白高表达于卵巢癌细胞表面,作为RTK家族的成员,ROR1具有肿瘤相关抗原(TAAs)的特性,研究表明ROR1表达与癌症密切相关[8,18]。最近,Zhang等[13]报道一种人源化抗ROR1单克隆抗体抑制乳腺癌干细胞相关基因表达,并降低了Rho-GTPases,Hippo-YAP/TAZ或BMI1的活化。Liu等[19]构建了一种新的ROR1抑制剂ARI-1,抑制了非小细胞肺癌的发展。以上表明,针对ROR1的靶向治疗是一种很有前景的癌症治疗策略。本研究成功构建了稳定表达的抗ROR1抗体Fab段重组表达质粒,经纯化得到抗ROR1抗体Fab段,其可与ROR1抗原结合,且具有高度特异性和高度亲和力。此外,流式细胞术及免疫荧光验证了嵌合性抗ROR1抗体Fab段能与表达ROR1蛋白的卵巢癌HO8910细胞的特异性结合,这为进一步探究ROR1的作用机制及卵巢癌分子靶向治疗奠定了基础。

