竞争ELISA 法检测人抗脊髓灰质炎病毒(Ⅲ型)中和抗体
张冰洁,赵卫忠,高菁霞,朱文勇,李卫东,廖国阳
(中国医学科学院北京协和医学院医学生物学研究所,云南昆明 650018)
脊髓灰质炎(俗称小儿麻痹,简称脊灰)是由脊髓灰质炎病毒(分为Ⅰ、Ⅱ、Ⅲ三个型)引起的一种严重危害人类(特别是婴幼儿)健康的急性传染病,主要通过消化道感染后再形成二次病毒血症,常累及中枢神经系统,造成永久性残疾或死亡[1-2]。上世纪50 年代以来,疫苗的广泛使用为在全世界范围内消除脊灰提供了有效手段[3-5]。全球范围内的最后一例Ⅲ型野生脊灰病毒是在2012年在尼日利亚北部检出。世界卫生组织(WHO)在2015 年正式宣布Ⅲ型脊灰病毒被消灭。为了维持无Ⅲ型脊灰状态,免疫效果的监测成为了问题。根据全球根除脊灰行动计划(GAP3)的进程,活病毒包括减毒株在内的所有脊灰活病毒都将要被封存,只能在WHO 认可的少数实验室中使用,这给脊灰中和抗体评价免疫力带来了的难题[6]。所以迫切需要一种快速、准确并且易于在基层医疗卫生机构实施的检测方法,用于疫苗免疫后效果监测和人群免疫屏障的监测。本实验室早在2007 年建立了多克隆抗体双抗体夹心ELISA 方法用于检测血清中和抗体水平[7],但仍然有进一步研究的价值。本研究建立了竞争ELISA 方法,并从特异性,灵敏性,稳定性和重复性方面进行详细研究。使用来源于临床的80 份血清作为研究对象,与中和试验进行一致性研究,现报道如下。
1 材料和方法
1.1 细胞
人喉表皮样癌细胞(HEP-2)购自于美国组织培养库(ATCC)(CCL-23TM),保存于中国医学科学院医学生物学研究所,在本研究中HEP-2 细胞工作代次为:第189 代。
1.2 抗原与抗体
脊髓灰质炎Ⅲ型的Sabin 株病毒灭活液由中国医学科学院医学生物学研究所生物四室生产并纯化后获得,批号为2016052310,经质量鉴定实验室检测,该批次Sabin Ⅲ型的D 抗原含量为3 187 DU/mL;兔多克隆抗脊髓灰质炎病毒抗体由生物制品五室制备并保存,经纯化后检测其总蛋白浓度为3 mg/mL;待测人血清标本来源于昆明医科大学第二附属医院检验科,由该科室负责血清的分离和血清的人口学调查。
羊多克隆抗兔抗体,有辣根过氧化物酶标记(HRP-Goat-anti-Rabbit IgG)购自Abcam 公司,Cat.No.ab6721;牛血清白蛋白(BSA)购自VETEC 公司;TMB 单组份显色液购自Solarbio 公司,Cat.No.PR1200。
1.3 溶液配制
MEM(50 L 装)粉剂和M199(50 L 装)粉剂均购自Gibco 公司,(Lot No.1778268)由中国医学科学院医学生物学研究所溶液组配置,灭菌和分装;新生牛血清购自兰洲民海生物工程有限公司(Lot No.20180925)。
竞争ELISA 稀释液:KH2PO40.2 g,Na2HPO4·12 H2O 2.87 g,NaCl 8 g,KCl 0.2 g,加蒸馏水1 000 mL,高压灭菌室温保存;再加入BSA 5 g,Tween-20 0.5 mL,充分混匀后备用。竞争ELISA洗液:在上述稀释液基础上,不加5 g 的BSA 即为洗板液。
竞争ELISA 反应终止液使用2 mol/L H2SO4,即将浓硫酸11.1 mL 缓慢加入到88.9 mL 去离子水中,充分混匀后备用。
1.4 实验方法
1.4.1 竞争ELISA 实验条件探索 采用方阵法[8-9],首先对最佳包被抗原的使用量和兔多抗脊灰抗体的最佳稀释度进行探索。该抗原和抗体的稀释梯度设置见表1。
用稀释液将Sabin Ⅲ型D 抗原浓缩液按要求进行倍比稀释后加入酶标板,每孔加100 μL,4 ℃过夜;洗板2 次后加入不同稀释度的兔抗脊灰抗体100 μL/孔,37℃孵育1.5 h;洗板3 次后加入羊抗兔HRP-IgG (1:6 000),100 μL/ 孔,37℃孵育1 h;洗板4 次加入底物TMB 显色,100 μL/孔,室温避光孵育10 min;加入50 μL 终止液,最后测定OD450nm值。
筛选指标:OD450nm值在0.9~1.8 并且与左右相差较大的反应孔抗原浓度与兔抗脊灰抗体稀释度即为最佳抗原包被量与抗体最佳稀释度[8-10]。
1.4.2 实验条件的优化 待测血清最佳稀释倍数:将待测血清以2 为梯度进行倍比稀释,从1:4 到1:512 之间,然后与兔多抗脊灰共同孵育,通过抑制率优化待测血清的稀释倍数。

阳性阈值的确定:使用16 份经过中和试验确定为阴性的血清,使用竞争ELISA 方法检测,计算每一份血清的抑制率,然后计算平均抑制率和标准差,阳性血清的阈值为平均抑制率加上三倍的标准差。
最高检出稀释倍数的确定:将经过中和试验确定为阳性的血清,随机抽取24 份,然后进行2 为梯度,更多倍比稀释,从1:8 到1:1024 之间。当抑制率接近阈值但大于阈值的稀释倍数即为待测血清的最高稀释倍数,也称为灵敏度。
重复性特征:分别进行了同一块酶标板中4 复孔的批内差异性分析,不同4 块酶标板的批间差异性分析,以及两名经过培训的工作人员进行的人员差异性分析,经过统计分析,批内、批间和人员变异系数应<10%,表示重复性较好[7]。
1.4.3 微量中和试验 使用抗体稀释法测定待测血清中的中和抗体滴度,首先待测血清从1:4 到1:1024,进行2 为梯度的倍比稀释,取50 μL,然后与滴度为106.625TCID50/mL 的病毒50 μL 在37℃条件下孵育2 h,然后加入Hep-2 细胞,细胞密度为106个/mL,于35℃培养7 d,通过CPE 的观察,计算待测抗体的最终中和抗体效价[11-12]。
1.5 统计学处理
本研究数据均采用SPSS 统计软件和Prism 6.0软件进行统计学处理,结果以均数±标准差()表示,显著性检验为Pair Sample T Test 检验,计数资料采用卡方检验。P<0.05 为差异有统计学意义。
2 结果
2.1 竞争ELISA 检测方法反应条件的优化
将不同浓度的包被抗原(D 抗原)与不同稀释度的兔抗脊灰(多抗)采用方阵滴定法确定了最佳工作浓度条件,结果见表1。然后在此基础上,进一步优化得到竞争ELISA 检测条件为:包被抗原使用浓度:99.6 DU/mL;兔抗脊灰稀释倍数为1:4000。酶标抗体HRP 标记,羊抗兔(多抗)选择直线相关性有着良好的范围内的最佳工作浓度为:0.33 μg/mL。
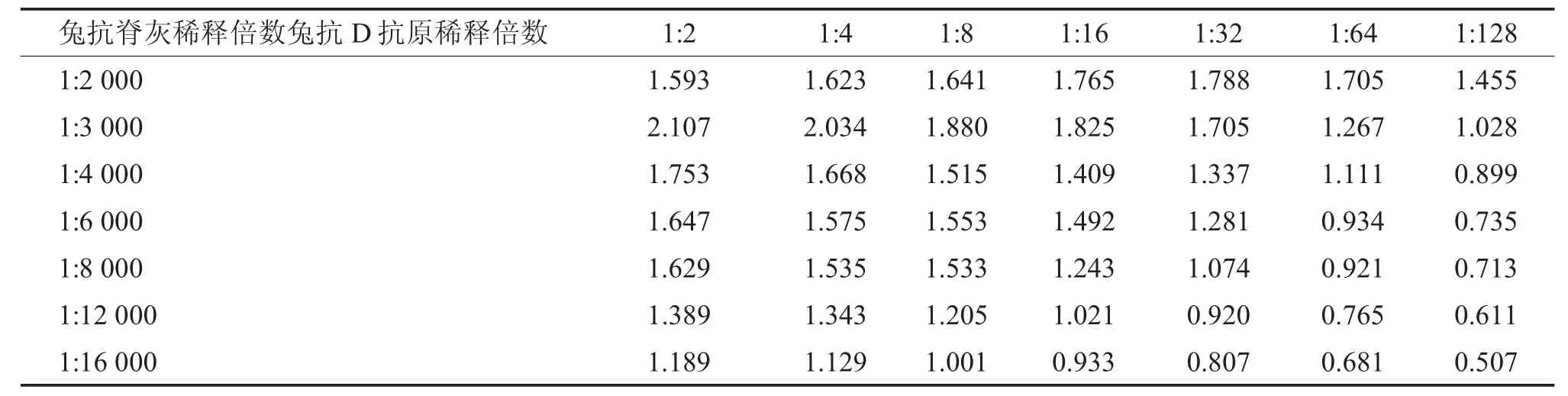
表1 方阵滴定法确定包被抗原和兔抗脊灰的稀释倍数的OD450nm 检测值Tab.1 Square titration method to determine the OD450nm detection value of the dilution multiples of coating antigen and rabbit anti-polio
2.2 待测血清最适稀释倍数和临界值的确定
将16 份经过中和试验证实的阴性血清,按照不同梯度进行稀释,检测竞争ELISA 的OD450nm值,结果见图1,观察发现待测血清在1:16 稀释条件下,OD 值进入平台,曲线斜率降低,该条件为待测血清的最适稀释倍数。同时计算其平均抑制率为25.03%,SD 为0.013,根据公式计算阳性血清的抑制率临界值为28.93%,待测血清在1:16 稀释条件下,抑制率大于该值方能判断为阳性。

图1 16 份阴性血清在竞争ELISA 方法中抑制率的散点图Fig.1 The distribution of scatter plot of inhibition rate of 16 negative serum in competitive ELISA
2.3 竞争ELISA 与中和试验结果的一致性
对64 份待测血清,同时使用竞争ELISA 方法和中和试验方法进行检测,检测结果见表2,通过χ2检验,表面两种检测方法在阳性检出中,差异无统计学意义(P>0.05)。

表2 血清Ⅲ型抗体竞争体ELISA 法与中和试验检测方法的比较Tab.2 The results of competition ELISA method and neutralization testing about type serum Ⅲantibody
2.4 竞争ELISA 的特异性
检测D 抗原和C 抗原上的特异性,将相同浓度99.6 DU/mL 的D 抗原,和56℃,1 h 高温条件下得到的C 抗原同时按照上述操作进行检测。当D 抗原转换为C 抗原后,在使用竞争ELISA,兔抗脊灰不能与之结合,人抗脊灰也不能形成相应的竞争。所以本研究建立的竞争ELISA 具有脊灰病毒D 抗原特异性。
在型上的特异性:使用D 抗原作为包被抗原,在三个型别特异性上进行验证,分别用Ⅰ、Ⅱ、Ⅲ型抗原,按照相同的D 抗原浓度进行包被,结果发现,Ⅲ型抗体与其它两个型的抗原不发生交叉反应。所以本研究建立的竞争ELISA 具有脊灰病毒Ⅲ型特异性。
2.5 灵敏特性
将待测血清按照1:2 的梯度进行倍比稀释,然后使用竞争ELISA 方法进行检测,结果观察到,当待测血清稀释度为1:256 时,抑制率能保持31.22%,但是进一步待测血清稀释度为1:512 时,抑制率为26.73%。所以竞争ELISA 检测检测的待测血清的最高稀释倍数为256 倍,最适稀释倍数为16 倍。
2.6 重复性验证
在相同的酶标板中,平行选择四孔复孔进行批内重复试验检测,其变异系数在3.296 %~4.518%;选择六块酶标板进行批间重复性试验,其变异系数在5.26%~6.11%;对两名专业技术人员进行培训后使用相同检测试剂进行重复性试验,其变异系数为7.21%~8.245%。结果表明该检测方法具有良好的重复性。
3 讨论
目前全球正处于消灭脊灰的最后阶段,Ⅱ和Ⅲ型脊灰病毒已宣布被消灭,目前仅脊灰病毒Ⅰ型野毒株在阿富汗,尼日利亚和巴基斯坦等国家和地区流行,但由于疫苗衍生毒株的产生,以及生活环境污水中脊灰能存活3~5 a 等因素下,在全球范围内消除脊灰仍然任重而道远[13-15]。解决的有效手段是加强人群的免疫,特别是新生婴幼儿,及时建立并巩固人群免疫屏障,并完善相应的疫苗免疫效果监测与管理[14-15]。另一个方面,封存脊灰野毒株以及Sabin 株的大前提下,建立开发新的可靠的检测方法成为了一项重要工作,因为一旦封存,过去建立在中和试验基础上的免疫效果监测就将难以开展,所以本研究具有很好的现实意义。
本研究成功建立了竞争ELISA 方法检测人抗脊灰中和抗体的方法,不使用活的脊灰病毒,符合国家规程的要求。而且与2007 年的双抗体夹心ELISA 方法[7]检测的不同,在一定程度上于提高了样品检测的阳性率,避免了假阴性的检验误差,能够更加真实地反映人群中的抗体水平。竞争ELISA方法通过抑制率作为阳性判断的标准,具有良好的科学性,能够有效判断待测血清的结果,而不简单依赖于OD 值的判断,有效减少了误差。
WHO 在上世纪就提出了消灭脊灰行动,我国目前也保持无脊灰状态多年,但是由于脊灰疫苗相关病例与VDPV 循环,以及全球交通互通互联加快,人口流动的范围、速度、频次增加,病毒输入和传播的机率加大,所以对脊灰抗体水平的监测是一项长期的工作[16-17],本研究为该工作的开展提供了一种行之有效的方法,值得在广大基层医疗卫生机构中推广。

