阿尔泰金莲花提取物抑制变异链球菌乳酸脱氢酶活性及抗氧化活性研究
姜 敏,田树革,李柯翱,季志红*
(1.新疆医科大学中医学院,新疆 乌鲁木齐 830011; 2.新疆奇沐医药研究院(有限公司),新疆 乌鲁木齐 830011)
1 实验
1.1 材料、试剂与仪器
阿尔泰金莲花,采自新疆博乐温泉,经新疆医科大学中医学院李永和主任药师鉴定为毛茛科、金莲花属阿尔泰金莲花(Trolliusaltaicus)。
牡荆素(批号20160201),宝鸡辰光生物科技有限公司;荭草苷(批号H-044-181216),成都瑞芬思生物科技有限公司;脑心浸出液BHI,北京索莱宝科技有限公司;乳酸脱氢酶试剂盒,南京建成生物工程研究所;其余试剂均为国产分析纯。
752型紫外可见分光光度计,ME204E型电子天平,CO2细胞培养箱,酶标仪,洁净工作台,SJ-3F型pH计,全自动式电热高压蒸汽灭菌器。
1.2 菌株的培养及菌悬液的制备
将变异链球菌菌株(ATCC 76100)从超低温冰箱中取出,在BHI液体培养基中复苏48 h;采用平板划线法将其接种到BHI琼脂板上,37 ℃、5%CO2厌氧培养24 h;涂片,显微鉴定为纯培养物。采用取菌环取单菌落接种于BHI液体培养基中培养24 h,用生理盐水将菌悬液稀释至106CFU·mL-1。
1.3 阿尔泰金莲花提取物的制备
称取阿尔泰金莲花粗粉10 g,用10倍量30%乙醇回流提取2次,每次1 h,合并滤液,浓缩至浸膏状后,冷冻干燥,备用。
1.4 最小抑菌浓度和最小杀菌浓度的测定
参照文献[11],采用微量稀释法测定MIC。配制50 mg·mL-1的阿尔泰金莲花提取物溶液,无菌滤头滤菌后,稀释至50~3.125 mg·mL-1,依次向96孔板中加入等量不同浓度的阿尔泰金莲花提取物与菌悬液(106CFU·mL-1),轻微振荡混匀,37 ℃、5%CO2孵育24 h,取出观察;以不加阿尔泰金莲花提取物为空白对照组,每个浓度设3个重复。孔内液体清澈透明,没有细菌生长的最小浓度即为MIC。
在MIC测定的基础上,选择96孔板中浓度≥MIC的菌悬液,用取菌环蘸取菌悬液后在BHI平板上划线培养24 h,平板上没有菌落出现的浓度即为MBC。
1.5 生长曲线的绘制
将106CFU·mL-1菌悬液与含有不同浓度(MIC、1/2MIC、1/4MIC、1/8MIC)阿尔泰金莲花提取物的BHI液体培养基分别等量加入无菌试管中,37 ℃、5%CO2厌氧培养,分别在0 h、2 h、4 h、6 h、8 h、10 h、14 h、18 h、22 h、26 h、30 h取样测定OD600值;以不加药物为空白对照组,每个浓度设3个重复。为避免阿尔泰金莲花提取物本身颜色的干扰,取不同时段OD600差值绘制细菌的生长曲线。
1.6 ΔpH值和LDH活性的测定
按体积比1∶10将菌悬液与含有不同浓度(MIC、1/2MIC、1/4MIC、1/8MIC)阿尔泰金莲花提取物的BHI溶液混合,测定上清液的pH值(pH初始);37 ℃、5%CO2厌氧培养18 h后,3 300 r·min-1离心20 min,测定上清液的pH值(pH结束),并按所提供试剂盒说明测定LDH活性;以不含药物的菌悬液为空白对照组,每个浓度设3个重复。以ΔpH值(pH初始-pH结束)评价阿尔泰金莲花提取物对变异链球菌产酸的影响。按式(1)计算LDH活性(U·L-1):

×1000
(1)
1.7 抗氧化活性评价
1.7.1 DPPH自由基清除实验
在文献[12]的基础上进行改进。配制0.1 mg·mL-1阿尔泰金莲花提取物溶液,分别稀释成0.000 3 mg·mL-1、0.000 5 mg·mL-1、0.001 mg·mL-1、0.002 mg·mL-1、0.004 mg·mL-1、0.006 mg·mL-1、0.008 mg·mL-1、0.01 mg·mL-1的样品溶液。将3 mL样品溶液与2 mL 1×10-4mol·L-1DPPH自由基溶液在室温下混合均匀后,避光静置30 min,以相应溶剂为参比测定520 nm处吸光度;以VC为阳性对照。每个样品平行测定3次,按式(2)计算DPPH自由基清除率:
(2)
式中:A0为2 mL DPPH+3 mL无水乙醇的吸光度;A1为2 mL无水乙醇+3 mL样品溶液的吸光度;A2为2 mL DPPH+3 mL样品溶液的吸光度。
同法测定荭草苷和牡荆素对DPPH自由基的清除率。
1.7.2 ABTS自由基清除实验
在文献[13]的基础上进行改进。将10 mmol·L-1ABTS自由基溶液与10 mmol·L-1K2S2O8溶液混合,过夜静置16 h,得ABTS储备液,用无水乙醇稀释,使其在734 nm处吸光度为0.70±0.02。配制0.4 mg·mL-1阿尔泰金莲花提取物溶液,分别稀释成0.05 mg·mL-1、0.10 mg·mL-1、0.15 mg·mL-1、0.20 mg·mL-1、0.25 mg·mL-1、0.30 mg·mL-1的样品溶液。将0.2 mL样品溶液与3.9 mL ABTS自由基溶液在室温下混合均匀后,避光静置15 min,以相应溶剂为参比测定吸光度;以VC为阳性对照。每个样品平行测3次,按式(3)计算ABTS自由基清除率:
(3)
式中:A0为3.9 mL ABTS +0.2 mL无水乙醇的吸光度;A1为3.9 mL无水乙醇+0.2 mL样品溶液的吸光度;A2为3.9 mL ABTS +0.2 mL样品溶液的吸光度。
同法测定荭草苷和牡荆素对ABTS自由基的清除率。

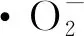
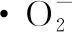
(4)
式中:A0为用1 mL无水乙醇代替样品溶液的吸光度;A1为1 mL 10 mmol·L-1HCl溶液代替邻苯三酚溶液的吸光度;A2为Tris-HCl缓冲液加不同浓度样品溶液的吸光度。
1.8 统计分析
采用SPSS 16.0软件进行数据统计分析,数据以x±s表示。首先通过Shapiro-Wilk检验确认数据是否服从正态分布,若方差齐,使用LSD-t检验进行组间比较,P<0.05表示具有显著性差异。
2 结果与讨论
2.1 阿尔泰金莲花提取物的最小抑菌浓度和最小杀菌浓度
微量稀释法测定结果显示,当阿尔泰金莲花提取物浓度≥12.5 mg·mL-1时,所对应的96孔板内的溶液均清澈透明,所以MIC为12.5 mg·mL-1。当阿尔泰金莲花提取物浓度为25 mg·mL-1时,BHI平板上没有细菌生长,所以MBC为25 mg·mL-1。
2.2 阿尔泰金莲花提取物的抑菌作用(图1)
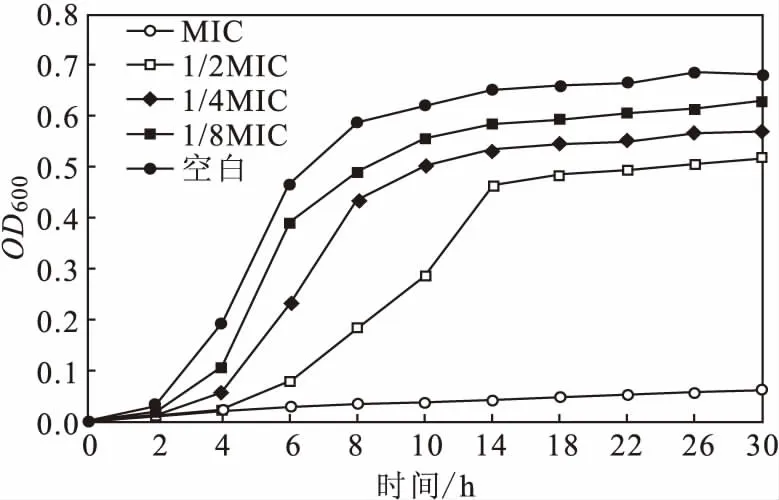
图1 阿尔泰金莲花提取物对变异链球菌的抑菌作用Fig.1 Antibacterial effect of Trollius altaicus extract on S.mutans
由图1可知,在培养的前14 h,药物组中变异链球菌的增殖速度均小于空白对照组。根据生长曲线可知,空白对照组在培养2 h后就进入了对数生长期;14 h后,各浓度阿尔泰金莲花提取物作用后变异链球菌的增殖速度减缓。与空白对照组相比,阿尔泰金莲花提取物浓度越大,变异链球菌进入对数生长期越晚。
2.3 阿尔泰金莲花提取物对变异链球菌产酸的影响(表1)

表1 不同浓度阿尔泰金莲花提取物对变异链球菌产酸的影响
由表1可知,药物组随着阿尔泰金莲花提取物浓度的增大,ΔpH值从0.49±0.03下降到0.09±0.03。各浓度药物组培养液的ΔpH值均低于空白对照组的ΔpH值,具有显著性差异(P<0.05)。
2.4 阿尔泰金莲花提取物对变异链球菌LDH活性的影响(图2)
由图2可知,与空白对照组相比,各浓度阿尔泰金莲花提取物作用于变异链球菌后,LDH活性均显著降低(P<0.05);且随着药物浓度的增大,LDH活性呈下降趋势,表明阿尔泰金莲花提取物抑制LDH活性能力逐渐增强。

图2 阿尔泰金莲花提取物对变异链球菌乳酸脱 氢酶活性的影响Fig.2 Effect of Trollius altaicus extract on LDH activity of S.mutans
2.5 阿尔泰金莲花提取物的抗氧化活性
2.5.1 阿尔泰金莲花提取物对DPPH自由基的清除作用(图3)
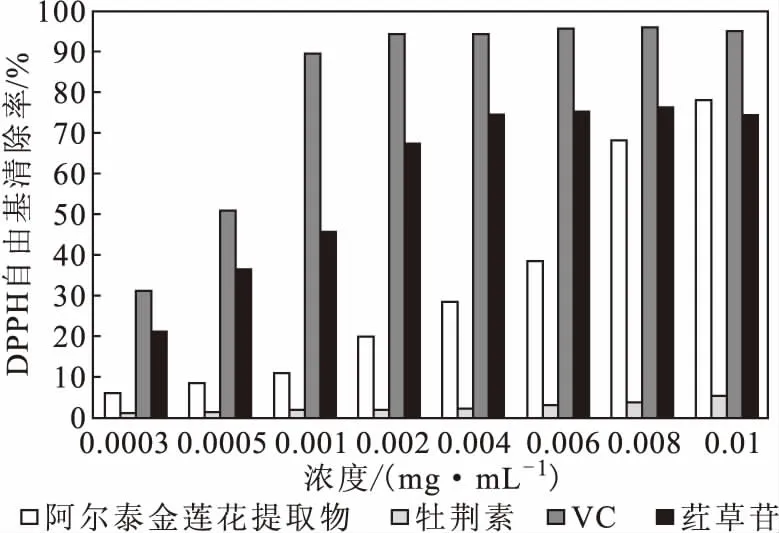
图3 阿尔泰金莲花提取物对DPPH自由基的清除作用Fig.3 Scavenging effect of Trollius altaicus extract on DPPH free radicals
由图3可知,除牡荆素外,阿尔泰金莲花提取物、荭草苷、VC在一定浓度范围内对DPPH自由基的清除作用具有一定的量效关系。当浓度低于0.008 mg·mL-1时,对DPPH自由基的清除率大小依次为VC>荭草苷>阿尔泰金莲花提取物>牡荆素。
2.5.2 阿尔泰金莲花提取物对ABTS自由基的清除作用(图4)
由图4可知,随着浓度的增大,牡荆素与阿尔泰金莲花提取物对ABTS自由基的清除率逐渐升高,但量效关系不明显;VC与荭草苷对ABTS自由基的清除率逐渐升高,且具有一定的量效关系。当VC与红草苷基本将ABTS自由基清除完全时,阿尔泰金莲花提取物对ABTS自由基的清除率为49.48%,牡荆素仅为10.41%。在一定浓度范围内,对ABTS自由基的清除率大小依次为VC>荭草苷>阿尔泰金莲花提取物>牡荆素;当浓度超过0.15 mg·mL-1后,VC与荭草苷对ABTS自由基的清除率基本保持不变,说明这2种药物对ABTS自由基的清除作用已经达到饱和,且荭草苷对ABTS自由基的清除作用与VC基本相当。
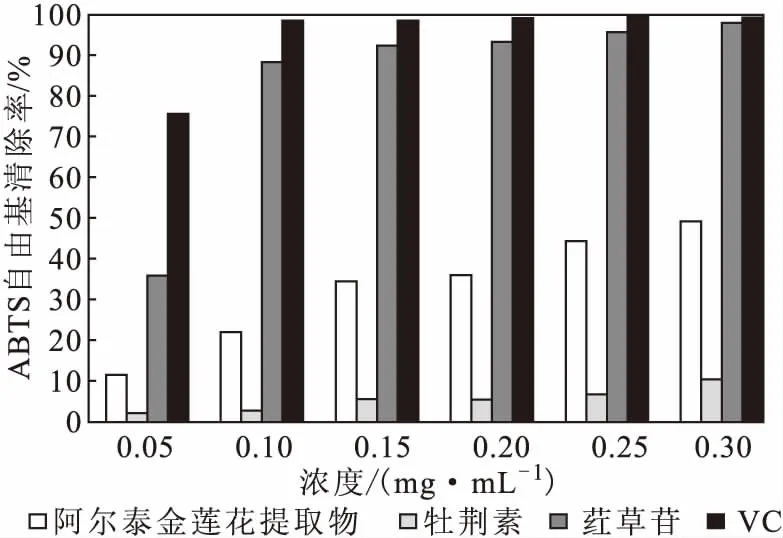
图4 阿尔泰金莲花提取物对ABTS自由基的清除作用Fig.4 Scavenging effect of Trollius altaicus extract on ABTS free radicals

图5 阿尔泰金莲花提取物对的清除作用Fig.5 Scavenging effect of Trollius altaicus extract on
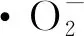
2.6 讨论
龋齿是一种常见的慢性细菌感染性口腔疾病,糖摄入量以及口腔卫生习惯、口腔菌群的改变都是导致龋齿产生的关键原因。现广泛采用抗生素和氟化物治疗,虽然具有一定的治疗效果,但是在使用过程中出现的耐药性以及抗生素滥用等现象也引起人们的广泛关注。近年来,研究者更加关注天然产物在口腔疾病方面的应用。
变异链球菌可以在牙釉质表面形成菌斑生物膜从而可以不受外界环境干扰定植在口腔中[15],形成的生物膜成为隔绝变异链球菌与外界环境的有利屏障,使膜内的细菌生长在厌氧和酸性的环境中[16],从而给龋齿的发生提供了有利的环境条件。因此,抑制变异链球菌的生长和降低LDH活性是治疗口腔疾病的关键。对口腔致龋菌的研究需要从药物对变异链球菌的生长、酸代谢、LDH活性的影响以及清除自由基等多方面进行。
本研究通过微量稀释法测定了阿尔泰金莲花提取物对变异链球菌的MIC与MBC值,测得MIC值为12.5 mg·mL-1,MBC值为25 mg·mL-1。通过绘制变异链球菌的生长曲线,可以直观地反映阿尔泰金莲花提取物浓度对其生长水平的影响。结果表明,在本实验设定的浓度范围内,阿尔泰金莲花提取物的浓度越大,对变异链球菌生长的抑制作用越强。
变异链球菌的产酸能力与致龋能力具有相关性。产酸实验结果表明,随着阿尔泰金莲花提取物浓度的增大,ΔpH值逐渐减小,抑制产酸作用逐渐增强。综上,阿尔泰金莲花提取物不仅能有效抑制变异链球菌的生长,还能抑制其产酸。
研究发现,变异链球菌的产酸能力除受其它信使分子的调控外[17],LDH也是其产酸过程中的重要因子。LDH在菌体内部和外部均有分布,可以通过菌悬液测定其活性[18]。以1/8MIC~MIC浓度的阿尔泰金莲花提取液作用于变异链球菌后,药物组菌悬液的LDH活性较空白对照组明显下降(P<0.05)。可初步推断,阿尔泰金莲花提取物抑制变异链球菌的作用途径为:通过抑制LDH活性,影响丙酮酸向乳酸的转化,从而抑制变异链球菌产酸,降低培养液pH值。
3 结论