卵泡期高孕激素状态下促排卵方案与微刺激方案应用于卵巢低反应人群的效果比较
徐少蓉,吴延,周孟君,赖婷,李丹,马琴芹,路巍,李俊林,何玮,李润,郭翠翠,张耀
(绵阳市中心医院,绵阳 621000)
随着现代社会环境的变化以及人们生活习惯的改变,不孕不育发生率逐年增加;自2016年二胎政策全面放开以来,有生育要求的高龄女性越来越多[1]。同时由于环境因素、遗传因素、社会因素以及生活习惯和工作压力等诸多因素的影响,卵巢储备功能减退(DOR)患者的比例越来越高,在接受辅助生殖技术(ART)的不孕患者中约占10%[2]。高龄和DOR患者在体外受精/卵胞浆内单精子注射-胚胎移植(IVF/ICSI-ET)助孕时常表现为卵巢低反应(POR),控制性促排卵(COS)过程中容易出现促性腺激素(Gn)用量大、发育的卵泡少、获卵数少的现象,导致临床妊娠率降低、周期取消率升高[3]。为了有效解决上述问题,生殖领域医生进行了许多尝试,比如应用不同的降调节方案、给予不同的促排卵药物剂量、添加雄激素[如脱氢表雄酮(DHEA)]或者小剂量的生长激素(GH)以及采用中医药治疗等,但目前仍没有针对POR患者最佳助孕方案的临床指南和共识,如何为这类患者选择合适有效的COS方案,改善其促排卵结局,最终提高其临床妊娠率,是目前辅助生殖领域的研究热点和难点之一。
近年来Kuang等[4]进行黄体期促排卵,未发生早发LH峰,并且获得了理想的妊娠结局;该团队继续对卵巢储备功能正常的不孕症患者采用高孕激素状态下促排卵方案(PPOS方案)发现,PPOS方案可以有效抑制早发LH峰,获得理想的妊娠结局[5]。目前已有诸多研究证实PPOS方案应用于POR、卵巢反应正常以及高反应人群,均能有效抑制早发LH峰并获得较理想的临床结局[6-12],尤其在POR患者中更具优势,但该观点尚缺乏大样本多中心研究支持,且PPOS方案在各生殖中心的临床应用尚不广泛,其卫生经济学效益等仍有待进一步研究。因此,本研究采用前瞻性研究的方法,对POR患者分别应用PPOS方案与微刺激方案促排卵,比较两种方案的促排卵结局和胚胎实验室指标,旨在探讨PPOS方案应用于POR患者的临床价值。
资料与方法
一、研究对象
收集2017年9月至2019年12月在我院生殖医学中心接受IVF/ICSI-ET助孕治疗的POR患者的临床资料(共74个周期)。纳入标准:符合2011年欧洲人类胚胎与生殖学会(ESHER)和美国生殖医学协会(ASRM)在意大利博洛尼亚讨论并制定的POR诊断共识[13]:(1)年龄≥40岁或存在卵巢反应不良的其它危险因素;(2)前次IVF周期出现POR,常规促排卵方案获卵数≤3个;(3)卵巢储备功能下降:基础窦卵泡数(AFC)<5~7个或抗苗勒管激素(AMH)<0.5~1.1 mg/L;如果年龄<40岁或卵巢储备功能检测正常,患者连续2个周期应用最大化的卵巢刺激方案仍出现POR也可诊断;至少满足以上3条中的2条即可诊断为POR。所有患者均符合《人类辅助生殖技术规范》的适应证并排除禁忌证。排除标准:(1)夫妻任何一方患有严重的精神疾患、泌尿生殖系统急性感染、性传播疾病;(2)患有《母婴保健法》规定的不宜生育、目前无法进行产前诊断或胚胎植入前遗传学诊断(PGD)的遗传性疾病;(3)夫妻任何一方有吸毒等严重不良嗜好;(4)夫妻任何一方接触致畸量的射线、毒物、药品并处于作用期;(5)女方子宫不具备妊娠功能或患有严重躯体疾病不能承受妊娠。
本研究所有纳入的患者由同一高年资医师进行沟通,患者在充分知情理解后自愿选择PPOS方案或微刺激方案,并签署治疗同意书。本研究取得我院生殖医学伦理委员会审核同意。
按照COS方案不同将研究对象分为两组:PPOS组(55个周期)和微刺激组(19个周期)。
二、研究方法
1.COS方案:(1)PPOS方案:在月经周期第2~3天开始给予安宫黄体酮(浙江仙琚制药)10 mg/d至扳机日,同时根据患者年龄、体重指数(BMI)、AFC、AMH、基础FSH(bFSH)、bFSH/bLH比值和既往促排卵卵巢反应情况,开始使用丽申宝(珠海丽珠制药)和/或HMG(珠海丽珠制药)150~300 U/d,促排治疗4 d后行阴道B超监测卵泡发育情况,同时监测血清FSH、LH、E2、P水平,并根据血清性激素水平和卵泡发育情况调整促排卵药物的剂量。(2)微刺激方案:在月经周期第2~3天开始给予克罗米芬(高特制药,塞浦路斯)50~100 mg或来曲唑(江苏恒瑞医药)2.5~5.0 mg口服5 d,5 d后行阴道B超监测卵泡发育情况,同时监测血清性激素水平,并根据血清性激素水平和卵泡发育情况增加或不增加丽申宝和/或HMG 150~300 U/d,如血清LH水平超过bLH水平2倍以上,或卵泡直径≥14 mm,则皮下注射促性腺激素释放激素拮抗剂(GnRH-ant,默沙东,美国)抑制早发LH峰。
两组患者中当有1个以上直径≥20 mm的卵泡或者3个以上直径≥18 mm的卵泡时,当晚给予重组人绒毛膜促性腺激素(rHCG,艾泽,默克雪兰诺,意大利)250 μg扳机,36 h后取卵。
2.取卵及IVF:在阴道超声引导下行取卵术,依次抽吸所有直径10 mm以上的卵泡。IVF方式根据男方精液情况和既往受精情况评估决定,行常规IVF或ICSI受精。按照本中心常规操作进行胚胎培养,并根据胚胎发育过程中卵裂球大小、形态及碎片比例等指标将卵裂期胚胎分为Ⅰ~Ⅳ级[14]:Ⅰ级胚胎:卵裂球大小均匀,形状规则,透明带完整;胞质均质、清晰;胚胎内碎片≤5%。Ⅱ级胚胎:卵裂球大小略不均匀,形状略不规则;胞质均匀或存在少量空泡;碎片6~20%。Ⅲ级胚胎:卵裂球大小明显不均匀,可有明显的形状不规则;胞质可有明显颗粒或大量空泡;碎片20~50%。Ⅳ级胚胎:细胞大小严重不均匀;胞质可有严重颗粒现象,变黑,或有大量空泡;碎片超过50%。将来源于正常受精卵,且受精后第3天胚胎细胞数7~9个,评分为Ⅰ~Ⅱ级的胚胎定义为D3优质胚胎;将来源于0PN、1PN、2PN的受精卵,受精后D3胚胎细胞数4~11个,评分为Ⅰ~Ⅲ级的胚胎定义为D3可利用胚胎。
因PPOS方案与微刺激方案均影响子宫内膜容受性,故全部取消新鲜周期移植,行全胚胎冷冻,择期行冻融胚胎移植(FET)。
3. FET及妊娠判断:所有解冻周期患者均选择激素替代治疗(HRT)准备内膜,于月经周期第3天起,口服天然雌激素,起始剂量4 mg/d,每4 d增加剂量2 mg/d,至8 mg/d,通常雌激素使用时间≥12 d。当子宫内膜厚度≥8 mm时,参考当日血清E2、P水平,给予黄体酮注射液(浙江仙琚制药)60 mg/d或黄体酮阴道缓释凝胶(默克雪兰诺,美国)90 mg/d。孕激素用药第4日移植D3胚胎,第6日移植D5/D6囊胚,移植后继续使用雌孕激素,可添加地屈孕酮(雅培,荷兰)20 mg/d,行黄体支持至孕12周。移植后12/14日测血β-HCG值≥25 U/L确定生化妊娠,移植后28/30日B超见孕囊者确定为临床妊娠。
4.观察指标:主要评价指标有:早发LH峰发生情况、获卵数、MⅡ卵率、正常受精率、卵裂率、优质胚胎率、可利用胚胎率等。早发LH峰指扳机前LH>10 U/L。
三、统计学分析

结 果
一、两组患者一般资料比较
经Mann-WhitneyU检验显示,PPOS组和微刺激组患者的年龄、不孕年限、BMI、AMH、AFC、bFSH、bLH、bE2等比较均无显著性差异(P>0.05),提示两组患者具有可比性(表1)。
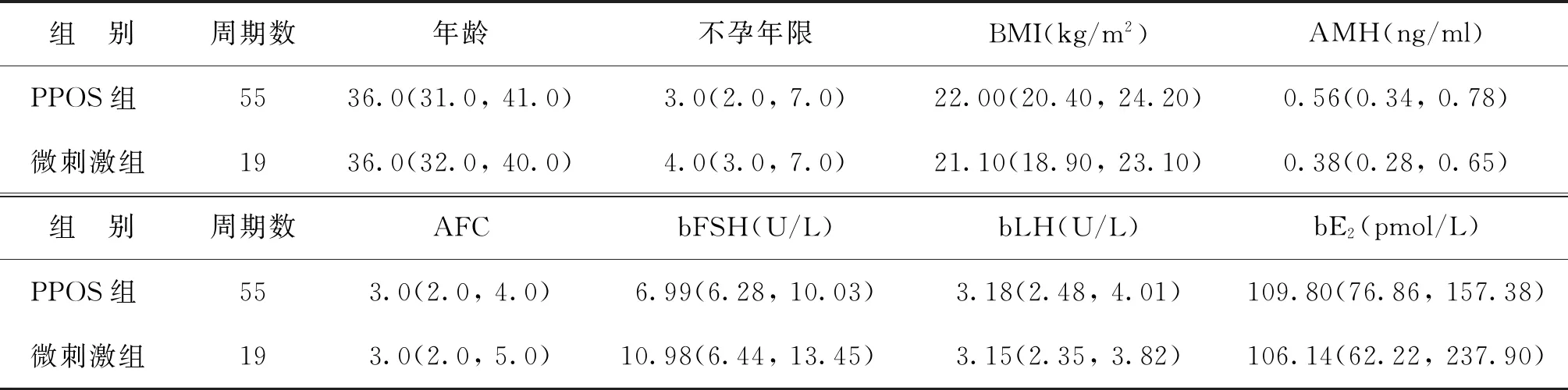
表1 两组患者一般情况比较[M(P25,P75)]
二、两组患者促排卵情况比较
经Mann-WhitneyU检验显示,PPOS组的Gn天数、Gn总量、HCG日E2水平、HCG日≥14 mm卵泡数显著高于微刺激组(P<0.05);PPOS组HCG日LH水平显著低于微刺激组(P<0.05);两组HCG日P水平比较无显著性差异(P>0.05)(表2)。PPOS组无早发LH峰出现,微刺激组发生2例早发LH峰。
三、两组患者胚胎实验室指标比较
PPOS组获卵数显著高于微刺激组(3.0 vs. 2.0)(P<0.05);PPOS组与微刺激组的MⅡ卵率(94.6% vs. 95.5%)、正常受精率(67.7% vs. 64.3%)、卵裂率(97.0% vs. 97.4%)、优质胚胎率(46.8% vs. 29.6%)、可利用胚胎率(69.8% vs. 52.6%)比较均无显著性差异(P>0.05)(表3)。

表2 两组患者促排卵情况比较[M(P25,P75)]

表3 两组患者胚胎实验室指标比较[M(P25,P75),%]
四、两组患者临床妊娠情况
PPOS组行HRT-FET共37个周期,临床妊娠6例,其中宫内单胎5例,宫内双胎1例,活产1例健康男婴,其余5例至文章撰写时尚未分娩;微刺激组行HRT-FET共11个周期,临床妊娠3例,全是宫内单胎,至文章撰写时尚未分娩。因样本量少,且至撰文时微刺激组尚未有妊娠结局,因此未对两组的妊娠结局进行统计学分析。
讨 论
POR在人群中的发病率越来越高,尤其在≥40岁的高龄女性中发生率超过50%[15],POR患者在助孕过程中对Gn反应差,用药剂量大,获卵少,胚胎质量差,促排卵效果不理想,难以获得理想的妊娠结局[16]。目前在临床工作中,微刺激方案、拮抗剂方案、自然周期和短效长方案等均有应用于POR患者,但降调节方案可能导致卵巢过度抑制,导致Gn用量大、用药时间长,药物耗费高,用药复杂等现象。自然周期、微刺激方案以及拮抗剂方案虽然简单,但无法完全避免早发LH峰导致的周期取消,卵泡早期LH升高还可能会对卵子质量产生负面影响[17]。因此寻找合适的COS方案,尽快获取高质量的卵子和胚胎,是改善POR患者临床结局的关键。本研究分析了POR患者使用PPOS方案(55个周期)的临床疗效,研究结果显示PPOS方案可以明显改善卵巢的反应性,同时有效抑制早发LH峰,不失为POR患者的一种可选促排卵方案。PPOS方案的有效机制是在雌激素水平上升前给予孕激素,使下丘脑孕激素化,以阻断雌激素诱导的正反馈作用,抑制早发LH峰的发生;且该方案不干扰下丘脑GnRH受体功能,并不抑制垂体Gn的脉冲式分泌。同时,孕激素具有拮抗雌激素的作用,该作用对于临床常见的雌激素依赖性疾病(如子宫内膜异位症、子宫肌瘤等)具有一定的缓解作用[18]。
PPOS方案临床运用的有效性已被较多研究证实。张欣等[6]研究显示PPOS方案在高龄患者中能显著提高卵母细胞受精率、优质胚胎率。沈秀等[7]将PPOS方案应用于FSH升高的DOR患者,发现其能有效抑制LH峰,提高优质胚胎率。叶静等[8]在卵巢功能正常患者中应用PPOS方案,发现其获卵数、成熟卵数、可利用胚胎数及随后FET周期中的临床妊娠率等均与短方案相似。杨菁等[9]发现PPOS方案在POR患者中能较好地抑制早发LH峰,增加可移植胚胎率。郭丽娜等[10]对长方案促排后助孕未获成功的卵巢正常反应患者应用PPOS方案发现,PPOS方案可以改善胚胎质量,获得较好的临床妊娠结局。颜晓红等[11]认为PPOS方案不仅经济简便,且其应用于POR患者可以有效抑制早发LH峰,获得满意的胚胎质量。本研究中,PPOS方案的获卵数显著优于微刺激方案,证明PPOS方案能改善POR患者的卵巢反应性。PPOS组患者均无早发LH峰出现,微刺激组2例患者出现早发LH峰,证明PPOS方案能有效抑制早发LH峰。两组方案的MⅡ卵率、正常受精率、卵裂率、优质胚胎率等比较均无显著性差异。
PPOS方案持续应用外源性孕激素是否会对卵子质量造成影响进而威胁子代安全,是生殖医师关注的重点。Venetis等[19]对60 000多个促排卵周期的资料行Meta分析表明,高孕激素水平主要影响本次促排周期的子宫内膜容受性,对卵泡发育和胚胎质量并无明显影响。Zhang等[20]对PPOS方案促排卵获得的新生儿(n=1 931)随访后观察到,与传统的短方案(n=1 658)和微刺激方案(n=1 007)相比,PPOS方案促排卵后获得的新生儿在不良出生结局和畸形率等方面的风险并没有增加。Chen等[21]回顾性分析587例新生儿的出生缺陷发生情况,证明了黄体期促排卵的子代安全性,而PPOS方案与黄体期促排卵方案均是高孕激素状态下促排卵,且PPOS方案更接近生理性卵泡生长。但因为本研究样本量有限,还有一部分患者的胚胎未移植,移植并妊娠的患者中仅PPOS组分娩1例健康男婴,微刺激方案中获得临床妊娠的患者至撰文时尚未分娩,故本研究无法验证PPOS方案的子代健康问题。
近年来随着FET技术的不断成熟,冻融胚胎复苏率逐年升高,提示冻融胚胎的质量及发育潜力未受到明显影响。国内外多项研究证实了FET技术的安全性[22-25],为PPOS方案全胚冷冻提供了技术支持。总之,PPOS方案作为一种新型、简单、经济、有效的方案,简化了促排卵过程,且能有效抑制早发LH峰,降低周期取消率,改善卵巢反应性,是一种适合POR患者的临床促排卵方案,但仍需多中心大样本的临床研究进一步观察验证,以期不断完善和优化PPOS方案,使其更好地应用于临床治疗。

