DNA损伤修复基因XRCC1 rs25487单核苷酸多态性与男性不育关系的Meta分析
杨蕊琼,惠玲,马俊,唐瑜
(1.甘肃中医药大学临床医学院,兰州 730000;2.联勤保障部队第940医院基础医学实验科 甘肃省干细胞与基因药物重点实验室,兰州 730050)
目前,全世界受到不孕不育症困扰的育龄夫妇约10%~15%左右,其中男性不育约占 50%[1]。与其他细胞相比生殖细胞对DNA损伤剂极其敏感,生殖细胞DNA的损伤被认为是导致生精失败和男性不育的主要原因之一[2-3]。然而,人类基因组中存在一套完整的DNA损伤修复系统可应对DNA损伤,从而保持基因组的完整性。DNA损伤修复系统可归纳为碱基切除修复(Base excision repair,BER)、核苷酸切除修复(Nucleotide excision repair,NER)、错配修复(Mismatch repair,MMR)和双链断裂修复(Double-strand break repair,DSBR)。X线修复交叉互补基因1(X-ray repair cross-complementary gene 1,XRCC1)是第一个被克隆出来的在BER途径中起关键作用的支架蛋白,可将不同成分招募到DNA损伤部位,提高BER修复途径的效率[4]。XRCC1基因位于19q13.2,包含17个外显子[5]。研究发现XRCC1单核苷酸多态性(Single nucleotide polymorphism,SNP)可能会改变DNA修复能力,并且可能会影响疾病易感性[6-7]。随着DNA 测序技术的发展,发现XRCC1基因常见的单核苷酸多态性有可能阻碍正常的精子发生,从而导致男性不育。目前XRCC1基因 Gln399Arg(rs25487)多态性与男性不育的关系尚存在争议。本研究纳入既往报道的相关文献,采用Meta分析以综合评价XRCC1 rs25487多态性与男性不育发病风险之间的关系。
资料与方法
一、文献检索
通过计算机系统检索PubMed、中国生物医学文献数据库(CBM)、中国知网及万方数据库中已发表的涉及XRCC1基因多态性与男性不育相关性的研究。中文数据库中关键词选择“人类X线修复交叉互补基因1”“基因多态性”“XRCC1”“rs25487”及“男性不育”等。英文数据库检索词选择“X-ray repair cross-complementary gene 1”“XRCC1”“SNP”“rs25487”“polymorphism”和“male infertility”“Oligozoospermia”等。
二、文献选择标准
1. 纳入标准:(1)公开发表的评价XRCC1单核苷酸多态性与男性不育相关性的中英文病例-对照研究;(2)研究对象为男性不育症患者;(3)报道了病例组和对照组的各基因型频数,并能计算出优势比(OR)及其95%可信区间(95%CI);(4)同一研究若重复发表时取最新发表的文献;(5)对照组基因型分布遵循哈迪-温伯格平衡(Hard-Weinberg equilibrium,HWE)检验。
2. 排除标准:(1)研究类型不是病例对照研究;(2)不能获取原始数据,无法计算OR及95%CI;(3)对照组的基因型分布不符合HWE;(4)研究数据重复使用;(5)实验设计不严谨的文献。
三、文献筛选及质量分析
文献筛选工作由两名研究人员严格按照纳入及排除标准进行,并采用Endnote软件筛选,互相核对,出现结果差异时与第3位评价员通过协商解决。对所纳入文献采用Newcastle-Ottawa scale(NOS)标准进行质量分析。
四、数据提取
对纳入的文献提取下列数据:(1)研究的基本信息(第一作者姓名、发表时间、研究地点、研究人群、研究类型);(2)基因分型方法,包括聚合酶链式反应(PCR)、限制性片段长度多态性(Polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)、水解探针法(TaqMan)等;(3)数据的信息(病例组和对照组人数、病例组和对照组的各基因型和等位基因频数、HWE检验的P值等)。
五、统计学分析
将所纳入的数据运用Review Manager 5.3软件进行统计学处理,采用OR及95%CI进行数据分析,以P<0.05为差异具有统计学意义。利用HWE确认研究样本的群体代表性(若P>0.05,表示研究对照组的结果符合HWE;若P<0.05,表明不符合HWE)。异质性检验采用P和I2检验,若I2>50%以及P<0.05则说明具有显著异质性,需采用随机效应模型进行分析;若P≥0.05提示异质性较小时则采用固定效应模型进行分析,同时计算OR值和95%CI,并分析引起异质性可能的因素。I2<25%,25%≤I2<50%,I2≥50%,分别表示低度、中度和高度异质性。最后通过egger’s检验和漏斗图评估本项研究是否存在发表偏倚。
结 果
一、纳入文献基本情况
按检索策略,初步检索到相关文献95篇,按剔除标准剔除82篇,得到13篇,通读全文后排除5篇,再根据是否符合HWE检验又剔除1篇[8],最终纳入7篇文献[9-15](图1)。发表年份为2007~2019年,研究人群为亚洲人和高加索人。所有研究中对照组基因型分布均符合HWE平衡。基因分型的方法为PCR-RFLP。各项研究病例组均已排除具有导致精子发生障碍的原因,精液检查为无精子症或严重少精子症不育男性;对照组为正常的健康男性(表1)。

图1 文献的纳入与排除过程
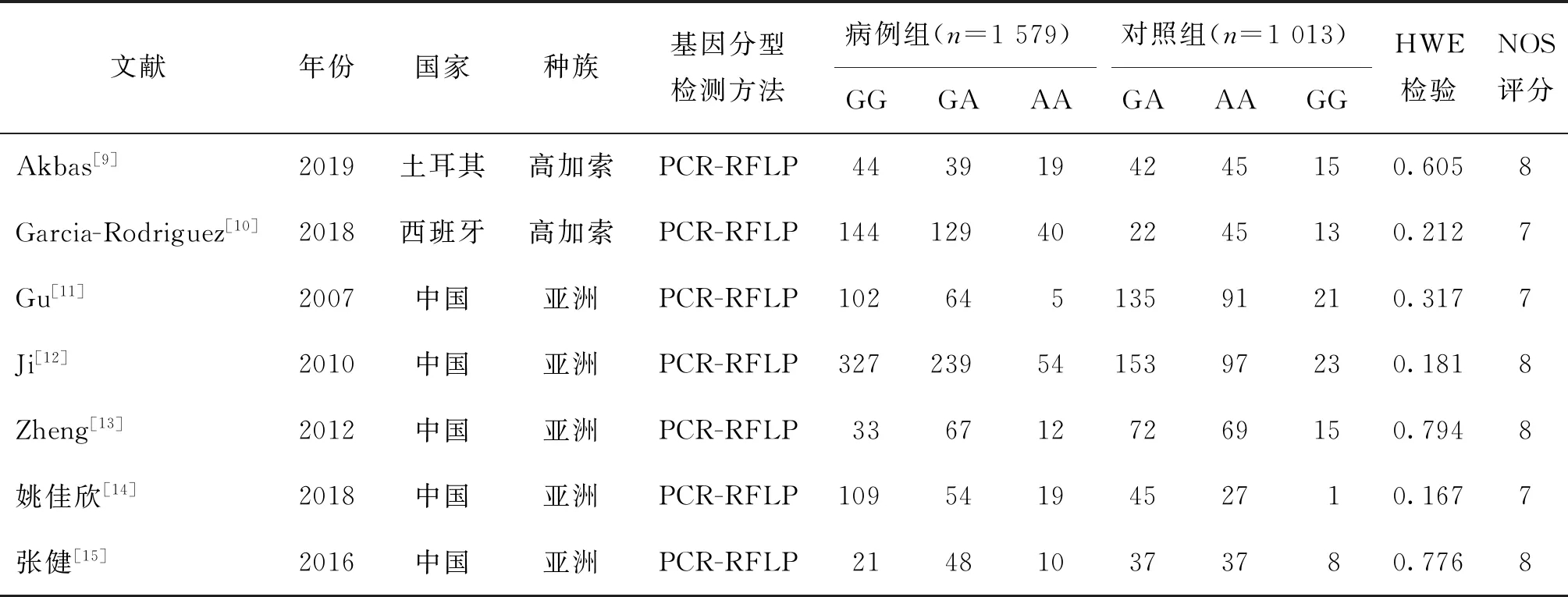
表1 Meta分析中7篇文献 XRCC1 rs25487基因型的主要特征
二、Meta分析结果
1. 等位基因模型与男性不育的Meta分析:结果显示,等位基因模型A vs. G:OR=1.06,95%CI(0.83,1.36),P=0.64。提示在等位基因模型中XRCC1 rs25487与男性不育发生无明显相关性(图2)。
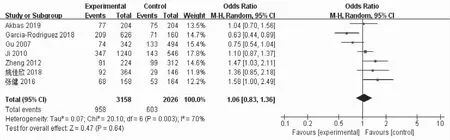
图2 等位基因模型与男性不育的Meta分析(A vs. G)
2. 显性模型与男性不育的Meta分析:结果显示,显性模型AA+AG vs. GG:OR=1.08,95%CI(0.76,1.54),P=0.67。提示在显性模型中XRCC1 rs25487与男性不育发生无明显相关性(图3)。

图3 显性模型与男性不育的Meta分析(AA+AG vs. GG)
3.隐性模型与男性不育的Meta分析:结果显示,隐性模型AA vs. GG+AG:OR=1.03,95%CI(0.77,1.36),P=0.85。提示在隐性模型中XRCC1 rs25487与男性不育发生无明显相关性(图4)。

图4 隐性模型与男性不育的Meta分析(AA vs. GG+AG)
4.纯合模型与男性不育的Meta分析:结果显示,纯合模型AA vs. GG:OR=1.03,95%CI(0.77,1.36),P=0.85。提示在纯合模型中XRCC1 rs25487与男性不育发生无明显相关性(图5)。

图5 纯合模型与男性s不育的Meta分析(AA vs. GG)
5.杂合模型与男性不育的Meta分析:结果显示,杂合模型AG vs. GG:OR=1.04,95%CI(0.72,1.51),P=0.82。提示在杂合模型中XRCC1 rs25487与男性不育发生无明显相关性(图6)。

图6 杂合模型与男性不育的Meta分析(AG vs. GG)
6.分层分析XRCC1 rs25487多态性与男性不育发生之间的危险因素:根据种族和病例数(>200和<200)不同进一步分层分析,在5种比较模型中,结果显示差异无统计学意义(P>0.05),表明种族和病例数不是XRCC1 rs25487多态性与男性不育发生之间的危险因素(表2)。
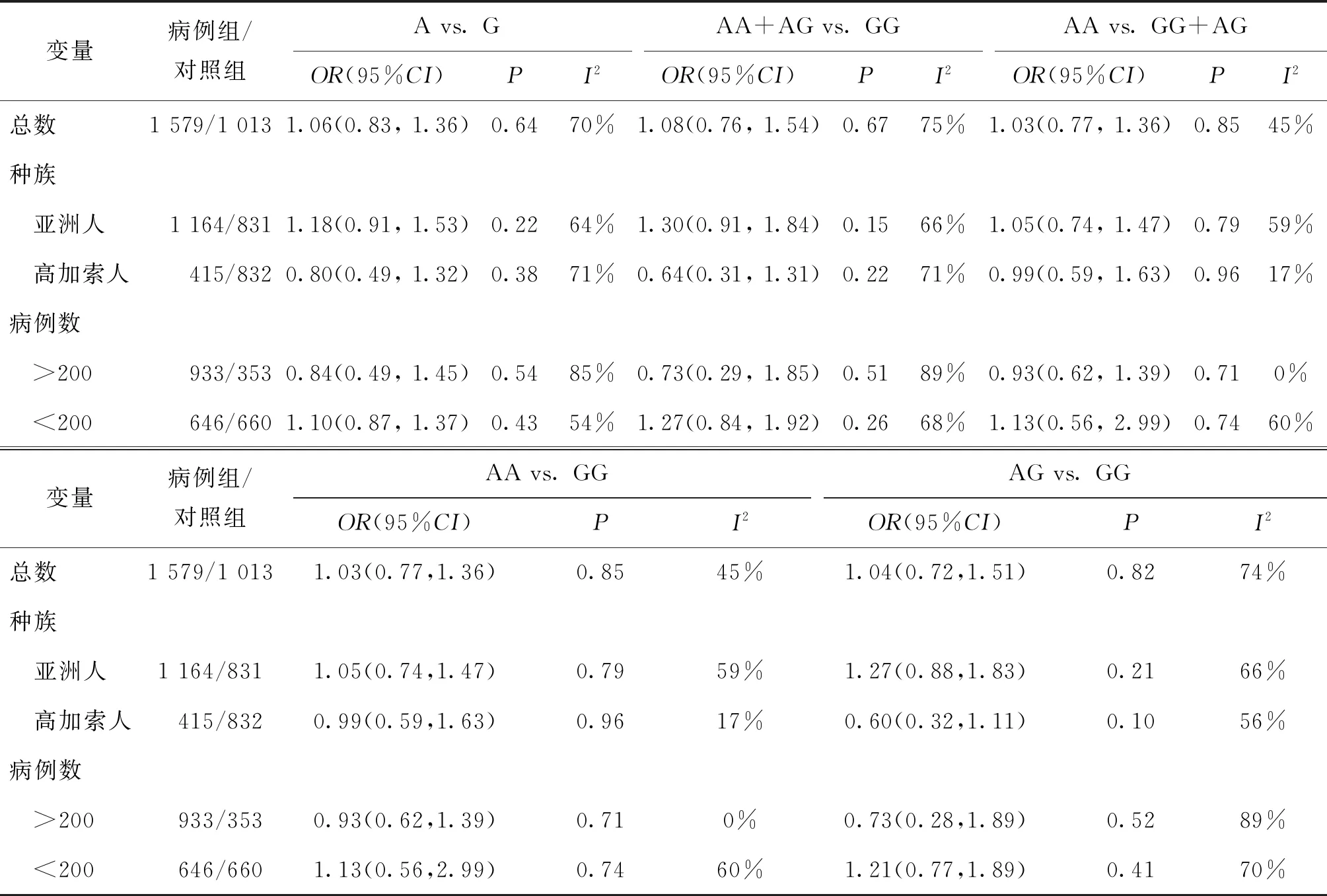
表2 XRCC1 rs25487在5种比较模型中的结果
三、敏感性和发表偏倚分析
将5种基因型模型中的单个研究逐个剔除后重新获得其他研究合并的OR值及95%CI,结果显示剔除单个研究后Meta分析结果均未发生显著变化,可以判定最终的合并效应量较稳定。但在剔除Garcia-Rodriguez(2018)等[10]、Gu(2007)等[11]两篇文献后5种模型比较中的异质性均有不同程度的降低,并且结果显示在等位基因模型中A vs. G:OR=1.23,95%CI(1.05,1.43)(P=0.009),说明这两篇文章是异质性的主要来源(表3)。采用egger’s检验和绘制漏斗图形,结果显示等位基因模型、显性模型、隐性模型、纯合模型和杂合模型的漏斗图基本对称,没有明显的发表偏倚情况(图7)。
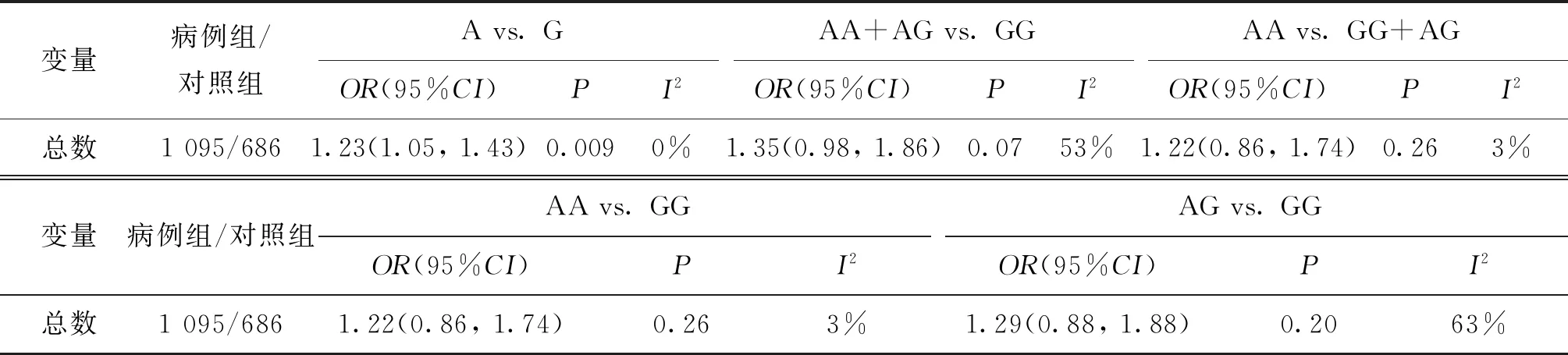
表3 XRCC1 rs25487在5种比较模型中调整后的结果
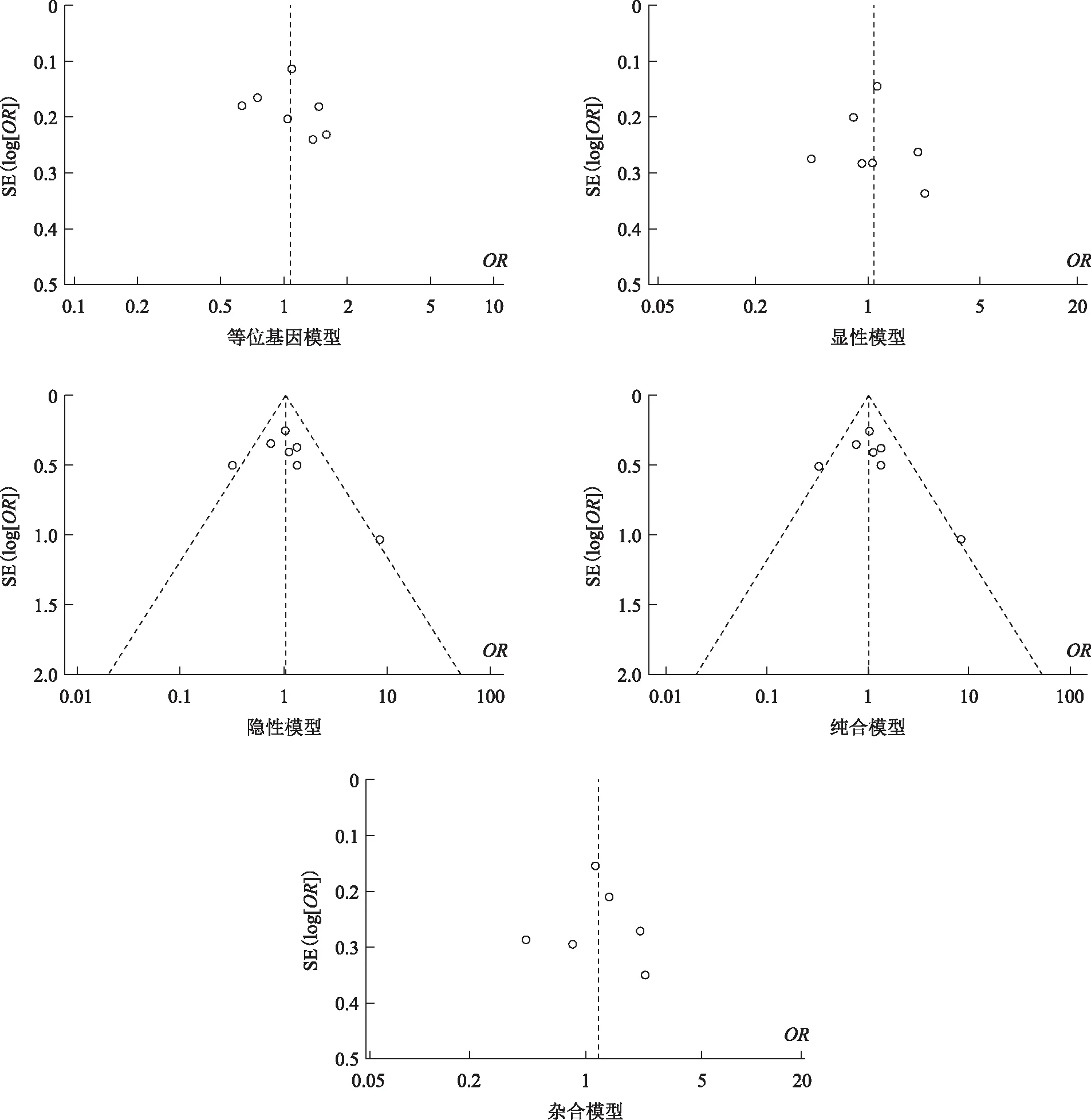
图7 XRCC1 rs25487在5种比较模型中的Meta分析漏斗图
讨 论
男性不育的发生受多种因素的干扰,而遗传因素占主导地位,其中精子的发生最为关键。精子的产生是一个多步骤、多条件、多阶段的过程。生精细胞如持续受到内源性物质(如活性氧等)和外源性物质(例如射线、化学毒物等)影响,会导致大量DNA受损,继而造成男性生育功能障碍[16]。因此,通过DNA修复维持精子DNA的完整性是男性正常生育的一项重要环节。XRCC1基因在BER修复途径中起重要作用,其作为连接体与DNA聚酶β、 DNA连接酶Ⅲ、多聚ADP核糖聚合酶以及多核苷酸激酶等结合,通过一系列反应形成DNA损伤修复系统,参与各种损伤造成的碱基切除修复和单链断裂修复[17-18]。DNA修复能力减弱可能会增加生殖细胞及生精相关基因的突变风险,进一步导致精子发生的失败,引起精子减少甚至出现无精子症[19]。从2007年开始,一些病例对照研究发现XRCC1基因多态性可能会增加男性不育的风险[11]。近年来,关于XRCC1基因多态性rs25487与男性不育发生的相关性实验研究有很多,但结果存在较大的争议。本文所纳入的7篇文献中,Garcia-Rodriguez等[10]、Gu等[11]、Zheng等[13]、姚佳欣等[14]和张健等[15]的研究结果认为XRCC1 rs25487基因多态性与男性不育有相关性,而Akbas等[9]和Ji等[12]的研究结论认为没有相关性。后来,Singh等[20]的研究也发现XRCC1 rs25487与男性不育无相关性。可见不同的研究由于研究背景及人群的不同结果也会有所差异。因此,本研究运用Meta分析方法对所纳入的既往文献进行整理综合统计,以期得到更为客观、真实的评价结果用于指导临床和实验研究。
本研究共纳入7篇病例对照试验,其中病例组1 579例,对照组1 013例。对各项纳入研究进行HWE检验,均符合平衡(P>0.05)。整体分析显示,在5种比较模型中,XRCC1 rs25487多态性与男性不育发生之间无相关性。异质性检验提示各项研究均存在中、高度异质性,当去除Garcia-Rodriguez(2018)等[10],Gu(2007)等[11]两篇文献后,5种模型比较中的异质性均有不同程度的降低,说明这两篇文献是主要异质性的来源。我们根据种族和病例数(>200和<200)不同进一步分层分析显示,亚组分析结果显示差异仍无统计学意义(P>0.05)。发表偏倚情况采用egger’s检验和绘制漏斗图形,未发现明显的发表偏倚,证明研究结论可靠。
本次Meta分析虽然按照严格纳入标准和文献筛选过程进行,但仍存在一些不足。首先,文献纳入数量较少,仅有7篇,数据分析结果存在一定偶然性误差;其次,纳入人群仅为亚洲人和高加索人,由于不同种族的生活习俗、遗传背景及饮食习惯的差异可能对本结果的稳定性产生干扰;最后,部分患者的详细信息(生活习俗、工作状态、身体状况及家族病史情况等)文献中采集不够准确,存在一定干扰因素。因此,后续有待于临床上开展多中心、大样本的高质量病例对照或队列研究以获得更严谨、科学的结论。

