酸碱胁迫对鳜血清pH、耗氧率及解毒相关基因表达的影响
张成硕,周昊天,曾萌冬,王艳玲,赵金良,赵 岩
(上海海洋大学,水产种质资源发掘与利用教育部重点实验室,水产动物遗传育种中心上海市协同创新中心,上海 201306)
水体的酸碱度是影响鱼类生活的重要环境因素[1]。淡水的缓冲能力较差,其酸碱度波动范围较大。对于池塘养殖而言,水体pH的昼夜波动可达到6.6~10.2[2]。近年来,国内工业快速发展导致酸雨愈加频繁,河流两岸碱性粉煤灰、氧化钙等违法乱排,以及养殖过程中残留饵料过多、药物的滥用及养殖密度过大等都加剧了水体pH变化[3-4]。酸碱环境变化(酸碱胁迫)对鱼类生长性能、物质代谢、免疫防御等方面的影响十分明显[5-9]。
化学防御系统是生物抵御环境中化学胁迫和维持内环境稳态的重要机制。解毒酶系(生物转化酶系)是化学防御系统的核心组分。有毒害的疏水化合物在这些酶的作用下,转化为更亲水的衍生物从生物体中排除[10-11]。目前,在人类药物代谢[12],植物适应逆境环境胁迫(干旱、高温、重金属[13-14]等),水生动物接触化学药剂(除草剂、杀虫剂[15-17]等)过程中均有关于生物化学防御机制的研究报道。但鱼类为适应水环境pH变化调动化学防御机制,进行的一系列生物转化尚缺乏系统深入的研究。
鳜(Sinipercachuatsi)属鲈形目鮨科鳜亚科鳜属,俗称桂花鱼,是我国重要的名贵淡水经济鱼类[18]。鳜鱼养殖对水质要求较高[19-20],对酸碱环境胁迫的适应机制有自身的特点。为了解酸碱胁迫对鳜的影响以及相应解毒作用,本研究对鳜进行不同pH的急性胁迫,测定72 h血清pH、耗氧率、CYP450、FMO、UGT和GST基因相对表达量的变化过程,从生理生化角度揭示酸碱对鳜的毒性及其适应机制,为其健康养殖与生产应用提供基础资料。
1 材料与方法
1.1 实验材料
实验用鳜取自于上海市浦东新区孙农水产养殖场。选取体质健康、规格基本一致,平均体重为(30±5)g的个体进行实验。于上海海洋大学养殖中心控温循环水族箱中暂养一周,每天投喂活饵料鱼,及时清理残饵和粪便,保证实验鱼的正常生理活动。实验前24 h停止喂食。试验用水为曝气48 h以上的自来水,水温(24.6±0.5)℃,pH为(7.5±0.1),溶解氧大于5 mg/L。
1.2 实验方法
1.2.1 样品采集和处理
根据预实验结果,用1 mol/L HCI和1 mol/L NaOH调节实验液pH,设置酸碱度分别为4.0、5.5、7.0、8.5、10.0。实验在透明水族箱(55 L)中进行。实验时,将实验鱼从水族箱内取出,直接放入实验组中,每组12尾,实验期间不投喂饵料,实验开始后,每隔5 h调整实验液一次,充氧1 h,每隔24 h更换实验液,胁迫后0、3、12、24、48、72 h进行采样。每组随机取2尾。
用1 mL一次性无菌注射器从鱼尾静脉处抽血,每尾鱼抽血时间不超过5 min,血液注入经抗凝剂处理的1.5 mL离心管中,4 ℃静置过夜,分层后离心(1 500 r/min,4 ℃,25 min),取出上层血清待用。抽血后的实验鱼,冰上解剖,快速取出脑、鳃、肝、肾组织,液氮速冻后,放入-80 ℃超低温冰箱保存。
1.2.2 血清pH测定
采用FE20-FiveEasy PlusTM pH测定血清pH。为保证血清能浸没探头,将分离获得的血清转移到自制柱状容器(内径1.5 cm)中测量。同一样本测量3次,取其平均值。
1.2.3 耗氧率测定
实验使用的溶氧仪为德国WTW multi3620便携式水质分析仪。实验组水族箱用保鲜膜封口,透明胶带固定,确保与空气隔绝,中间留1圆孔,大小与溶氧仪的传感器尺寸一致。实验开始后,每隔1 h测定水体中的溶氧量。用下式计算耗氧率:
1.2.4 细胞自噬小体的定量检测 不同浓度槐耳清膏(4、8、16、32mg/ml)作用 NCI-N87 细胞 24h 后,收集细胞,用浓度为1μg/ml吖啶橙室温条件下避光染色20min,离心之后弃染液,用1×PBS清洗3次后,PBS重悬细胞,上流式细胞仪检测,FL3通道检测红色荧光,FL1通道检测绿色荧光,红色荧光增强说明细胞内酸性自噬小体增多。

式中:R0为单位体重耗氧率[mg/(g/h)],C0、C1为试验前后水体的溶氧量(mg/L);V为水体体积(L);T为试验持续时间(h);W为鱼体总体质量(g)。
1.2.4 荧光定量PCR
脑、鳃、肝、肾研磨成粉末后,按照TRIzol®Reagent(Invitrogen)说明书提供的方法提取总RNA,使用核酸蛋白测定仪和琼脂糖凝胶电泳测定RNA的完整性,加入适量的RNase free ddH2O调整至1 000 ng/μL。用Prime ScriptRRT Reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒合成cDNA第一链,反转录产物于-20 ℃冰箱保存待用。
根据GenBank中鳜GST(GenBank登录号:EU719618.1)和UGT、CYP450、FMOcDNA序列(本实验室所测鳜转录组数据),用Primer Premier 5.0软件设计(表1),引物由金唯智(苏州)生物科技有限公司合成。

表1 定量PCR分析的引物序列
实时荧光定量PCR扩增体系如下(20 μL):10 μL TB GreenTM Premix EX TaqTM(TaKaRa),上下游引物(10 μmol/L)各0.8 μL,cDNA 1 μL,RNase-free water定容至20 μL。每个样本做3个重复,以β-actin为内参建立标准曲线以及溶解曲线。在MyiQ5荧光定量PCR仪上进行扩增反应,反应条件为预变性95 ℃ 30 s;变性95 ℃ 5 s,延伸 60 ℃ 30 s,循环40次。数据分析采用CFX Manager软件进行,基线值、阈值和阈循环值由软件自动设定,采取相对定量2-ΔΔCt法计算表达量。
1.3 统计分析
实验数据采用SPSS 19.0统计软件分析,单因素方差分析进行显著性检验,Duncan多重比较检测各测量指标的差异,以P<0.05为差异显著。利用Sigmaplot 10.0软件作图。
2 结果与分析
2.1 酸碱胁迫对鳜的行为影响
实验鳜放入pH=7的组中无明显应激现象,游动平缓正常,水质无变化。其他处理组中鳜在放入后表现为快速游动,尾部摆动幅度较大,鳃盖扩张速率较快,随后游动逐渐减缓,鱼体悬浮静止。其中,在pH=4与pH=10两组的胁迫过程中,鳜体色明显变浅,体表分泌物增多,形成一层灰白色薄膜,水质较为浑浊。在胁迫过程的后期,鳜时而出现乱冲撞现象,鱼体发生微斜,不能保持平衡,眼部稍有凸起。实验过程中没有出现死鱼现象。
2.2 酸碱胁迫对鳜血清pH的影响
pH=7组鳜血清pH较稳定,维持在7.31~7.43,其他各酸碱度处理组中,胁迫3 h后鳜血清pH均发生显著变化。pH=4组的鳜血清pH始终呈持续下降趋势,于72 h达到6.20。pH=5.5组的鳜血清pH呈先下降后上升再下降的变化趋势。pH=8.5组和pH=10组的鳜血清pH呈先上升后下降再上升趋势(表2)。

表2 酸碱胁迫对鳜血清pH的影响
2.3 酸碱胁迫对鳜耗氧率的影响
不同酸碱度胁迫对鳜耗氧率的影响结果如图1所示。组内方差分析结果显示,各实验组间存在极显著性差异。随着胁迫时间的增加,除pH=7组耗氧率变化趋势较为稳定外,其余各实验组耗氧率在12 h后均呈现出先升高再降低的变化趋势,其中,pH=8.5组耗氧率峰值出现在36 h;pH=4、pH=5.5与pH=10组耗氧率峰值均出现在42 h。另外pH=4组其耗氧率在12 h后较同一时段不同pH胁迫组均处于最低的状态。单因素方差分析得出,pH对鳜耗氧率的影响极显著。

图1 不同酸碱度胁迫对鳜耗氧率的影响
2.4 酸碱胁迫对鳜不同组织解毒反应相关基因表达的影响
2.4.1 酸碱胁迫对鳜肝脏组织中解毒基因表达的影响
如图2所示,pH=7组鳜肝脏各相关解毒基因的相对表达量无显著变化,而其余各实验组相关解毒基因的相对表达量在酸碱胁迫过程中呈明显先升高后降低的变化趋势。其中,在酸碱胁迫3 h后,UGT基因与GST基因开始显著升高,胁迫12 h后,CYP450基因与FMO基因开始显著升高,此时GST基因相对表达量达最高值,随后呈下降趋势。在胁迫48 h后,CYP450、FMO与UGT基因相对表达量均达到最高值,至胁迫72 h相对表达量下降,但显著高于pH=7组。
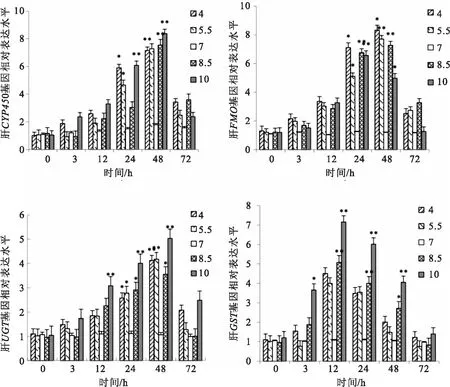
图2 酸碱胁迫对鳜肝脏组织中解毒基因表达的影响
2.4.2 酸碱胁迫对鳜肾脏组织中解毒基因表达的影响
如图3所示,在72 h的酸碱胁迫过程中,pH=7组鳜肾脏各相关解毒基因的相对表达量无显著变化,而其余各实验组相关解毒基因的相对表达量在胁迫过程中呈明显先升高后降低的变化趋势。其中,pH=8.5组与pH=10组各基因相对表达量均在胁迫48 h后达最高值,至胁迫72 h相对表达量下降。胁迫3 h后CYP450基因与UGT基因开始显著升高,胁迫12 h后,FMO基因与GST基因开始显著升高。至胁迫24 h后,pH=5.5组的CYP450基因与FMO基因达到最高值,随后呈下降趋势。

图3 酸碱胁迫对鳜肾脏组织中解毒基因表达的影响
2.4.3 酸碱胁迫对鳜脑中解毒基因表达的影响
如图4所示,在72 h的酸碱胁迫过程中,pH=7组鳜脑部各相关解毒基因的相对表达量无显著变化,而其余各实验组相关解毒基因的相对表达量在胁迫过程中呈明显先升高后降低的变化趋势。胁迫3 h后,除pH=7组外,各实验组相关解毒基因的相对表达量均开始显著升高,至胁迫24 h后,除pH=7外,各实验组UGT基因均达最高值,随后呈下降趋势。胁迫48 h后,CYP450、FMO与GST基因相对表达量均达到最高值,至胁迫72 h后表达量下降。

图4 酸碱胁迫对鳜脑中解毒基因表达的影响
2.4.4 酸碱胁迫对鳜鳃中解毒基因表达的影响
在72 h的酸碱胁迫过程中,pH=7组鳜鳃部各相关解毒基因的相对表达量无显著变化,而其余各实验组相关解毒基因的相对表达量在胁迫过程中呈明显先升高后降低的变化趋势(图5)。胁迫12 h后,除pH=7组外,各实验组相关解毒基因的相对表达量均开始显著升高,至胁迫24 h后,除pH=7外,各实验组UGT基因与GST基因均达最高值,随后呈下降趋势。胁迫48 h后,各实验组CYP450基因与FMO基因相对表达量均达到最高值,至胁迫72 h后表达量下降。

图5 酸碱胁迫对鳜鳃中解毒基因表达的影响
3 讨论
3.1 酸碱胁迫对鳜血清pH的影响

3.2 酸碱胁迫对鳜耗氧率的影响
鱼类的大多数代谢活动都离不开氧的参与,耗氧率能够反应鱼类的生理状况。朱爱意等[24]研究发现,鱼体可以通过改变代谢状况,消耗较多的能量以适应外界环境pH变化,但超出一定范围,耗氧率会降低。例如长鳍篮子鱼(Siganuscanaliculatus)幼鱼在pH=6.0时耗氧率最低,pH=9.0时耗氧率最高[25]。pH值为8.2~9.2时,米诺鱼的耗氧率显著高于其他pH时的水平[26]。本研究中,pH=5.5、8.5、10组中耗氧率在胁迫24 h后均出现上升趋势,且在36~60 h间耗氧率均超过pH=7组,而pH=4组中鳜耗氧率均处于最低状态,说明水体环境pH=5.5~10,鳜通过提高耗氧率、消耗更多的能量来适应酸碱胁迫,而pH4的酸性环境对鳜的耗氧率有强烈的抑制作用。
3.3 酸碱胁迫下鳜不同组织中解毒反应相关基因的表达
对于水体中存在的氨氮、亚硝酸盐、硫化氢等有毒物质,pH的剧烈波动均能够使这些有毒物质毒性加强,从而致使鱼类中毒[27-28]。环境胁迫下的生物将会启动生物体化学防御,通过生物转化过程将各种有机或无机的毒物(包括各种药物、环境毒素和酚类物质等)主动排出体外[29]。具体而言,Ⅰ相酶将有害毒物转化为亲水性的酚或亲电性的苯醌和环氧化物,Ⅱ相酶与之结合,在运输酶的作用下排出体外[10]。研究报道,细胞色素P450等代谢基因能够清除贻贝毒素对大西洋鲑(Salmosalar)的毒害作用[30];GST基因参与去除淡水鱼类微囊藻毒素的过程[31];斑马鱼(Daniorerio)UGT超家族在葡糖醛酸化过程中,使葡糖醛酸与内源或外源底物的羧基、硫基等基团结合形成毒性更低的葡糖苷酸[32];刘雨等[33]在鳜幼鱼的急性氨氮胁迫实验中发现,胁迫初期谷胱甘肽(GSH)基因表达量会出现上调趋势。本研究中,pH=7组中鳜解毒相关基因(CYP450、FMO、UGT、GST)在不同组织中(肝、肾、脑、鳃)的表达量始终无显著变化,其余酸碱胁迫实验组中在胁迫3 h后,不同组织中基因的表达量均出现上调趋势,说明在外源性酸碱的作用下,鳜鱼体内会启动生物体化学防御来维持内环境稳态,且Ⅰ相反应与Ⅱ相反应均具有重要作用;酸碱胁迫24~48 h,基因表达量达到峰值,随后呈下降趋势,这与耗氧率在此时间段内变化趋势相同,说明鳜在去除酸碱胁迫产生的毒性的过程中需要消耗能量;胁迫72 h后,酸碱实验组的基因表达量均出现下调,这可能是因为鳜在此胁迫环境下的逐渐适应;另外,酸度与碱度实验组的基因表达量总体差异不大,这或许与解毒过程中的作用底物类似有关。

