miRNA155在阿霉素诱导乳腺癌上皮间质转化过程中的表达及其作用
佘金铭 车 静 陈聪颖 郭煜晖 崔 蕾
(1.三峡大学 医学院,湖北 宜昌 443002;2.三峡大学 第一临床医学院[宜昌市中心人民医院] 医疗美容科,湖北 宜昌 443003)
乳腺癌是女性最常见的恶性肿瘤,死亡率居女性癌症之首,约90%的乳腺癌相关死因归结于转移[1,2]。上皮间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞在特定的生理和病理情况下向间充质细胞分化的现象[3]。近期研究表明,肿瘤细胞发生EMT伴随miRNA改变,调控miRNA可逆转肿瘤细胞EMT[4]。miRNA是一种非编码小分子RNA,通过与靶mRNA 3'UTR结合,调控mRNA的表达,从而实现对基因的转录后调控[5]。阿霉素可诱导乳腺癌细胞EMT[6],本研究分析了阿霉素诱导MCF-7细胞EMT前后miRNAs分子的表达差异,寻找阿霉素诱导乳腺癌细胞EMT中起关键作用的miRNAs分子,并观察该miRNA对阿霉素耐药及乳腺癌细胞侵袭能力的影响,为临床防治肿瘤细胞EMT提供实验基础。
1 材料和方法
1.1 主要材料
①乳腺癌细胞系及阿霉素:实验用乳腺癌细胞系MCF-7购自武汉大学乳腺癌细胞系资料库;实验用细胞系培养于内含100 U/mL青霉素、0.1 g/L链霉素和10%胎牛血清的DMEM培养基中,于37℃、5% CO2条件下进行培养,每2 d传代1次,所有实验用细胞均处于对数生长期。阿霉素购自上海阿拉丁生化科技股份有限公司。②细胞免疫荧光、Western blot及RT-PCR相关材料:miRNA155反转录引物、miRNA200c荧光定量PCR引物及U6引物均由上海生工技术设计公司合成;反转录试剂盒、实时荧光定量PCR试剂盒、BCA蛋白定量试剂盒、E-cadherin抗体均购自Invitrogen公司。③细胞转染及细胞侵袭实验相关材料:所有质粒均购自ABI公司,LipofectamineTM3000细胞转染试剂购自Invitrogen公司;Transwell小室与细胞培养板由康宁公司生产,Matrigel购于BD公司。
通过检索和收集国内外相关文献,我们成功筛选部分与EMT相关的miRNAs分子,设计miRNA反转录引物及荧光定量PCR引物并由上海生工合成,序列结构如表1。

表1 引物序列表
1.2 实验方法
1.2.1 实验分组
MCF-7细胞分为4组:对照组、阿霉素处理1周组、阿霉素处理2周组和阿霉素处理3周组,阿霉素的处理剂量为10 ng/mL[7]。将细胞置于37℃、5% CO2孵育箱中连续培养72 h后,进行下述实验。
1.2.2 Western blot检测E-cadherin蛋白表达
提取MCF-7细胞总蛋白,BCA法检测蛋白含量,取50 μg含MCF-7细胞蛋白的溶液并加入等量2×SDS上样Buffer,100℃变性10 min,SDS-PAGE电泳、转膜。加入封闭液封闭膜1 h,加入一抗(E-cadherin和兔多克隆抗体,分别按1∶1 000和1∶2 000稀释)4℃冰箱孵育过夜。TBST冲洗3次,加入二抗,室温孵育2 h,ECL化学发光法显色。
1.2.3 免疫荧光检测E-cadherin蛋白表达
将10 ng/mL阿霉素处理3周的MCF-7细胞转至12孔板,每组细胞设4个复孔,多聚甲醛固定,0.3% Triton-X透膜,BSA室温孵育30 min,PBS清洗后控干,一抗4℃孵育过夜,标记荧光二抗室温下孵育2 h。荧光显微镜下观察E-cadherin蛋白的表达情况。
1.2.4 RT-PCR检测MCF-7细胞miRNA155和miRNA200c表达水平
提取MCF-7细胞总RNA进行逆转录,逆转录反应体系为:总RNA 1 μL、miRNA-RT Primer 1 μL、M-MLV 0.5 μL、4×dNTP 1 μL、5×RT Buffer 4 μL,补充反应体系至20 μL。RT-PCR试剂盒检测各组细胞内miRNA155、miRNA200c的表达,PCR反应体系:miRNA逆转录产物1 μL、2×RT-PCR Buffer 20 μL、miRNA Specific Primer Set 1 μL、Taq酶 0.2 μL,补充反应体系至20 μL。以U6作为内参检测细胞内miRNA155及miRNA200c相对表达量,使用ABI 7500 Fast仪扩增并记录Ct值,miRNA相对表达量用2-ΔΔCt表示,实验重复3次。
1.2.5 流式细胞术分析miRNA155转染MCF-7细胞前后细胞的凋亡情况
观察转染miRNA155 mimics后,阿霉素处理MCF-7细胞凋亡作用的差异。取正常培养的MCF-7细胞,将之分为空白对照组和miRNA-155转染组,待细胞融合度接近80%时按照LipofectamineTM3000细胞转染试剂说明书进行转染,孵育24 h后刮取收集细胞,PBS洗2次,并加入70%乙醇4℃固定过夜。离心弃上清,加入Triton X-100及200 μg/mL的RNase A各200 μL,置于37℃恒温箱内15 min,再加入100 μg/mL的PI染料1 mL,室温避光静置15 min,行流式细胞术检测,每份样品检测5 000个细胞,分别检测相应的凋亡情况。
1.2.6 细胞侵袭实验验证miRNA155对MCF-7细胞侵袭能力的影响
取阿霉素处理3周的MCF-7细胞分为4组,分别为空白对照组、对照质粒转染组、空转染组及miRNA155转染组。将Transwell小室放入培养板中,每个Transwell小室上层均包被matrigel,放入37℃培养箱中孵育5 h,将4组细胞分别制备细胞悬液,调整细胞密度至5×105/mL。用无血清培养基清洗matrigel 1次,每孔加入100 μL细胞悬液,下腔室中加入500 μL含血清的培养基,置于37℃培养箱中孵育24 h,取出Transwell用PBS洗2遍,4%多聚甲醛4℃固定,加入1%结晶紫染色10 min,将基质胶下层置于显微镜下观察,选择5个高倍镜视野对细胞进行计数,实验重复3次,计算每个视野下细胞的平均数,绘制柱状图。
1.3 统计学处理
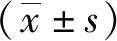
2 结果
2.1 相差显微镜结果
相差显微镜下观察细胞形态,见图1。对照组MCF-7细胞光镜下呈圆形或椭圆形、呈铺路石样,细胞间连接紧密。阿霉素诱导3周后,细胞形态呈梭形及不规则形,类似成纤维细胞,细胞间连接松散。
2.2 阿霉素对E-cadherin蛋白表达的影响
Western blot检测细胞内E-cadherin蛋白表达,见图2。与对照组相比,阿霉素不同时间处理组E-cadherin表达均明显低于对照组,且随阿霉素处理时间增加,E-cadherin表达逐渐降低(均P<0.05)。结果提示阿霉素可下调E-cadherin表达,并随时间延长作用增强。
2.3 细胞免疫荧光结果
图3中免疫荧光结果显示,10 ng/mL阿霉素培养3周后细胞形态发生明显变化,由典型上皮逐渐变为梭形及不规则形,类似肌成纤维细胞,与对照组相比,阿霉素组E-cadherin免疫荧光表达明显降低。
2.4 RT-PCR检测阿霉素诱导MCF-7细胞EMT前后miRNA155表达水平
RT-PCR检测MCF-7细胞内miRNA155表达水平(见图4),结果表明,阿霉素处理3周后miRNA155表达水平显著提高,同为EMT相关的miRNA200c表达并无明显改变,提示miRNA155可能参与阿霉素诱导的MCF-7细胞EMT过程。
2.5 miRNA155对阿霉素耐药性的影响
为评估miRNA155对阿霉素耐药性的影响,我们通过转染miRNA155 mimics,建立miRNA155高表达瞬转模型,流式细胞仪检测乳腺癌MCF-7细胞凋亡。阿霉素(10 ng/mL)处理24 h后,发现转染miRNA155 mimics组细胞存活数高于对照组(见图5)。分别刮取收集两组细胞,行流式细胞术检测凋亡,结果表明,miRNA155高表达组凋亡峰小于对照组,提示miRNA155可能抑制ADM诱导MCF-7细胞凋亡。
2.6 miRNA155对MCF-7细胞侵袭能力的影响
为进一步验证miRNA155对MCF-7细胞侵袭能力的影响,应用Transwell实验检测各组MCF-7细胞生物学行为情况(见图6),结果发现miRNA155 mimics转染组细胞穿透数小于空白对照组、对照质粒转染组及空转染组,其侵袭能力显著降低(均P<0.05),提示miRNA155可能抑制乳腺癌MCF-7细胞的侵袭。
3 讨论
乳腺癌作为女性常见恶性肿瘤,严重危害女性身体健康,即便在开展乳腺癌筛查的地区,乳腺癌发病率仍仅次于肺癌[8]。乳腺癌是一种具有高度浸润和转移能力的肿瘤,炎症因子、缺氧、放疗、化疗等均可诱导乳腺癌细胞的浸润转移[9]。肿瘤转移是一连续复杂的动态生物学过程,与EMT密切相关。表现为上皮细胞标志性表型蛋白E-cadherin表达下降,肿瘤细胞间黏附能力下降,并伴随细胞形态改变、细胞外基质降解及细胞信号传导通路异常等[10,11]。原发部位肿瘤细胞经EMT后获得迁移及侵袭能力,而间质上皮转化在肿瘤转移的最后一步中起重要作用,即从血管或淋巴管中渗出的肿瘤细胞恢复到上皮细胞状态,增殖形成继发性肿瘤[12]。
阿霉素作为临床上首个使用的蒽环类抗癌药,对乳腺癌具有良好的治疗效果,但化疗药物在有效清除肿瘤细胞的同时亦可引起肿瘤细胞恶性程度增加,研究发现阿霉素在肿瘤治疗过程中常引起耐药和肿瘤细胞转移而致其疗效降低[13]。本研究结果表明阿霉素在处理剂量为10 ng/mL时,随作用时间延长,乳腺癌细胞E-cadherin表达下降,EMT程度增加,提示EMT参与了阿霉素诱导的耐药过程。
国内外研究发现,miRNA分子与乳腺癌的形成、浸润、转移、耐药密切相关。miRNA200家族是最早发现参与肿瘤细胞EMT调控的miRNA分子,其低表达可促进EMT[14,15]。由于miRNAs分子的表达具有组织和时相特异性,同一个miRNA分子在不同组织中所起的作用并不相同,如miRNA200a、miRNA200c在乳腺癌、结肠癌中低表达可以促进EMT形成,高表达miRNA200a、miRNA200c可逆转EMT,但在黑色素细胞瘤中miRNA200a、miRNA200c高表达可以促进EMT[16-18]。本研究结果提示miRNA200c可能不参与阿霉素诱导的乳腺癌EMT过程。
本研究发现在乳腺癌EMT过程中miRNA155表达水平升高,提示miRNA155可能参与乳腺癌细胞EMT的发生发展。体外实验表明miRNA155上调可促进乳腺癌细胞增殖,动物实验也验证了miRNA155促进肿瘤增殖的作用[19]。通过miRNA155靶基因预测和实验验证,miRNA155可能通过抑制FOXO3a表达和磷酸化活化,从而促进乳腺癌细胞的浸润转移[20]。另有研究提示miRNA155通过抑制抑癌基因TP53表达,从而抑制细胞凋亡并诱导耐药产生[21]。在肿瘤免疫调控方面,miRNA155缺失可导致TH17细胞分化异常,TH17细胞是抗原驱动的记忆T细胞,参与慢性炎症诱导恶性肿瘤的转化,在幽门螺杆菌感染胃上皮细胞的胃癌模型中可观察到miRNA155高表达,在胃癌组织中miRNA155亦呈高表达[22]。通过分析乳腺癌和周围组织中miRNA155的表达水平,发现癌组织中miRNA155表达高于癌旁组织,该结果提示miRNA155可能为肿瘤演进过程中重要的标志分子[23]。虽然miRNA155作为oncomiR可促进肿瘤的转移,然而近年来,在某些肿瘤中,相继有关于miRNA155逆转EMT过程、发挥抑瘤作用的报道。Liu等[24]研究发现miRNA155能明显抑制大肠癌细胞的增殖、迁移和侵袭。另有研究表明miRNA155通过调控肿瘤相关巨噬细胞的成纤维细胞生长因子-2(fibroblast growth factor-2,FGF-2)的表达从而抑制食管癌细胞的增殖,并通过抑制血管形成降低食管癌细胞的侵袭及迁移能力[25]。在本实验中,我们研究过表达miRNA155对MCF-7细胞侵袭能力的影响,并以一线化疗药物阿霉素作用于MCF-7细胞,观察瞬转miRNA155 mimics与对照组细胞凋亡的生物学行为,结果表明外源转染miRNA155可增加阿霉素的耐药性、抑制乳腺癌的侵袭能力。究竟是何机制使miRNA155在不同肿瘤中的作用存在差异还有待于进一步研究。
化疗药物阿霉素诱导乳腺癌耐药过程中,EMT发挥了重要作用。该过程中miRNA155高表达提示miRNA155可能是乳腺癌演进、耐药的一个重要标志分子,检测其表达可作为评估乳腺癌预后的一个潜在指标。此外,miRNA155可能参与了乳腺癌EMT过程,其过表达可能增加阿霉素的耐药性,但减弱乳腺癌的侵袭能力。

