腹泻型肠易激综合征患者体内CD4+T淋巴细胞亚群的分布及其诊断意义▲
李毓玲 张 国 梁运啸 农 兵 梁列新 郭先文
(广西壮族自治区人民医院消化内科,南宁市 530021,电子邮箱:1015886762@qq.com)
肠易激综合征(irritable bowel syndrome,IBS)是一种临床常见的功能性肠病,主要表现为慢性或复发性腹痛、大便性状和排便习惯异常。该病在西方国家的患病率达22%,在我国的患病率也逐年升高[1-2]。根据临床症状可将IBS分为腹泻型、便秘型、混合型和未定型,临床上以腹泻型肠易激综合征(diarrhea irritable bowel syndrome,IBS-D)最常见,但其诊断主要依赖以症状学为主的罗马Ⅳ诊断标准[3],缺乏特异性的实验室指标,导致临床诊治难度大。精准诊治有赖于对疾病发病机制的详尽认识,然而IBS-D的发病机制目前仍未明确。研究表明,基于脑-肠轴的“神经-免疫-内分泌网络”参与IBS-D的发病,其中免疫活化起着重要作用[4]。有学者发现,IBS患者外周血及肠黏膜中T淋巴细胞增多提示适应性免疫激活[5-6];IBS-D患者肠黏膜中T淋巴细胞等免疫细胞浸润增多,也证实了免疫炎症在IBS-D发生与发展的过程中的重要性[7]。在IBS-D患者肠黏膜中明显增加的T淋巴细胞以CD4+、CD3+、CD8+细胞为主[8]。其中CD4+辅助性T细胞(T help cell,Th)活化导致免疫激活,影响IBS-D的发生和发展[8]。在功能上CD4+Th细胞可分化为多种细胞亚群,包括 Th1、Th2、Th17和最近发现的Th22细胞,它们分别选择性表达干扰素γ、白细胞介素(interleukin,IL)-4、IL-17和IL-22[9],但是目前关于这些CD4+T淋巴细胞亚群与IBS-D的研究甚少。本研究探讨CD4+T淋巴细胞亚群在IBS-D患者中的分布及其对IBS-D的临床诊断效能,以期为临床上遴选出可靠的诊断标记物提供参考。
1 资料与方法
1.1 临床资料 选取2018年11月至2019年4月在本院诊断为IBS-D的30例患者作为IBS-D组。纳入标准:(1)IBS-D诊断符合罗马Ⅳ诊断标准[3],病程至少2年;(2)年龄18~65周岁,男女不限;(3)既往无癌症、炎症性肠病、结缔组织病、代谢性疾病及其他器质性疾病史;(4)无胃肠道手术史者;(5)无哮喘等过敏性疾病,近1个月内未服用抗过敏药、非甾体类消炎药及未饮酒者;(6)纳入研究后随访3个月,期间仍符合罗马Ⅳ诊断标准。排除标准:(1)结肠镜检查发现器质性病变;(2)妊娠或哺乳期女性。另选取同期20例体检健康者作为对照组。纳入标准:(1)年龄18~65周岁,男女不限;(2)排除腹部急慢性疼痛、肠道急慢性感染及IBS;(3)无哮喘等过敏性疾病,近1个月内未使用抗过敏药、非甾体类消炎药及未饮酒;(4)常规体检结果无异常;(5)结肠镜检查未发现器质性病变。排除妊娠或哺乳期女性。两组研究对象的一般情况比较,差异无统计学意义(P>0.05),见表1。研究对象均自愿参与本研究,并签署知情同意书。本研究已经过我院医学伦理委员会审查批准。

表1 两组研究对象的一般情况比较
1.2 主要试剂和仪器 200目细胞过滤筛网(Solarbio公司,批号:XBGLS200),流式细胞仪(美国BD Biosciences公司,型号:BD FACSCantoⅡ),离心机(美国Eppendorf公司,型号:TDZS-WS),培养箱(美国Thermo Scientific公司,型号:forma37),生物安全柜(上海力申科学仪器,型号:HFsafe-1200A2)。1×磷酸盐缓冲液(phosphate buffered saline,PBS;Solarbio公司,批号:P1020-500),胶原酶D(美国Roche Diagnostics公司,批号:11088866001),二硫苏糖醇(美国Sigma公司,批号:20200902),淋巴细胞分离液(Ficoll-PaqueTMPLUS GE公司,批号:17-1440-03),新鲜胎牛血清(美国Gibco公司,批号:10099-13),台盼蓝(美国Gibco公司,批号:15250-061),青霉素+链霉素(美国Gibco公司,批号:15140-122),淋巴细胞刺激剂(美国eBioscience公司,批号:00-4975-93),固定破膜剂(美国BioLegend公司,批号:554714)。荧光抗体包括异硫氰酸荧光素抗人CD4抗体、别藻蓝蛋白抗人IL-22抗体、藻红蛋白抗人IL-17抗体、别藻蓝蛋白抗人IL-4抗体、藻红蛋白-花青素抗人干扰素γ抗体均购自美国eBioscience公司(批号:MA1-19603、12-7229-41、12-7169-42、17-7049-42、25-7319-41)。广谱链霉素抗生物素蛋白-过氧化物酶免疫组化检测试剂盒(北京博奥森生物技术有限公司,批号:SP-0022),免疫组化抗体兔抗人IL-22多克隆抗体(北京博奥森生物技术有限公司,批号:bs-2623R)。
1.3 方法
1.3.1 外周血单个核细胞提取:使用真空肝素钠抗凝管采集患者空腹时前臂静脉血约3mL,取2 mL肝素抗凝血与PBS等体积混合后,采用淋巴细胞分离液密度梯度离心法收集外周血单个核细胞。
1.3.2 肠黏膜固有层单个核细胞提取:参照Hart 等[10]的方法提取肠黏膜固有层单个核细胞。常规电子结肠镜检查时(操作前一晚7点及当天早晨7点患者口服稀释后的磷酸钠盐口服液清肠)内镜直视下用同一型号活检钳随机、多点采取结肠黏膜组织(升结肠2块、横结肠2块):1块置于浓度为10%的中性福尔马林液中,3块置于放有冰冷的1×PBS的培养皿中,用10 mL注射器将肠腔粪便冲洗干净后,转移至含青霉素、链霉素的RPMI 1640培养基中。将活检组织放入10 mL含1 mmol/L二硫苏糖醇和1 mmol/L乙二胺四乙酸的(不含有钙和镁离子)平衡盐溶液中,去除黏液和上皮细胞。处理后的组织转入10 mL含1 mg/mL胶原酶D的RPMI 1640培养基中,37℃水浴消化1.5~2 h,采用淋巴细胞分离液密度梯度离心法收集肠黏膜固有层单个核细胞。0.2%台盼蓝拒染实验检测,细胞活性≥95%。
1.3.3 细胞因子检测:在含有肠黏膜或外周血单个核细胞的培养基中加入细胞刺激剂(每1 mL培养基中加2 μL),37℃ 孵育4 h,用异硫氰酸荧光素抗人CD4抗体进行细胞表面标记,经固定破膜后进行细胞内细胞因子荧光染色标记。使用流式细胞仪,采用四色流式细胞术检测细胞比例。细胞表面表达CD4分子时,若细胞内表达IL-22则为Th22细胞,若细胞内表达IL-17则为Th17细胞,若细胞内表达IL-4则为Th2细胞,若细胞内表达干扰素γ则为Th1细胞;采用双盲法进行结果分析。
1.3.4 苏木精-伊红染色:取肠黏膜活检组织,用10%甲醛固定,石蜡包埋,4 μm连续切片,进行苏木精-伊红染色,由病理科医生采取盲法进行组织病理学诊断,诊断标准参照文献[11]。
1.3.5 免疫组化染色:将制作好的石蜡切片置于65℃烘箱中,烘烤切片2 h,常规二甲苯、酒精脱蜡至水化,用pH为7.4的PBS冲洗3次,3 min/次。于3%过氧化氢中孵育10 min,PBS液洗3次,3 min/次,滴加山羊血清封闭液,置室温封闭30 min,除去多余液体,滴加浓度为 1 ∶200 的兔抗人IL-22多克隆抗体50 μL,37℃恒温孵育1 h,PBS 液洗 3 次,3 min/次,滴加酶标单抗鼠/兔IgG聚合物 50 μL,3,3-二氨基联苯胺显色、苏木素复染、脱水、固定、封片、镜检。用PBS代替一抗做阴性对照。免疫组化结果定性判断标准:光镜下观察到IL-22的阳性染色主要位于胞质内,为棕黄色颗粒沉积。免疫组化结果定量判断标准:高倍镜下(×400)随机选取互不重叠的3个视野,用专业图像分析软件 Image-ProPlus 6.0测定每个视野阳性染色的光密度平均值[光密度平均值=累积光密度值/(除去空白部分)视野面积],取其平均值作为IL-22的表达水平。
1.4 观察指标 记录两组研究对象肠黏膜中Th22细胞的比例,外周血中Th22细胞、Th17细胞、Th2细胞、Th1细胞的比例,肠黏膜病理切片苏木精-伊红染色结果,肠黏膜中IL-22表达水平。入组后行肠镜检查前采用IBS症状严重程度量表(IBS Symptom Severity Scale,IBS-SSS)[12]评分、胃肠道症状分级量表(Gastrointestinal Symptom Rating Scale,GSRS)[13]评分评价两组研究对象的病情严重程度,其中IBS-SSS 包括IBS症状对日常生活的困扰、腹胀的严重程度、腹痛的严重程度、腹痛的频率以及对大便情况的满意度。得分范围从0分(无症状)到500分(最大严重程度)。GSRS 包括上腹痛、胸部不适、反酸、饥饿痛、恶心、肠鸣音、腹胀、咽喉部不适、口气、便秘、腹泻、大便稀、大便干结、有便意需立即排便、里急后重。每项按0分(完全没有)~6分(特别严重)进行评分。分析CD4+T淋巴细胞亚群比例及肠黏膜中IL-22水平与IBS-SSS评分、GSRS评分的相关性。
1.5 统计学分析 采用SPSS 20.0软件进行统计学分析。正态分布的计量资料用(x±s)表示,比较用t检验;非正态分布的计量资料用[M(P25,P75)]表示,比较采用秩和检验;计数资料以例数或百分比表示,比较采用χ2检验;相关性分析采用Pearson相关分析;采用受试者工作特征(receiver operating characteristic,ROC)曲线评价CD4+T淋巴细胞亚群比例及肠黏膜中IL-22水平对IBS-D的诊断效能。以P<0.05表示差异有统计学意义。
2 结 果
2.1 两组肠黏膜病理切片苏木精-伊红结果 IBS-D组患者的肠黏膜结构完整,腺体结构正常,但肠黏膜固有膜层中炎症细胞增多,以单个核细胞为主,表现为非特异性炎症。对照组未见明显病理学异常。见图1。

图1 两组肠黏膜病理学的改变(苏木精-伊红染色,×200)
2.2 两组肠黏膜Th22细胞比例和IL-22水平的比较 IBS-D组患者肠黏膜的Th22细胞比例和IL-22水平均高于对照组(P<0.05)。见表2、图2和图3。

表2 两组肠黏膜Th22细胞比例和IL-22水平的比较[M(P25,P75)]
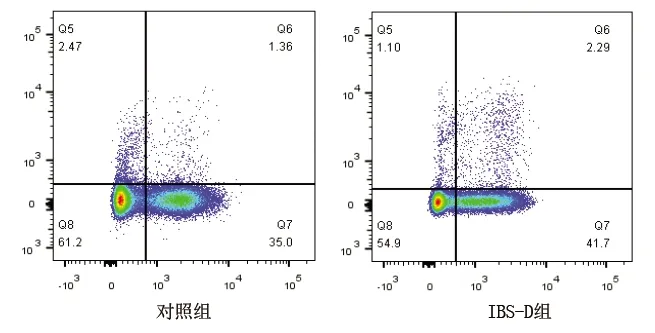
图2 两组肠黏膜Th22细胞比例四色流式细胞术散点图

图3 两组肠黏膜组织IL-22免疫组化图(免疫组化染色,×400)注:IL-22的阳性染色主要位于胞质内,为棕黄色颗粒沉积。
2.3 两组外周血CD4+T淋巴细胞亚群比较 IBS-D组患者外周血Th17细胞比例高于对照组(P<0.05);而两组间Th22细胞、Th1细胞和Th2细胞比例差异无统计学意义(P>0.05)。见表3、图4。

表3 两组外周血CD4+T淋巴细胞亚群比较(x±s,%)
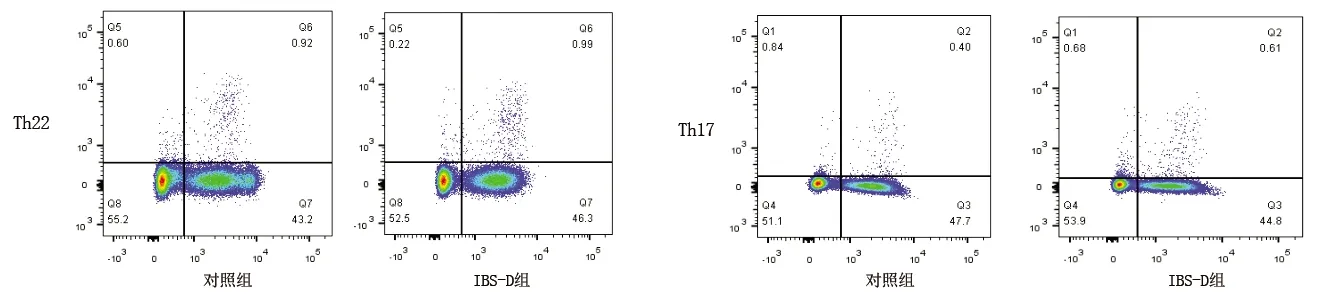

图4 两组外周血CD4+T淋巴细胞亚群四色流式细胞术散点图
2.4 CD4+T淋巴细胞亚群比例、IL-22水平与IBS-SSS评分、GSRS评分的关系 肠黏膜Th22细胞比例、IL-22水平和外周血Th22细胞、Th17细胞比例与IBS-SSS评分、GSRS评分呈正相关(P<0.05),而外周血Th2细胞、Th1细胞比例与IBS-SSS评分、GSRS评分无明显相关性(P>0.05)。见表4和表5。

表4 肠黏膜Th22细胞比例、IL-22水平与IBS-SSS评分、GSRS评分的关系

表5 外周血CD4+T淋巴细胞亚群与IBS-SSS评分、GSRS评分的关系
2.5 CD4+T淋巴细胞亚群比例、IL-22水平对IBS-D的诊断效能 肠黏膜Th22细胞比例、IL-22水平和外周血Th22、Th17、Th2、Th1细胞比例诊断IBS-D的临界值分别为0.955%、0.182、0.795%、0.625%、1.195%、7.290%,ROC曲线下面积分别为0.893、0.839、0.733、0.738、0.581、0.651。见图5、表6。

图5 CD4+T淋巴细胞亚群、IL-22水平对IBS-D的诊断效能

表6 CD4+T淋巴细胞亚群、IL-22水平对IBS-D的诊断效能
3 讨 论
IBS是一种常见的功能性肠病,全球患病率约为5%~15%,且逐年上升[3],我国IBS患病率约为5.7%[14]。临床上以IBS-D最为常见,但其诊断主要依赖以症状学为主的罗马Ⅳ诊断标准,该诊断标准主观性较强,容易造成误诊或者漏诊,因此,寻找一种诊断效能较高的生物学标记物是目前IBS临床诊疗面临的挑战之一。近年来,随着研究的深入,免疫应激在IBS发生发展过程中的作用越来越明确,炎症细胞及其效应因子有望成为诊断IBS-D的有效生物学标记物。研究证明,IBS-D患者存在肠道低度慢性炎症[15],90%患者的肠肌神经丛内有少量淋巴细胞浸润[16]。另有研究发现,IBS患者肠黏膜内T淋巴细胞数量增多,且黏膜固有层免疫活性细胞也增多,这一变化在IBS-D患者中更为明显[17]。研究表明,IBS-D患者肠黏膜固有层中以CD4+T淋巴细胞浸润增多为主[18],CD4+Th细胞活化导致免疫激活,影响IBS-D的发生发展[8]。
本研究结果显示,IBS-D组患者肠黏膜的Th22细胞比例及IL-22水平均高于对照组,且与IBS-SSS评分、GSRS评分呈正相关(P<0.05),其诊断IBD-D的ROC曲线下面积分别为0.893、0.839,灵敏度分别为86.7%、83.3%,特异度分别为80.0%、75.0%,提示Th22细胞比例及IL-22水平与IBS-D患者的腹痛、腹泻等症状密切相关,且对IBS-D具有较高的诊断效能。而IBS-D组外周血Th22细胞比例与对照组差异无统计学意义(P>0.05)。其原因可能是IBS-D患者的免疫激活仅仅存在于肠道,而非全身性[19]。Th22细胞是CD4+T细胞的另一新亚群,其主要通过分泌 IL-22 发挥作用。IL-22信号通路在黏膜免疫防御及组织再生中发挥多种作用[20]。目前,Th22细胞及IL-22已被证实与过敏性疾病、自身免疫性疾病、肿瘤等疾病的发生发展密切相关[21-23]。在机体内IL-22主要通过与其受体结合发挥生物学作用,研究证实消化道表达IL-22受体1链为IL-22的主要作用靶点[24]。有研究报道,肠道存在炎症时,小肠上皮细胞在IL-22的诱导下可生成黏蛋白等相关蛋白以抵御病原菌感染,从而减少肠道损害[25];同时,IL-22会通过信号传导和转录激活因子3信号通路重塑杯状细胞和促进上皮细胞再生,从而阻止有害微生物侵及上皮层;结肠中IL-22的过表达可促进杯状细胞再生和黏液分泌,减少共生细菌易位,从而达到保护结肠上皮细胞的效果[26-27]。Leppkes等[28]将IL-22缺陷的T细胞和野生型T细胞分别转移至重组激活基因1缺陷的小鼠体内,前者可导致严重的结肠炎,这进一步证实了IL-22在肠道炎症中具有保护作用。
本研究结果还显示,IBS-D组患者外周血Th17细胞比例高于对照组(P<0.05),其诊断IBD-S的ROC曲线下面积为0.738,灵敏度为62.5%,特异度为53.3%,提示外周血Th17对IBS-D的诊断效能较低,与既往研究结果相似[19]。Th17细胞主要通过分泌IL-17来发挥调节固有免疫的作用,IL-17还可联合干扰素γ促进单核细胞趋化蛋白1等趋化因子的分泌,进一步破坏肠黏膜屏障[29]。干扰素γ又是Th1细胞的特异效应因子。研究证实,高浓度干扰素γ通过破坏肠黏膜上皮细胞紧密连接的通透性,引起肠黏膜屏障受损,进而导致水钠吸收功能障碍,出现腹泻等临床症状[30]。与此相反,Th2细胞通过分泌IL-4起到抑制炎症发生和发展的作用[31]。实验研究显示,用表达IL-4的重组5型腺病毒载体来治疗由三硝基苯磺酸诱发的结肠炎,可明显地减少肠道黏膜的损伤[32]。由此看来,Th17细胞和Th1细胞主要发挥促进肠道炎症的作用,而Th2细胞则发挥抑制肠道炎症的作用。但是本研究结果显示,两组间外周血Th1细胞和Th2细胞比例差异无统计学意义(P>0.05),这表明IBS-D患者的全身免疫激活状态不明显,也许仅仅存在于肠道局部。今后需要进一步探究Th17细胞、Th1细胞和Th2细胞在肠黏膜的分布情况。
综上所述,IBS-D患者肠黏膜Th22细胞及其效应因子IL-22水平增高,两者均与IBS-D患者的肠道症状密切相关,且对IBS-D具有较高的诊断效能,这或可为寻找诊断IBS-D的生物学标记物提供新的思路。

